观光木果实黄酮类成分的初步鉴定及抗氧化活性分析
2021-12-28罗佳马若克符韵林韦鹏练
罗佳 马若克 符韵林 韦鹏练
摘 要:为探究观光木果实纯化后黄酮的纯度、抗氧化活性以及黄酮类物质的结构,本文采用D101大孔树脂和不同体积分数的乙醇对观光木果实的黄酮类化合物进行纯化,得到5个洗脱物,分别为水洗脱物、10%洗脱物、30%洗脱物、50%洗脱物和70%洗脱物,研究洗脱物黄酮纯度以及对1,1-二苯基-2-三硝基苯肼(DPPH)和2,2-联氮-双-3-乙基苯并二氢噻唑啉-6-磺酸(ABTS)的清除能力,通过傅里叶变换红外光谱仪(FT-IR)进行初步结构表征,进一步使用超高效液相色谱串联四极杆-静电场轨道阱高分辨质谱仪联用技术 (Q-EXCTIVE-MS)鉴定纯化后洗脱物的组成和结构。结果表明,30%洗脱物黄酮纯度最高,且DPPH和ABTS的清除能力最强,半抑制质量浓度分别为106.95、71.57 mg/L。傅里叶变换红外光谱仪显示样品含有羟基、酚羟基、CO以及甲基等黄酮类特征官能团,对纯化后的果实进行UPLC分析,共鉴定出5种黄酮类化合物,分别为4′,5,6,7-四甲氧基黄酮、三叶豆苷、异鼠李素-3-O-葡萄糖苷、异金雀花素、橘皮素。DPPH和ABTS抗氧化试验表明纯化后的观光木果实具有较好的抗氧化能力,研究可为观光木的保护和资源利用提供一定的参考。
关键词:观光木;黄酮;傅里叶变换红外光谱仪;抗氧化活性;化学成分
中图分类号:S792.11 文献标识码:A 文章编号:1006-8023(2021)06-0053-09
Abstract:To explore the purity of flavonoids, antioxidant activity and the structure of flavonoids after purification of T. odorum fruit, D101 macroporous resin and different concentrations of ethanol were used to purify the flavonoids of the determined T. odorum fruit, and 5 eluates were obtained, namely, water eluate, 10% eluate, 30% eluate, 50% eluate and 70% eluate, the eluate flavonoid purity and the scavenging ability of 1,1-diphenyl-2-picrylhydrazyl (DPPH) and 2, 2 -azino-bis (3-ethylbenzothiazoline-6-sulfonic acid) (ABTS) were studied. Preliminary structural characterization was carried out by Fourier infrared spectroscopy (FT-IR), and the composition and structure of the purified eluate were further identified using ultra performance liquid chromatography mass Spectrometry (Q-EXCTIVE-MS). The results showed that the 30% eluate had the highest purity of flavonoids and the strongest scavenging ability of DPPH and ABTS. The half-inhibitory concentrations were 106.95 mg/L and 71.57 mg/L, respectively. Fourier infrared spectroscopy showed that the sample contained characteristic functional groups of flavonoids such as hydroxyl, phenolic hydroxyl, CO and methyl. UPLC analysis of the purified fruit revealed a total of 5 flavonoids, 4 , 5, 6, 7-tetramethoxyflavonoids, trifolin, isorhamnetin-3-O-glucoside, isoscoparin, tangeretin. The antioxidant tests of DPPH and ABTS showed that the purified T. odorum fruit had good antioxidant capacity, which provided a certain reference for the protection and resource utilization of T. odorum.
Keywords:Tsoongiodendron odorum; flavonoids; Fourier transform infrared spectroscopy; antioxidant activity; chemical constituents
0 引言
觀光木(Tsoongiodendron odorum)又名香花木,是我国珍稀濒危树种,主要分布地区为广东、广西、海南、贵州和福建[1]。观光木树形优美,分枝整齐,花多而美观,叶和果也具有一定的特色,常用于园林观赏树种和行道树种[2]。其木材纹理通直,材质优良,易加工,不易开裂,多用于建筑和家具,是较好的用材树种[3],树皮和根皮在民间被用于治疗癌症[4]、木材材性[8]以及群落结构[9-10]等,关于其化学成分和生物活性的研究较少。
黄酮类化合物广泛存在于植物中,具有较强的抗氧化活性和抗炎活性,还能抑制肿瘤生长。大量研究证明木兰科植物也具有抗肿瘤活性、抗真菌活性、抗炎活性和抗氧化活性的效果[11-14],可供药用。了解观光木的化学成分对于主动保护观光木以及开发利用药用价值有重要的意义。因此,本研究以观光木的果实为研究对象,采用D101型大孔树脂和不同体积分数的乙醇进行洗脱和纯化,并探究不同洗脱物的抗氧化能力,采用傅里叶红外光谱仪对纯化后的洗脱物进行初步结构表征,并进一步利用超高效液相色谱串联四极杆-静电场轨道阱高分辨质谱仪联用技术(Q-EXACTIVE-MS)鉴定黄酮类化学成分,为提高观光木的利用价值以及后续观光木果实黄酮类化合物开发创新和分离提供一定的参考。
1 材料与方法
1.1 材料与试剂
观光木果实于2019年11月采自广西壮族自治区南宁市良凤江国家森林公园试验林区,将果实自然风干,用磨粉机磨碎,过40~60目筛,备用。
1.2 仪器与设备
超高效液相色谱质谱联用仪( Q-EXCTIVE-MS,美国热电公司);傅里叶变换红外光谱仪(IRTracer-100,岛津公司);B电子天平(SA124S-CW,赛多利斯科学仪器有限公司);粉碎机(DFT-200,温岭市林大机械有限公司);可见紫外分光光度计(SP∶754,上海光谱有限公司)。
1.3 实验方法
1.3.1 黄酮的提取与纯化
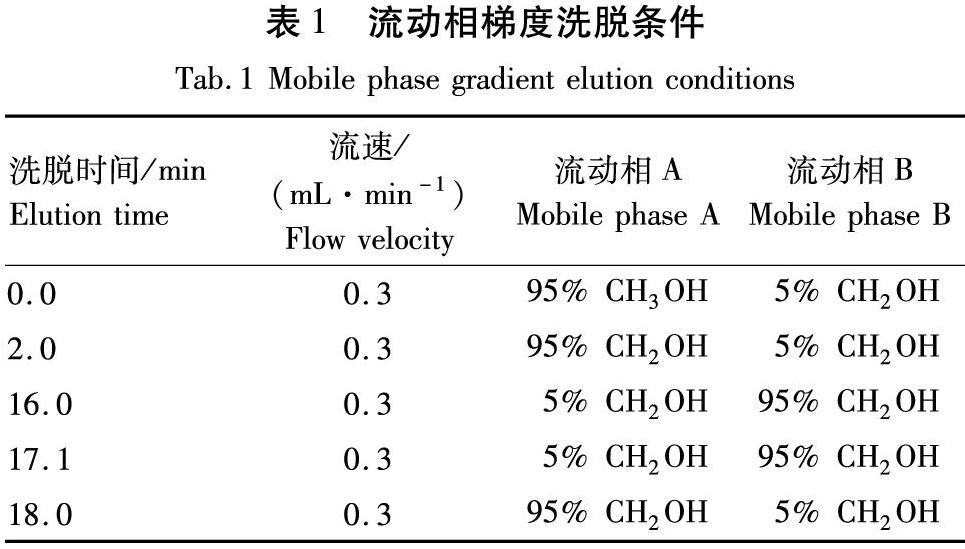
采用80%乙醇回流提取3次 ,第1次5倍量提取2 h,第2次4倍量提取2 h,第3次4倍量提取2 h,提取液合并过滤浓缩至无醇味,加水稀释至提取物的3倍,静置过夜,400目绒布过滤,滤液上处理好的D101大孔吸附树脂,树脂用量为提取物的3倍。径高比为1∶8,先用蒸馏水冲洗至无色,再分别用2倍柱体积水、10%乙醇、30%乙醇、50%乙醇和70%乙醇进行洗脱,分别收集洗液,真空浓缩干燥即得到不同乙醇洗脱物。
1.3.2 芦丁标准曲线的绘制
参考王俊青等[15]研究方法。
1.3.3 纯化后黄酮化合物纯度的计算
取大孔树脂纯化后黄酮粉末各0.050 g 放入10 mL容量瓶中,用70%的乙醇定容,得到质量浓度为5 mg/L的黄酮类化合物标准溶液;取适量黄酮溶液加入0.3 mL的5% NaNO2 溶液,摇匀,静置6 min,再加入0.3mL的10%AlCl3 溶液,摇匀,静置6 min,最后再加入4 mLNaOH 溶液,用70%乙醇定容至10 mL,摇匀,静置15 min,在波长为510 nm 处测定上述样品溶液的吸光度,将所得吸光度带入建立的回归方程中,得到纯化后黄酮类物质的质量纯度。
1.3.4 DPPH法测定黄酮类物质的抗氧化活性
参考何礼等[16]研究方法。取3 mL不同浓度的样品溶液,加入3 mL的2×10-4mol/L DPPH(1,1-二苯基-2-三硝基苯肼),混合均匀,避光反应30 min,以无水乙醇为空白测吸光度A1;3 mL不同浓度的样品溶液和3 mL无水乙醇的吸光度为A2; 3 mLDPPH溶液和3 mL无水乙醇的吸光度为A3,在517 nm波长下分别测其吸光度。计算IC50值,即DPPH清除率达到50%时各组分样品的质量浓度。IC50值越小,则表示其DPPH自由基清除能力越强。
1.3.5 ABTS法测定黄酮类物质的抗氧化活性
参考王富豪等[17]研究方法。取1 mL不同质量浓度的样品溶液,加入4 mL ABTS(2,2-联氮-双-3-乙基苯并二氢噻唑啉-6-磺酸)溶液,混合均匀,避光反应15 min,以无水乙醇为空白,吸光度为B1;1 mL不同质量浓度的样品溶液和4 mL无水乙醇的吸光度为B2; 4 mLABTS溶液和1 mL无水乙醇的吸光度为B3,在734 nm波长下分别测其吸光度。计算IC50值,即ABTS清除率达到50%时各组分样品的质量浓度。IC50值越小,则表示其ABTS自由基清除能力越强。
1.3.6 红外光谱分析
取適量芦丁和纯化后样品分别与溴化钾混合后压片,在500~4 000 cm-1范围内扫描[18]。
1.3.6 超高效液相色谱-串联质谱鉴定观光木果实中黄酮类成分
采用Q-EXACTIVE-MS对黄酮化学成分进行鉴定。超高效液相色谱条件:色谱柱为ACQUITY UPLCBEHC18(2.1 mm×50 mm×1.7 μm)。流动相:A为0.1%甲酸水,B为甲醇,柱温为30 ℃,进样体积为1 μL,梯度洗脱见表1。
高分辨质谱条件:采用ESI 离子源;温度300 ℃;传输毛细管温度320 ℃;鞘气206 kPa;辅助气流速69 kPa;正离子模式下喷雾电压为3.0 kV;扫描模式为Full MS和Full MS/dd-MS2,质量范围100~1 000 ua,一级扫描和二级扫描分辨率分别为70 000、17 500。
1.4 数据处理
每个样品重复3次实验,采用IBM SPSS Statistics 19统计分析软件计算IC50值,采用Origin绘图。
2 结果与分析
2.1 观光木果实总黄酮标准曲线
以芦丁质量浓度为横坐标,吸光度为纵坐标,拟合曲线,得到芦丁质量浓度和吸光度之间的回归方程:y=0.009 5x+0.004 1, 相关系数R2=0.999 7。
2.2 黄酮纯度
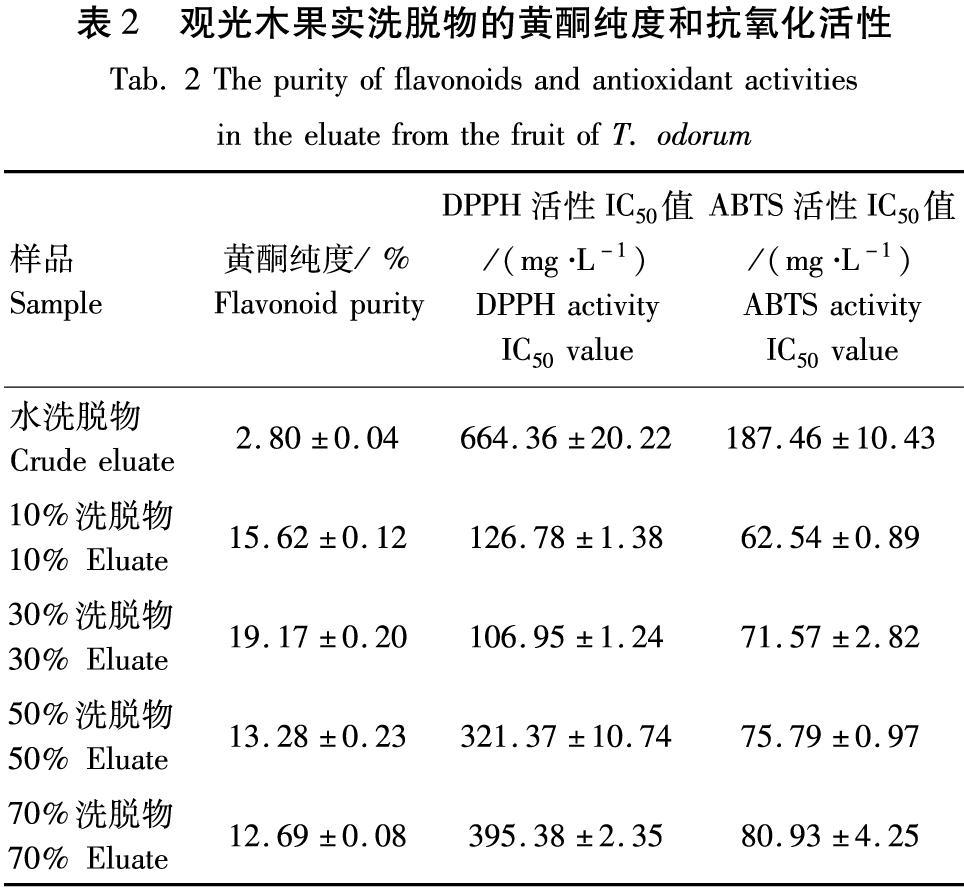
观光木果实经D101大孔树脂和不同体积分数乙醇洗脱后得到5个洗脱物,其黄酮纯度见表2。30%洗脱物中黄酮纯度最高,水洗脱物黄酮纯度最低,初步认为30 %乙醇对观光木果实的黄酮类物质具有较强的富集效果。
2.3 DPPH自由基清除能力
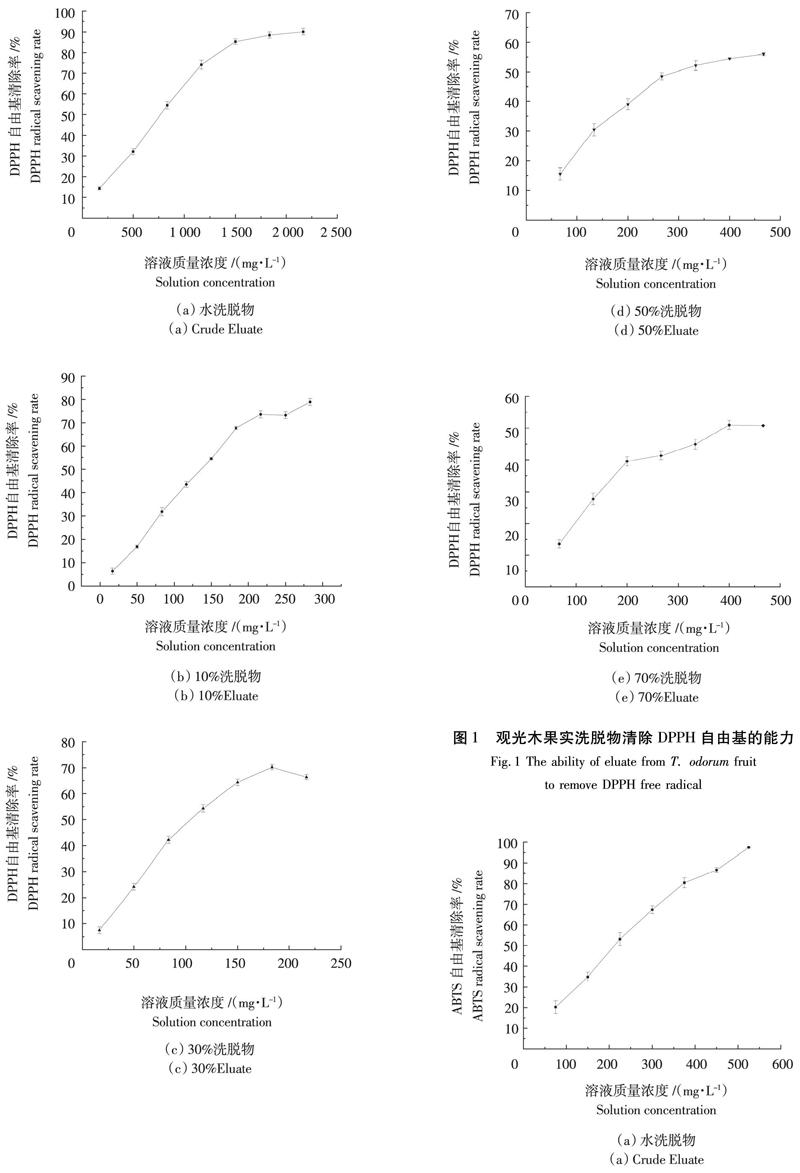
由图1可知,5个洗脱物对DPPH自由基均具有一定的清除作用,随着溶液质量浓度的增加,DPPH自由基清除能力也呈增加的趋势。由表2可知,IC50的大小依次为:水洗脱物、70%洗脱物、50%洗脱物、10%洗脱物、30%洗脱物,IC50值越小,表明清除能力越强。其中,30%洗脱物对DPPH自由基清除能力最强,观光木果实黄酮质量浓度为16.67~216.67 mg/L,随着溶液质量浓度的增加,清除DPPH自由基能力加强,当溶液质量浓度为183.33 mg/L时清除率达到70.15%。
2.3 ABTS自由基清除能力
由图2可知,5个洗脱物对ABTS自由基的清除能力随着溶液质量浓度的增加而增加。10%洗脱物、30%洗脱物、50%洗脱物对ABTS自由基具有较强的清除能力,IC50分别为62.54、71.57、75.29 mg/L(表2),均表现出较强的ABTS自由基清除能力。其中,30%洗脱物对ABTS自由基表现出较强的抗氧化活性,溶液质量浓度为25~200 mg/L,随着溶液质量浓度的增加,清除ABTS自由基的能力也增强,当溶液质量浓度为200 mg/L时,观光木果实总黄酮对ABTS自由基的清除能力高达92.10%。
2.4 观光木果实黄酮类化学成分初步鉴定
2.4.1 红外光谱分析
红外光谱通过样品吸收谱带的位置、形状和强度等,来推测官能团的种类[19]。图3为芦丁和观光木果实黄酮类物质纯化产物的红外光谱,标准品芦丁和样品分别在3 428.3、3 427.5 cm-1出现宽而强的吸收峰,为O—H的伸缩振动,表明有酚羟基的存在[20];芦丁在2 938.4 cm-1处,样品在2 927.9 cm-1处均有一个强度较小的吸收峰,为亚甲基的C—H的反对称伸缩振动峰,说明饱和碳上的氢较少;1 654.1~1 457.8 cm-1为芦丁标准品的苯环的骨架震动特征吸收峰分布区域,样品在1 656.9 cm-1和1 504.5 cm-1处有吸收峰,表明样品可能存在苯环;芦丁样品在1 500~1 300 cm-1均出现一些特征峰,这属于O—H的弯曲振动峰;1 300~1 200 cm-1属于CO的伸缩振动吸收峰,芦丁和样品有出现一定的特征峰。依据以上推断,初步判断观光木果实中的黄酮主要为黄酮醇类,具体的结构需要进一步进行UPLC-MS/MS检测。
2.4.2 UPLC-MS-MS法鉴定黄酮类物质成分
为了探讨观光木果实中具有抗氧化作用的主要化学成分,本文进一步对黄酮纯度较高和抗氧化活性较强的30%洗脱物进行了UPLC-MS-MS分析。根据保留时间、质谱图的碎片断裂模式、软件(Compound discoverer 3.1)的对比分析以及参考文献,推断出的5种黄酮类物质的结构,这些化合物可能是观光木果实具有较好清除DPPH和ABTS自由基的活性物,结果见表3。
表3中的几种化合物的分子结构如图4所示。
化合物1准分子離子峰[M+H]+m/z 343.172 9,分子式为C19H18O6,二级质谱碎片有[M+H-O]+m/z 327.119 7, [M+H-2CH3-CO]+m/z285.111 7,根据文献[21]及质谱数据库推断化合物1可能为4′,5,6,7-四甲氧基黄酮。
化合物2准分子离子峰[M+H]+m/z 449.107 9,推断分子式为C21H20O11,二级质谱碎片离子有[M+H- C6H11O5]+m/z 287.054 6,[M+H- C6H11O5-OH]+m/z 270.075 6,再根据文献[22]报道,推断为三叶豆苷。
化合物3准分子离子峰[M+H]+m/z 479.118 4,推断分子式为C22H22O12,二级质谱特征碎片离子为 [M+H- C6H11O5]+m/z 317.065 4,通过与mzcloud(赛默飞-未知物鉴定的新型数据库)质谱数据库和参考文献[23]对比,化合物3被鉴定为异鼠李素-3-O-葡萄糖苷。
化合物4在高分辨质谱下的准分子离子峰[M+H]+m/z 463.123 5,推断分子式为C22H22O11,二级质谱特征碎片离子为 [M+H- C6H11O5]+m/z 301.070 4,结合文献报道[24],推断为异金雀花素。
化合物5在高分辨质谱下的准分子离子峰[M+H]+m/z 373.124 3,推断分子式为C20H20O7,二级质谱碎片离子有 [M+H- CH3]+m/z 358.1040,[M+H- 2CH3]+m/z 343.080 8,[M+H-2CH3-O]+m/z 327.085 8,结合文献[25]报道,推断为橘皮素。
3 结论
本文利用D101型大孔树脂和不同体积分数的乙醇纯化观光木果实的黄酮,得到5个洗脱物,发现不同洗脱物的黄酮纯度和抗氧化活性均存在一定的差异,其中,30%洗脱物的黄酮纯度最高,水液洗脱物最低。5个洗脱物DPPH和ABTS的抗氧化活性均随着溶液质量浓度的增加而逐渐增加,30%洗脱物对二者的清除能力最强,最大清除率分别达到70.15%和92.10%,表明观光木果实总黄酮具有较强的抗氧化活性。通过FT-IR进行了初步的结构表征,观光木果实提取物以羟基、酚羟基、羧基以及甲基为主。用UPLC-MS/MS进一步推断了出观光木果实的黄酮中可能含有4′,5,6,7-四甲氧基黄酮、三叶豆苷、异鼠李素-3-O-葡萄糖苷、异金雀花素、橘皮素。
【参 考 文 献】
[1]刘晓玲,吴道念,符韵林.溶胶-凝胶法调控木材表面附着二氧化硅薄膜的研究[J].林产工业,2016,43(8):13-17.
LIU X L, WU D N, FU Y L. Research on silicon dioxide film adhered wood surface modified by Sol-gel method[J]. China Forest Products Industry, 2016, 43(8): 13-17.
[2]刘晓涛,张泰劼,李芸瑛,等.3年生观光木夏季的光合生理特性初探[J].华南师范大学学报(自然科学版),2017,49(6):65-70.
LIU X T, ZHANG T J, LI Y Y, et al. Photosynthetic physiological characteristics of 3-year-old Tsoongiodendron odorum seedlings in summer[J]. Journal of South China Normal University (Natural Science Edition), 2017, 49(6): 65-70.
[3]潘陆荣,亢亚超,潘虹,等.生物质炭对铝胁迫下观光木幼苗生长生理特性的影响[J].西南林业大学学报(自然科学),2021,41(5):18-26.
PAN L R, KANG Y C, PAN H, et al. Effects of biochar on the growth and physiological characteristics of Tsoongiodendron odorum seedlings under aluminum stress[J]. Journal of Southwest Forestry University (Natural Sciences), 2021, 41(5): 18-26.
[4]宋晓凯,吴立军,屠鹏飞.观光木树皮的生物活性成分研究[J].中草药,2002,33(8):676-678.
SONG X K, WU L J, TU P F. Studies on bioactive constituents in bark of Tsoongiodendron odorum[J]. Chinese Traditional and Herbal Drugs, 2002, 33(8): 676-678.
[5]亢亚超.氮磷钾配比施肥对观光木幼苗生长生理及光合特性的影响[D].南宁:广西大学,2020.
KANG Y C. Effects of different NPK ratio fertilization on growth, physiology and photosynthetic characteristics of Tsoongiodendron odorum seedlings[D]. Nanning: Guangxi University, 2020.
[6]张应明,吴林芳,栾福臣,等.高光照强度下不同时间观光木光合生理特征对比[J].安徽农业科学,2019,47(14):116-117.
ZHANG Y M, WU L F, LUAN F C, et al. Comparison of photosynthetic physiological characteristics of Tsoongiodendron odorum at different time under high light intensity[J]. Journal of Anhui Agricultural Sciences, 2019, 47(14): 116-117.
[7]林宁,谢安德,王凌晖,等.低温胁迫对观光木幼苗离体叶片生理特性的影响[J].湖北农业科学,2012,51(16):3524-3527.
LIN N, XIE A D, WANG L H, et al. Effects of low-temperature stress on physiological characteristics of in vitro Tsoongiodendron odorum seedlings leaves[J]. Hubei Agricultural Sciences, 2012, 51(16): 3524-3527.
[8]符韵林,邱炳发,韦鹏练,等.观光木木材干燥特性研究[J].浙江农林大学学报,2011,28(5):767-770.
FU Y L, QIU B F, WEI P L, et al. Drying characteristics of Tsoongiodendron odorum wood[J]. Journal of Zhejiang A & F University, 2011, 28(5): 767-770.
[9]许秀平,邓元德,严铭海.福建梁野山自然保护区观光木群落特征研究[J].长江大学学报(自然科學版),2019,16(11):69-74.
XU X P, DENG Y D, YAN M H. Characteristics of Michelia odora forest community in Liangyeshan national nature reserve in Fujian Province[J]. Journal of Yangtze University (Natural Science Edition), 2019, 16(11): 69-74.
[10]张信坚,邱建勋,胡玮珊,等.江西信丰细迳坑自然保护区观光木群落研究[J].亚热带植物科学,2016,45(4):343-350.
ZHANG X J, QIU J X, HU W S, et al. Tsoongiodendron odorum community in Xijingkeng nature reserve from Xinfeng, Jiangxi Province[J]. Subtropical Plant Science, 2016, 45(4): 343-350.
[11]郑燕菲.濒危植物单性木兰的有效成分及其生物活性研究[D].南宁:广西大学,2016.
ZHENG Y F. Study on effective component and bioactivity of Magnolia kwangsiensis figlar & noot[D]. Nanning: Guangxi University, 2016.
[12]宋晓凯.观光木化学成分及抗癌活性的研究[D].沈阳:沈阳药科大学,2001.
SONG X K. Studies on the chemical constituents and bioactivities of Tsoongiodendron odorum Chun[J]. Shenyang: Shenyang Pharmaceutical University, 2001.
[13]郭磊,高然,田野,等.桦褶孔菌不同溶剂萃取物抗氧化活性研究[J].西部林业科学,2020,49(2):17-23.
GUO L, GAO R, TIAN Y, et al. Evaluation of the antioxidant properties of various solvent extracts from Lenzites betulina[J]. Journal of West China Forestry Science, 2020, 49(2): 17-23.
[14]耿文慧,卢绍基,明艳林.铁皮石斛化学成分及其抗氧化活性研究[J].亚热带植物科学,2020,49(6):438-442.
GENG W H, LU S J, MING Y L. The chemical constituents and antioxidant activities of Dendrobium officinale[J]. Subtropical Plant Science, 2020, 49(6): 438-442.
[15]王俊青,汪全,焦阳阳,等.响应面法优化南方红豆杉叶总黄酮提取工艺研究[J].食品研究与开发,2019,40(2):86-90.
WANG J Q, WANG Q, JIAO Y Y, et al. Study on optimization of extraction process of total flavonoids leaves from Taxus chinensis(pilger) rehd. by response surface methodology[J]. Food Research and Development, 2019, 40(2): 86-90.
[16]何礼,陈克玲,何建,等.低温贮藏下塔罗科血橙抗氧化性能研究[J].西南农业学报,2015,28(6):2666-2671.
HE L, CHEN K L, HE J, et al. Antioxidant properties of blood orange tarocco during cold temperature storage[J]. Southwest China Journal of Agricultural Sciences, 2015, 28(6): 2666-2671.
[17]王富豪,黄璐,薛晨晨,等.不同品种大豆异黄酮组分及体外抗氧化活性分析[J].食品工业科技,2021,42(17):247-255.
WANG F H, HUANG L, XUE C C, et al. Analysis on the isoflavone profile and antioxidant activity in vitro of different soybean varieties[J]. Science and Technology of Food Industry, 2021, 42(17): 247-255.
[18]張晓南,普楠,张潇元,等.大豆异黄酮纳米粉体的反溶剂法制备及表征[J].中国食品学报,2019,19(9):103-108.
ZHANG X N, PU N, ZHANG X Y, et al. Preparation and characterization of soy isoflavone nanoparticles by antisolvent precipitation method[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(9): 103-108.
[19]范艳丽,韩丽娜,孟雪梅,等.枸杞叶黄酮提取物的组成及初步结构表征[J].食品工业科技,2017,38(14):46-50.
FAN Y L, HAN L N, MENG X M, et al. Composition analysis and preliminary structural characterization of the flavonoids from Lycium barbarum leaves[J]. Science and Technology of Food Industry, 2017, 38(14): 46-50.
[20]陈瑾,陈晶华,刘利平,等.枸杞叶黄酮提取物的纯化及组成结构分析[J].食品工业科技,2019,40(18):28-34.
CHEN J, CHEN J H, LIU L P, et al. Purification and structural analysis of flavonoids from Lycium barbarum leaves[J]. Science and Technology of Food Industry, 2019, 40(18): 28-34.
[21]XING T T, ZHAO X J, ZHANG Y D, et al. Fast separation and sensitive quantitation of polymethoxylated flavonoids in the peels of Citrus using UPLC-Q-TOF-MS[J]. Journal of Agricultural and Food Chemistry, 2017, 65(12): 2615-2627.
[22]郭群,萬军梅.液相色谱质谱联用法分析喜树果中苷类化学成分[J].亚太传统医药,2012,8(1):26-29.
GUO Q, WAN J M. Analysis of glycosides in the fruits of Camptotheca acuminata by hplc-esi-(ms)n[J]. Asia-Pacific Traditional Medicine, 2012, 8(1): 26-29.
[23]郑文惠,白海英,王丽瑶,等.UPLC-QTOF-MS法分析沙棘果实、叶和枝的成分[J].中成药,2020,42(11):2940-2947.
ZHENG W H, BAI H Y, WANG L Y, et al. Analysis of constituents in the fruit, leaf and twig of Hippophae rhamnoides by UPLC-QTOF-MS[J]. Chinese Traditional Patent Medicine, 2020, 42(11): 2940-2947.
[24]付林,古锐,张彩虹,等.藏药大花龙胆正丁醇部位的化学成分研究[J].中草药,2018,49(5):1002-1006.
FU L, GU R, ZHANG C H, et al. Chemical constituents of n-butanol fraction from Tibetan medicine Gentianae szechenyi spray[J]. Chinese Traditional and Herbal Drugs, 2018, 49(5):1002-1006.
[25]ZHENG Y Y, ZENG X, PENG W, et al. Characterisation and classification of Citri reticulatae Pericarpium varieties based on UHPLC-Q-TOF-MS/MS combined with multivariate statistical analyses[J]. Phytochemical Analysis, 2019, 30(3): 278-291.
