骨髓间充质干细胞玻璃体腔内注射对外伤性视神经损伤的修复作用研究
2021-12-28谢佩玲张俐娜何娜南开辉
谢佩玲,张俐娜,何娜,南开辉
外伤性视神经病变(TON)是颅脑外伤常见合并症状之一,在交通、高空坠落等事故中多见[1]。目前临床对于间接性TON治疗尚未达成共识,推荐治疗方法有静脉注射大剂量糖皮质激素和经颅或经筛窦视神经管减压术,但神经损伤修复再生治疗效果不稳定,治疗效果不佳主要与视网膜神经节细胞(RGCs)存活数量以及轴突再生关系密切[2-3]。为改善TON患者的治疗效果,研究者们致力于探索其他治疗手段如基因治疗、干细胞治疗用于视神经损伤修复再生,干细胞用于中枢神经损伤治疗作用在不同疾病模型研究中分别得到了证实[4-5],然而,干细胞在TON 中的具体作用及其机制研究相对较少。本研究选择大鼠视神经夹伤模型,经由玻璃体腔内注射骨髓间充质细胞(BMSC),研究其对RGCs的保护及其轴突再生作用。现报道如下。
1 资料与方法
1.1 材料 细胞培养基DMEM/F 12(1∶1)(1X)、胎牛血清、胰酶(0.25% trypsin-EDTA)等购自美国Gibco 公司,死活染色试剂盒(Live/dead Viability assay)购自美国Invitrogen 公司,光学相干断层扫描仪(OCT)购自美国Tissue-Tek 公司,Triton X-100 购自北京Solarbio 公司,氧氟沙星软膏购自沈阳兴齐眼药有限公司,霍乱毒素B 亚基(CTB)购置美国Invitrogen 公司。实验动物与分组:选取72 只健康SD大鼠,6~8 周龄,重量180~210 g,随机分为3 组:TON+BMSCs 注射组(BMSCs 组)、TON+磷酸盐缓冲溶液(PBS)注射组(PBS 组)和假手术组(Sham组),每组各24 只。BMSCs 组、PBS 组大鼠行眶内段视神经钳夹伤造模,Sham 组只暴露视神经。各组分别于造模后第3、7、14、28 天处死6 只大鼠。第25天在各组剩余的6 只大鼠玻璃体腔内注射CTB。
1.2 方法
1.2.1 TON 模型建立 先将大鼠放入含3%异氟烷的氧气、空气(1∶1)混合气体诱导箱内诱导麻醉5 min,大鼠翻身反射消失后,继续予含1.5%异氟烷的氧气、空气(1∶1)混合气体经面罩维持麻醉。大鼠置于手术台,局部应用盐酸丙美卡因滴眼液滴左眼予以表面麻醉处理。剃毛刀剔除眼睑及眶周部分毛发,0.5%聚维酮碘溶液清洁备皮区及结膜囊,用角膜剪自左眼外眦处开始向颞侧皮肤做长约6 mm的皮肤切口,注意勿损伤外眦静脉等较大血管;使用5-0 丝线将切口两侧皮瓣缝合于切口两侧皮肤,牵拉暴露切口范围。用角膜剪向结膜下穹窿部剪开结膜,暴露眶周脂肪并剪除遮挡视野部分,注意勿损伤眼外肌及血管;角膜剪剪除部分眶周脂肪,显微镊分离肌锥,暴露视神经(封三彩图3a)。在眼球后2 mm 处将显微镊(头部宽度为0.1 mm,WA3010,中国金钟)尖端完全闭合钳夹视神经持续6 s(封三彩图3b~c)。缝合切口后涂抹眼膏防止感染,腹腔注射0.05 mg/kg 布洛芬镇痛。BMSCs 组构建TON 模型后玻璃体注射BMSCs,PBS 组构建TON 模型后玻璃体注射PBS,Sham 组暴露视神经后不做夹持处理。
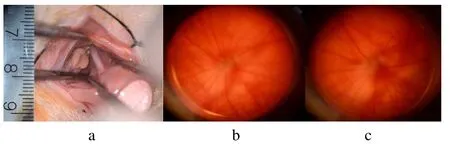
图3 经颞侧皮肤入路暴露视神经并构建视神经钳夹伤模型
1.2.2 BMSCs 培养与注射 另选取SD 大鼠2 只,重量80~100 g,腹腔注射10%水合氯醛溶液0.5 ml麻醉,麻醉后心脏注入5 ml空气处死,将大鼠浸泡于75%乙醇溶液中消毒5 min,移至超净台内的干净大培养皿中,分离出股骨、下肢骨,使用1 ml 注射器和BMSCs 专用培养基(含10%FBS、1%青霉素和链霉素的DMEM-F12 培养基)冲洗骨髓腔,收集至15 ml离心管中,1000 r/min 离心5 min,新鲜完全培养基重悬,接种于小培养瓶中,在37℃、5%CO2条件下培养。隔天换新鲜完全培养基,持续1 周,传代至大培养瓶中,扩大培养2 代,选取细胞生长良好的P2 代进行后续试验。BMSCs 组和PBS 组行玻璃体腔注射,Hamilton 微量注射器玻璃体腔内分别注射BMSCs 5(l细胞密度为8000 个/ml)和PBS 5l。
1.2.3 RGCs 轴突顺行标记与计数 使用装配33 G尖针头的10l Hamilton微量注射器,玻璃体内注射5l 浓度为1 mg/ml 的CTB 594 溶液,3 d 后大鼠心脏灌注4%多聚甲醛,摘除眼球并使用4%PFA固定。显微镜下以视盘作为中心,将分离的视网膜放射状剪成4 份,使用DM4B 正置荧光显微镜在200 倍下离视盘边界1500m处4 个象限随机拍照,用Image J 软件计数每个区域的RGC 数量,并取4 个区域的平均值作为视网膜上RGC 的数量。
1.2.4 视神经切片及新生轴突计数 解剖并固定视神经,包埋、连续切片20 张后置于-20 ℃冰箱短期保存。使用Image J 软件计数每张视神经切片距离损伤灶起始处200、500、1000、1500m 处CTB 阳性再生轴突数量;每根视神经选取3 张切片计数,并求出平均值。同时计数时测量神经的横截面宽度(2r),用于计算每毫米神经宽度的轴突数目。∑ad 是半径为r 的视神经中轴突距离视神经钳夹损伤起始处距离为d 的部位再生轴突总数,通过对所有厚度为的视神经切片根据下面公式求和计算而得出
1.3 统计方法 采用SPSS20.0统计软件进行分析,计量资料以均数±标准差表示,多组比较采用单因素方差分析,多重比较采用SNK检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组RGCs 计数情况比较 在各个时间点,BMSCs 组与PBS 组RGCs 存活数量均低于Sham组,而BMSCs 组RGCs 存活数量均高于PBS 组(均P <0.05),见表1 和封三彩图4~6。

表1 各组RGCs 计数情况比较 个/mm2

图4 Sham 组在各时间点视网膜铺片
2.2 轴突生长情况 在距离视神经夹伤起始部位200、500、1000、1500m 位置,BMSCs 组新生轴突数量高于PBS组(均P<0.05),见表2;造模后4 周,BMSCs 组显示有大量新生轴突穿过损伤部位,而PBS 组只有少量新生轴突,见封三彩图7。

表2 各组轴突生长情况比较 根
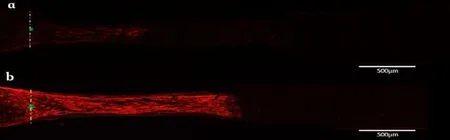
图7 玻璃体腔内注射CTB后新生轴突情况比较

图5 BMSCs 组在各时间点视网膜铺片
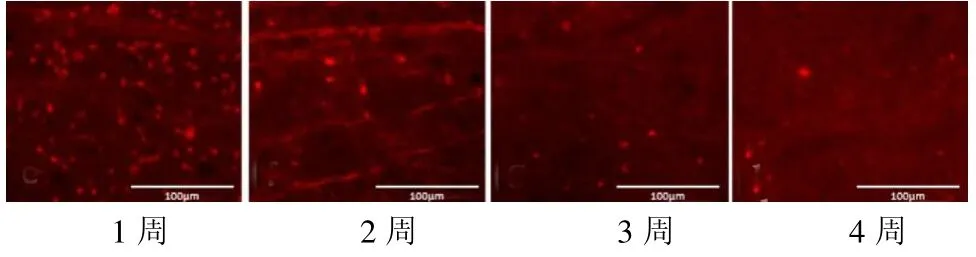
图6 PBS 组在各时间点视网膜铺片
3 讨论
外伤性视神经病变往往造成急性的视神经损伤,导致视力部分或全部丧失。视神经钳夹损伤是研究中枢神经系统损伤再生修复的重要模型之一,通过经眼眶暴露视神经,完全避免了对视神经的牵拉。本研究结果表明单纯经眼眶暴露视神经不会造成明显RGCs 数量的损失。本研究结果还显示视神经损伤2 周后即有大量RGCs凋亡,而视神经如果受到损伤,其再生能力远远低于周围神经。其原因如下:首先,RGCs作为高度分化细胞,在损伤后再生能力严重不足,这是视神经难以再生的主要原因;其次,视神经损伤后引起轴突溃变而断裂,造成RGCs 继发性凋亡;最后,视神经损伤后轴突再生形成磷髓酯碎片、胶质瘢痕等抑制性微环境严重阻碍了视神经再生[7-8]。
视神经再生包括以下几个方面:(1)保护RGCs,避免视神经损伤后的RGCs凋亡;(2)促使RGCs轴突沿视神经方向再生,即轴突定向生长,视神经损伤后,轴突断裂,视神经变性坏死失去功能,需要新生轴突重建功能;(3)重建新生轴突视觉信号传导功能,即视功能重建。视神经再生干细胞移植包括多功能干细胞以及间充质干细胞。多功能干细胞通过诱导分化使其移行整合到宿主的视网膜上,补充凋亡的RGCs及生成新生的轴突;间充质干细胞对损伤后的神经元细胞给予炎症调节、营养和神经保护支持[10-11]。BMSCs 在医学领域已经得到广泛的应用,其制备、质量管理、存储、运输等各个环节都较为成熟,为其在视神经再生领域的应用提供了保障。
本研究观察到视神经损伤大鼠玻璃体腔内注射一定量的BMSCs不仅可以提高RGCs的存活数量,同时也促进更多的新生轴突的生长。因此,玻璃体腔注射BMSCs 有可能成为外伤性视神经损伤的新疗法。但是,BMCs 促进RGCs 存活及促进轴突再生的机制需深入探讨,且本研究观察时间较短,未能重建新生轴突与脑靶区的连接及检测视功能的重建情况,而这恰恰是神经再生难点所在,其将是后续研究关注重点。
