2′-岩藻糖基乳糖的生理功效以及制备方法研究进展
2021-12-27李娜徐恺李丽於昊徐铮
李娜,徐恺,李丽,於昊,徐铮
(南京工业大学 食品与轻工学院,江苏 南京,211816)
2′-岩藻糖基乳糖(2′-fucosyllactose,2′-FL,CAS号:41 263-94-9)是乳糖与L-岩藻糖组成的非还原性三糖,分子式为C18H32O15,分子量488.44,结构如图1所示。它在人乳寡糖(human milk oligosaccharide,HMO)中含量最为丰富,占比达到31%[1],在婴幼儿的免疫力改善、肠道疾病预防、智力发育等领域效果明显。截止目前鲜有研究证明2′-FL会给人体带来负面影响,因而非常安全。早期2′-FL的获得是从母乳中分离提取[2],但这种方法只适合基础研究。为满足商业化生产需要,Glycom A/S公司开始利用化学法合成2′-FL[3],但该方法步骤多、溶剂污染大、规模化应用困难,因此目前主流生产技术是更加环保且高效的微生物发酵法。微生物发酵法以外源添加的乳糖为底物,通过微生物自身代谢途径形成的5′-二磷酸鸟嘌呤核苷-岩藻糖二钠盐(guanosine 5′-diphospho-β-L-fucose sodium salt,GDP-L-岩藻糖)为前体,在岩藻糖基转移酶的作用下合成2′-FL,已被证明具有较强的可行性。发达国家在十余年前便已开展利用微生物发酵法生产2′-FL的研究,代表性公司有丹麦Glycom A/S、德国Jennewein Biotechnologie、荷兰Glycosyn LLC、比利时Inbiose等,最终由巴斯夫等跨国公司添加到婴幼儿配方奶粉中销售。据Jennewein Biotechnologie公司称,目前2′-FL最高产量已达到180 g/L[4],并表明其生产成本在未来还具有很大的下调空间,可以大规模推广应用。近年来,随着国内消费者对于母乳喂养的观念日益增长,各类研究机构针对2′-FL的研究逐渐增多,使我国在研发生产2′-FL方面已经具备一定实力。本文主要总结了2′-FL的生理功效以及不同制备方法的研究进展,并提出了该领域今后的研发方向,以期为2′-FL工业化生产的进步提供参考。
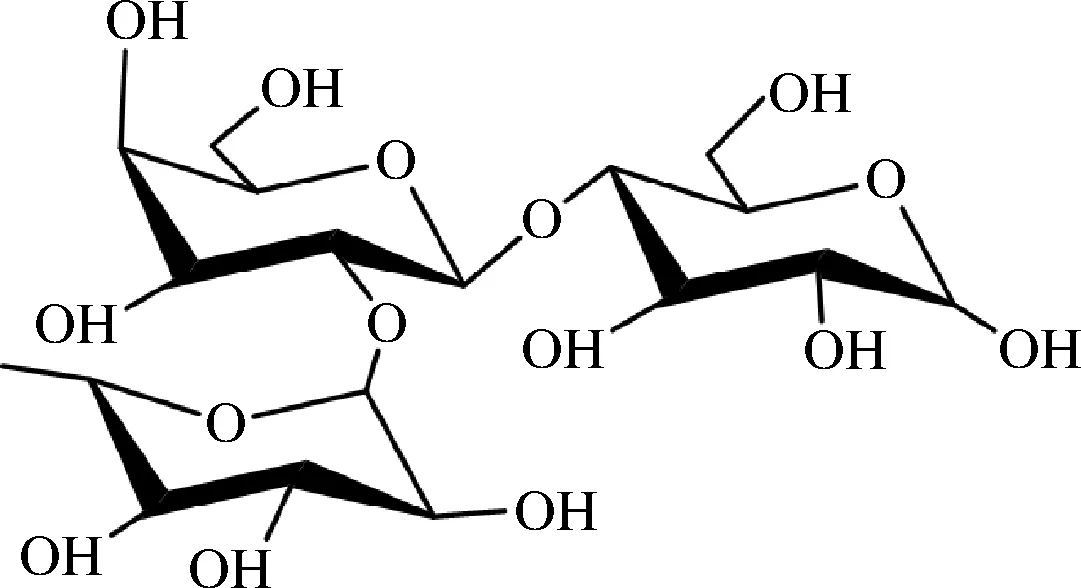
图1 2′-FL的结构示意图Fig.1 The chemical structure of 2′-FL
1 2′-FL的生理功效
近年来,国内外多个课题组对2′-FL的生理功效进行了深入研究,结果主要包括以下几个方面:
(1)促进肠道益生菌的繁殖、抑制有害菌生长。在体外实验中发现,2′-(或3-)岩藻糖基乳糖的混合溶液能够促进乳杆菌Lactobacillussp.和双歧杆菌Bifidobacteriurmsp.的生长,且不影响Lactobacillusdelbrueckiisubsp.bulgaricusNRRL B-548、L.caseisubsp.caseiNRRL B-1922、L.caseisubsp.caseiAS 1.2435以及BifidobacteriumlongumNRRL B-41409等益生菌的繁殖[5]。此类益生菌大量繁殖后能够产生丰富的短链脂肪酸(short chain fatty acids,SCFA),可以显著降低肠道微环境的pH值并维持酸性环境来促进肠道消化酶的分泌。SCFA进一步促进了肠道内其他益生菌的生长、抑制了致病菌(包括链球菌、志贺氏菌、乳球菌、致病性大肠杆菌等)的繁殖;增加了肠道内钙、镁等矿物质的溶解,使其以离子形式存在并刺激肠道黏膜细胞生长,提高其对矿物质的吸收能力[6]。此外,双歧杆菌的繁殖还可以促进B族维生素的合成,对蛋白质、碳水化合物、脂质代谢都起到重要作用[7]。以上实验条件与母乳喂养的婴幼儿肠道情况基本一致,侧面证明了2′-FL独特的生理效果。
(2)抗病原菌粘附、促进有益菌定殖。肠道病原菌入侵人体后的第一步通常是粘附在上皮细胞、随后开始感染组织。2′-FL与肠道上皮细胞的糖蛋白、糖链中的部分结构相似,因此可以诱导病原菌与其结合而不与肠道上皮细胞结合,进而阻断其粘附、定殖过程[8]。体外实验证明2′-FL可以抑制空肠弯曲杆菌、致病性大肠埃希氏菌、伤寒沙门菌和绿脓杆菌对人肠道细胞株Caco-2的粘附(分别减少了26%、18%、12%和17%),抑制绿脓杆菌对人呼吸道上皮细胞株A549的粘附[9],从而有助于预防肠道、呼吸道和尿路的炎症以及传染病;另一方面,2′-FL可以促进肠道益生菌的定殖,例如有实验表明BifidobacteriumbifidumDNG6在含有2′-FL的实验组中的粘附率为(9.34±0.31)%要高于含有低聚半乳糖组的实验(6.64±0.36)%和含有葡萄糖组的实验(7.08±0.27)%(P<0.01),发现了2′-FL能够通过加强表达B.bifidumDNG6的粘附基因来提高该菌的粘附能力,从而促进其定殖[10]。
(3)对免疫系统进行调节、降低炎症反应。研究表明,2′-FL可以直接通过参与细胞因子的分泌调节来影响免疫系统。例如2′-FL在婴儿体内可以降低炎症细胞因子(IL-1ra、IL-1α、IL-1β、IL-6、肿瘤坏死因子-α)浓度,这与母乳喂养组结果基本一致,而奶粉喂养组则出现炎症细胞因子显著上升的情况[11]。在小鼠流感疫苗接种模型中,摄入2′-FL的小鼠脾细胞中与疫苗特异性相关的CD4+和CD8+型T细胞、γ-干扰素的产生有显著增加,表明其改善了小鼠对接种疫苗的体液及细胞免疫反应[12]。2′-FL还能有效调节与过敏性疾病相关的肠道上皮细胞反应,选择性的抑制抗原-抗体复合物对促炎趋化因子CCL20的释放,进一步体现了其治疗食物过敏和通过抑制过度的炎症反应避免给肠道带来二次损伤的潜力[13]。除此之外,2′-FL对右旋糖酐硫酸钠诱导的结肠炎能起到预防作用,机理是降低条件致病菌的丰度和增加益生菌的比例,尤其是促进肠道免疫与代谢平衡的益生菌,例如Muribaculaceae、Ruminococcustorques、Lactobacillus、Bacteroides[14]。FACINELLI等[15]研究发现肠杆菌科菌株可以在含有低聚半乳糖的环境下繁殖,但却无法在与母乳含量相同的2′-FL环境下粘附,由于肠杆菌科细菌被认为与早产儿的坏死性小肠结肠炎相关,该结果表明2′-FL对肠杆菌科细菌具有显著抑制作用,可以降低坏死性小肠结肠炎的风险。这些研究均展示了2′-FL可以作为一种特殊的食品成分来降低儿童或成人炎症性肠病(inflammatory bowel disease,IBD)的潜力。
(4)对大脑发育有促进作用。研究人员在动物实验中发现,2′-FL能够增强大鼠海马POP-spike群体峰电位和场兴奋性突触后电位(fEPSP),有效地维持了长期信息存储效应并大大提高了长期信息存储效应的诱导性;在饮食中添加2′-FL有利于啮齿动物在认知领域的提高并能够改善学习和记忆水平[16]。因此,2′-FL在大脑发育、神经元传递和突触的形成中也有一定作用,能够刺激大脑发育和提高记忆力[17]。
综上所述,2′-FL对婴幼儿免疫力提高、肠道菌群调节、大脑发育等均存在有益效果,显著改善了婴幼儿健康、预防了疾病发生。
2 2′-FL的化学制备方法
2′-FL可以通过化学法合成获得,Glycom A/S公司的AGOSTON等[18]开发了公斤级的合成路线,具体方法如下:(1)乳糖受体的制备。以一水乳糖为原料,保留两个羟基功能,其余羟基以二甲缩醛形式保护,以甲基叔丁基醚(methyl tert-butyl ether,MTBE)作为结晶溶剂,结晶得到化合物1。以吡啶为碱,吡喃酰氯为酰化剂,在二氯甲烷(dichloromethane,DCM)中与甲戊酰酯反应,保护6′-OH功能,进行柱层析获得纯的乳糖受体。(2)岩藻糖基供体的制备。以L-岩藻糖为原料,在“一锅”反应中分别进行常规乙酰化、引入噻吩基和催化脱除乙酸酯反应,得到化合物2。以溴化苄为烷化剂,KOtBu为碱,在N,N-二甲基酰胺(N,N-dimethylformamide,DMF)中进行苄基化反应。以四氢呋喃为溶剂,结晶分离出糖基供体。(3)糖基化。选择Lemieux方法,将糖基供体溶解在DCM中,加入5 ℃的溴将其转化为溴蔗糖。将乳糖受体和四丁基溴化铵的DMF溶液加入到溴糖粗溶液中。搅拌后,加入甲醇,然后用60%醋酸在水中高温裂解,从乙酸乙酯中结晶分离得到晶体,再用甲醇重结晶进一步纯化。(4)目标化合物的分离。在异丙醇/甲醇/水/乙酸的混合物中进行保护基团的去除,用Pd/C和H2催化加氢脱除苄基,用MTBE甲醇沉淀法分离;最后加入异丙醇研磨,2′-FL以白色无定形固体的形式被分离得到。尽管化学合成可能具备易于放大生产、产品纯度高(或杂质成分容易确定)等优点,但是化学合成法在生产过程当中涉及有毒试剂的使用,限制了大规模应用,因此难以成为主流技术。
3 2′-FL的生物制备方法
2′-FL的生物制备方法主要包括发酵法和酶法两种,相较于酶法需要特定的反应条件且涉及到多酶分离纯化,发酵法凭借其简便、经济及可持续发展的优点引起了学者的广泛关注,研究比较深入。目前2′-FL发酵法合成的途径主要分为两条,一条是需要使用外源L-岩藻糖的补救途径即Salvage途径,该途径利用双功能酶fkp将外源L-岩藻糖转变为GDP-L-岩藻糖,经岩藻糖基转移酶将其与外源乳糖结合生成2′-FL;另一条是以葡萄糖或甘油为碳源,通过宿主进行多步代谢合成前体GDP-L-岩藻糖,最终通过表达的外源岩藻糖基转移酶与乳糖反应获得2′-FL,该途径为从头合成途径即denovo途径。合成途径如图2所示。两种途径都需要大量的GDP-L-岩藻糖作为产物合成前体与外源乳糖结合生产2′-FL,因此在生产菌株细胞内积累这种前体是极其关键的。其主要方法包括以下3种:(1)使用强启动子或高拷贝表达策略对GDP-L-岩藻糖合成途径进行增强,或过表达可拉酸合成途径的阳性转录因子基因来实现(例如rcsA);(2)敲除GDP-L-岩藻糖下游代谢的相关基因(例如wcaJ)来实现中间体积累;(3)对关键酶的限制性辅因子GTP和NADPH的合成进行调控。
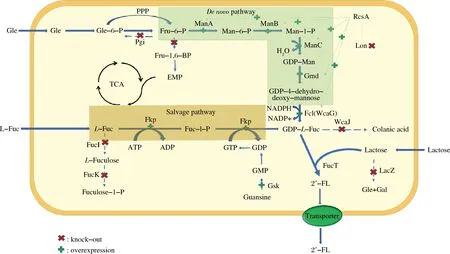
(ManA-甘露糖-6-磷酸异构酶;ManB-磷酸甘露糖变位酶;ManC-α-D-甘露糖-L-磷酸鸟苷酸转移酶;Gmd-GDP-甘露糖-6-脱氢酶;Fcl-GDP-L-岩藻糖合酶;FutC-α-1,2-岩藻糖基转移酶;WcaJ-可拉酸生物合成酶;LacY-乳糖透过酶;LacZ-β-半乳糖苷酶;Fkp-L-岩藻激酶/GDP-L-岩藻糖焦磷酸化酶)图2 2′-FL的两条生物合成路径Fig.2 The two biosynthetic routes of 2′-FL
3.1 发酵碳源的选择
由于L-岩藻糖价格十分昂贵且不易获得,使得虽然补救途径产量更高却缺乏实用价值,从头合成途径已成为目前研究的焦点。在发酵碳源的选择上,已有文献中较多选择甘油;例如CHIN等[19]为降低BL21 star(DE3)水解乳糖的能力利用λ-Red重组技术改造了乳糖操纵子并在FucT2酶的N端融合了3个天冬氨酸(即D3标签)增强其可溶性,最终在以甘油为碳源时进行发酵获得了6.4 g/L的产物,发酵结束时菌体干重为71.1 g/L,总发酵时长为78 h,生产强度为0.118 g/(L·h)。BAUNGRTNER等[20]将2′-FL合成途径的关键基因gmd、wcaG、manB、manC、futC(双拷贝)整合到宿主染色体,用Ptac作为表达启动子,使该菌株不需要外源质粒就可以进行基因表达,在以甘油为碳源且不添加抗生素的条件下进行高密度发酵,表达35.5 h后2′-FL的产量达到20.28 g/L,生产强度为0.57 g/(L·h),由于利用染色体整合技术得到的生产菌株不需要使用外源抗生素,因此该技术所得产品更加安全。此外,NI等[21]在大肠杆菌C41(DE3)菌株中表达了2′-FL合成相关基因manC、manB、gmd、wcaG、futC、rcsA、rcsB,并敲除了产物中间体消耗的关键基因wcaJ、nudK、nudD,以及半乳糖苷酶基因lacZ。所得基因工程菌在使用甘油为碳源的条件下,通过高密度发酵获得了66.8 g/L的2′-FL,对应的菌体干重为101.24 g/L,生产强度为0.95 g/(L·h),这是目前使用甘油碳源得到的最高生产水平,该结果表明敲除支路竞争途径、增强目标产物分支通量,有利于产物积累,并利用高密度发酵策略能够大幅提升2′-FL的产量。
尽管葡萄糖是最为廉价的工业用碳源之一,但大肠杆菌使用它生产2′-FL的实例并不多,这可以用葡萄糖效应引起的代谢抑制来解释[22],葡萄糖抑制了2′-FL生物合成过程中乳糖转运基因的表达,因此很难通过葡萄糖来生产2′-FL。但也存在成功的实例,DROUILLARD等[23]通过表达futC和rcsA基因,最终获得了14 g/L的产量,这是首次报道以葡萄糖为碳源利用从头合成途径合成2′-FL。HUANG等[24]在实验中发现在以葡萄糖为碳源时2′-FL产量要高于甘油,他们利用质粒表达成功表达了2′-FL从头合成途径的相关基因以及乳糖转运蛋白LacY,在此基础上还敲除了lacZ、lon、wcaJ,最终成功用改良的BL21(DE3)菌株进行发酵,获得了9.12 g/L的2′-FL。
来源于甘蔗和甜菜的蔗糖是最常见的二糖,因此在价格方面也具有工业化优势;Jennewein Biotechnologie公司的PARSCHAT等[25]研发了利用蔗糖为碳源高产2′-FL的菌株,该菌株共敲除6个基因,包括半乳糖苷酶基因lacZ、可拉酸合成基因wcaJ、葡萄糖转运蛋白基因ptsG、果糖-6-磷酸代谢基因pfkA以及葡萄糖代谢基因gcd和glk;同时也通过染色体整合的方式过表达了15个基因,包括中间体GDP-L-岩藻糖合成的关键基因(manC、manB、gmd、wcaG),有关蔗糖转运、水解、以及代谢的基因(cscABKR基因簇),胞内合成乳糖的代谢途径及转运的关键基因(galTpm1141、pgi、pgm、galE、lacY)以及2′-FL合成、转运基因(wbgL、tpyB),将蔗糖分解出的葡萄糖在胞内重新合成为乳糖并参与2′-FL合成。该策略避免了与传统发酵方法一般加入外源乳糖来合成2′-FL,进一步降低了成本且提高了产品质量,防止乳糖转化为副产物(如乳果糖)带来的不利影响。最终构建的工程菌株利用蔗糖发酵84 h产量可达60 g/L的2′-FL,表明该技术具有很高的可行性。
3.2 底盘微生物的选择
底盘微生物选择是2′-FL高产的关键因素,大多研究表明在不同大肠杆菌菌株的选择中BL21(DE3)要优于JM109(DE3),这是因为虽然后者在发酵过程中易产生生物膜、且乙酸产量较大,因此JM109(DE3)并不适合高密度发酵[19],利用大肠杆菌生产2′-FL的研究进展总结见表1。
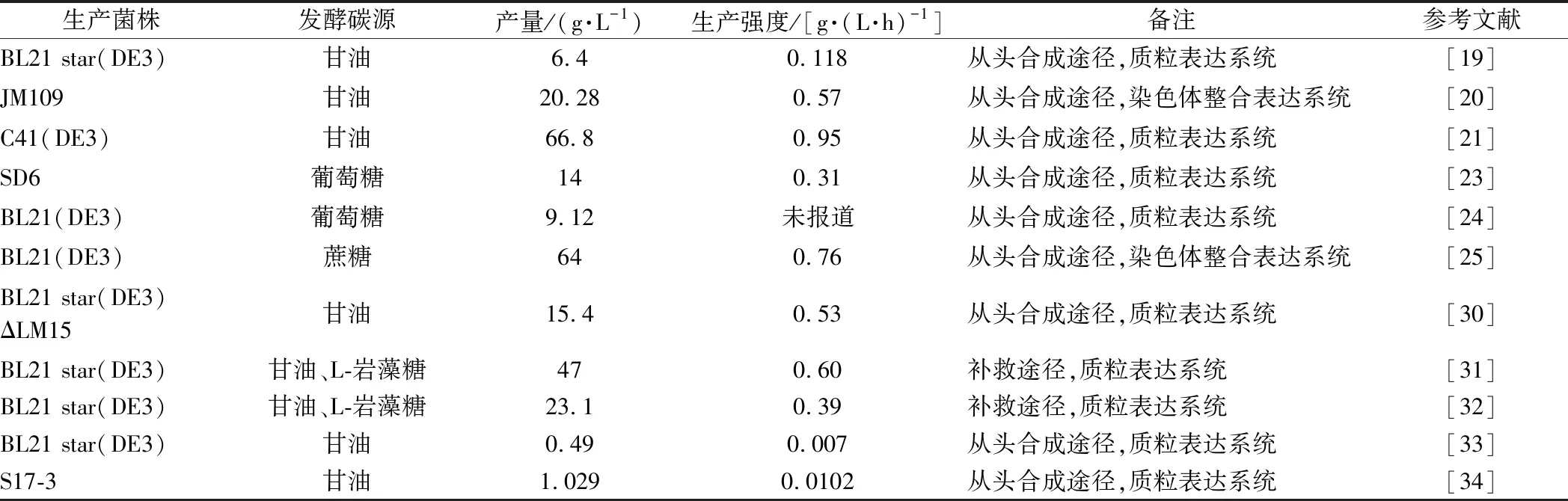
表1 已报道的部分大肠杆菌合成2′-FL工艺Table 1 The reported bio-production processes of 2′-FL
枯草芽胞杆菌、谷氨酸棒杆菌、酿酒酵母、解脂耶氏酵母等底盘微生物也被报道可以合成2′-FL,但目前产量均无法与大肠杆菌相比。其中产量最高的为解脂耶氏酵母(Yarrowialipolytica),杜邦公司的HOLLANDS等通过在其体内表达2′-FL合成途径关键基因gmd、gmeR、futC(融合SUMOstar标签),以及乳糖转运蛋白Lac12、产物运出蛋白CDT2使得产量达到24 g/L,总生产强度为0.44 g/(L·h)[26]。枯草芽胞杆菌作为一种食品级的模式微生物,被广泛用于营养食品和重组蛋白生产的宿主。但目前并没有在枯草芽胞杆菌中发现已知的岩藻糖降解途径,这也是利用该菌作为底盘微生物生产2′-FL的有利条件。江南大学的刘龙课题组[27]通过在枯草芽胞杆菌中敲除lacZ基因来阻止乳糖的降解,引入LacY基因来增强底物乳糖的转入。并在此基础上微调辅因子GTP再生模块基因gmd、ndk、guaA、guaC、ykfN、deoD和xpt的表达,引入回补途径关键基因fkp和fucT以提高2′-FL和GDP-L-岩藻糖的产量。最终构建了1株高产2′-FL的枯草芽胞杆菌菌株,在3 L补料分批发酵罐中获得5.01 g/L的产量。韩国YU等[28]首次报道了利用酿酒酵母生产2′-FL,他们通过在酿酒酵母中表达乳糖透过酶基因lac12以及关键酶基因fkp、fucT2,最终产量为0.5 g/L(120 h),但75%的2′-FL被发现位于胞内,仅有25%分泌到了胞外。虽然该结果表明酿酒酵母有作为2′-FL生产菌株的潜力,但由于酵母不能自主转运乳糖、且产物大部分不能释放到胞外等原因,使得酿酒酵母生产2′-FL的产量偏低。
酶法合成2′-FL是对发酵法的重要补充,目前尚处于探索阶段。SHI等[5]筛选了不同来源的岩藻糖基转移酶,发现Pedobactersp.来源的α-L-岩藻糖苷酶(PbFuc)具有合成3-FL和2′-FL的能力,当以4-硝基苯基-α-L-岩藻糖苷为底物时的转化率达到85%,为制备有价值的功能性岩藻糖化低聚糖提供了一种新颖而有效的酶法策略。此外,LI等[29]设计了一种有前景的体外多酶级联催化体系(MECCS),将L-岩藻糖和乳糖转化为2′-FL。通过串联3个酶实现了L-岩藻糖到2′-FL的合成路线,包括FKP、FucT、PK酶(丙酮酸激酶),其中PK酶满足了催化过程中对ATP和GTP的需求。他们在筛选岩藻糖基转移酶时发现幽门螺杆菌(Helicobacterpylori)来源FucT酶(HpFucT)的催化效率(kcat/Km)最高,以乳糖为底物时达到39.28 L/(mmol·min)。最终,含有HpFucT的多酶催化体系35 h内获得25.88 g/L的产物,生产强度为0.73 g/(L·h),这是首次利用改良的GDP-L-岩藻糖回收途径与丙酮酸激酶结合来再生昂贵的辅因子ATP和GTP来生产2′-FL,为GDP-L-岩藻糖的生产提供了持续和充足的供应,也为关键中间体GDP-L-岩藻糖的积累提供了新思路。
4 2′-FL的下游分离提取
生物法制备的2′-FL必须通过严格的下游分离提取过程才能够成为合格产品,因此下游分离提取极为重要。基本工艺步骤包括除菌、除盐、除色素、喷雾干燥与制粒等,不仅要求彻底除菌,还要求去除可溶性蛋白、多糖、核酸、色素等其他杂质。下游分离提取成本高昂,因此如何兼顾成本与产品质量成为产业化的关键问题。除此之外副产物的含量也对产品分离造成了困难,活性较高的岩藻糖基转移酶futC除了以乳糖为受体结合GDP-L-岩藻糖生成2′-FL,还会将2′-FL作为受体继续结合GDP-L-岩藻糖生成四糖副产物——乳糖二岩藻糖(difucosyllactose,DFL)[7]。CHIN等筛选到了来自于脆弱拟杆菌(Bacteroidesfragilis)的岩藻糖基转移酶WcfB,报道称该酶在合成2′-FL时没有副产物DFL生成进而有利于下游分离提取,利用表达有该酶的重组大肠杆菌可以获得15.4 g/L的产量,生产强度为0.53 g/(L·h)[30]。由于目前主流生产企业如巴斯夫、雀巢等公司的公开专利中仍使用大肠杆菌作为生产宿主,其主要原因是生长周期短、菌种构建难度低、更有利于盈利,因此有必要对探索去除内毒素的有效方法进行深入研究,提高工艺安全性。
5 展望
据中国发展研究基金会统计,我国的母乳喂养率不足30%,远低于国际平均水平。由于国内消费者对于母乳喂养的观念的逐渐形成,母乳类添加剂产品的前景十分光明。2′-FL作为母乳中含量最高的寡糖,其生理功效已获得了越来越多的佐证并取得广泛关注,产品需求旺盛,因此实现2′-FL国产化生产具有重要的国民健康战略意义。随着基因编辑等前沿技术的不断发展,未来针对生产菌株的食品安全性要求与日俱增,开发替代大肠杆菌的食品级底盘微生物将成为研发热点,未来可以结合代谢工程、蛋白质工程、启动子工程和发酵工程等多种修饰策略来进一步改良GRAS菌株作为2′-FL的生产平台。然而在产量和生产强度上能否媲美大肠杆菌的产量还有待验证。考虑到工业化对生产成本的较高要求,开发以葡萄糖或廉价生物质(纤维素水解液、糖蜜、菊粉等)为碳源的2′-FL制备方法有利于增强技术路线的竞争力。同时,寻找高效的岩藻糖基转移酶,根据蛋白质结构合理设计酶来提高2′-FL产量是一个必需的策略。此外,酶(多酶)固定化可以实现酶的重复利用、降低生产成本、提高产品转化效率。目前利用固定化酶生产2′-FL的研究相对较少,因此酶固定化方法在2′-FL的酶法生产中具有良好的应用潜力。鉴于目前2′-FL的产量已达到数每升数十克以上,未来在婴幼儿配方产品中大规模使用指日可待,将对该领域市场产生前所未有的推动作用。
