结肠癌中P2X7受体表达水平及其与患者预后的关系
2021-12-27邸泰霖纪云兆蒋文静王子斌刘大鹏
邸泰霖, 纪云兆, 蒋文静, 孔 磊, 王子斌, 刘大鹏
结肠癌是40~50岁男性高发的一种消化系统恶性肿瘤,本病病因与患者饮食习惯、结肠慢性炎症、结肠息肉及家族史等有关[1]。近些年的研究显示,癌基因激活及抑癌激活失活也是本病的重要影响因素[2]。P2X亚单位受体(P2X7)是嘌呤家族受体的一种,具有细胞外核苷酸结合能力,并以此向细胞内传递信号,进而调节肿瘤细胞生长、增殖,同时影响细胞凋亡进程[3]。P2X7受体还可抑制糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)表达,进而阻滞Wnt/β-catenin经典信号路径活化,而Wnt/β-catenin信号路径是结肠癌上皮间质转化的重要诱因,与结肠癌发生、发展密切相关[4]。本研究通过研究结肠癌患者的癌组织标本及癌旁组织标本中的P2X7受体表达情况,探讨P2X7受体表达与结肠癌肿瘤特征及患者预后的关系。
1 资料与方法
1.1 一般资料 选取2017年1月—2018年1月在河北中石油中心医院手术治疗的120例结肠癌患者,其中男65例,女55例;年龄47~75岁,平均(63.5±7.6)岁;病灶部位:左半结肠77例、右半结肠43例;病灶直径:≥ 5 cm 65例、<5 cm 55例;肿瘤分化程度:高分化26例、中分化45例、低分化49例;TNM分期:Ⅰ期13例、Ⅱ期34例、Ⅲ期73例;切缘阳性26例;淋巴结转移阳性70例。本研究方案经医学伦理委员会批准后实施。纳入标准:1)经病理学检查证实为结肠癌患者,结肠癌的诊断标准参考《中国结直肠癌诊疗规范(2020年版)》[5]中的标准;2)年龄18~75岁;3)术前患者未接受放疗、化疗、免疫学治疗;4)具有完整的随访资料。排除标准:1)病理学资料缺失;2)转移性结肠癌患者。
1.2 方法 采用免疫组化染色检测P2X7受体的阳性表达率:将两组样本进行包埋、切片后,采用烘箱对切片进行烘烤,温度设置为62 ℃,时长为1~2 h。随后进行脱蜡及水化操作,并选用0.01 mol/L柠檬钠抗原修复液进行修复操作,滴入2 mL 3% H2O2抑制样本酶活性,DAB染色苏木精复染,流水冲洗2次,盐酸乙醇分化2 s,流水冲洗10 min,梯度乙醇洗脱,透明并封片,镜下观察结果(XSP7B,双目生物显微镜,上海万衡精密仪器有限公司)。评分标准[6]:根据病理切片中阳性细胞的百分比和着色的强度,由2位病理科医生进行半定量免疫组织化学评分。评分标准为:阳性细胞的百分比≤10%为0分,11%~25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分。着色强度:0分为不着色;1分浅黄色;2分黄色;3分棕褐色。取上述两项分值的乘积作为总积分:0分为阴性(-),1~4分为弱阳性(+),6~8分为阳性(++),9~12分为强阳性(+++)。其中(+)及以下为低表达,(++)及以上为高表达。
1.3 观察指标 记录患者年龄、性别、肿瘤部位等一般资料,随访记录患者预后及生存期,分析不同预后患者的病理学特征差异,同时分析P2X7受体与患者3年预后结局的关系。
1.4 统计学处理 采用SPSS 21.0软件进行数据分析,计量资料以表示,两组间比较采用t检验;计数资料以例(%)表示,比较采用χ2检验;P2X7受体表达与患者生存的关系采用Kaplan-Meier法进行生存分析,多因素分析采用Logistic回归分析法;以P<0.05为差异有统计学意义。
2 结果
2.1 两组标本中P2X7受体表达水平比较 结肠癌组织中P2X7受体高表达率低于癌旁组织,差异有统计学意义(P<0.05),见表1、图1。

表1 两组标本中P2X7受体表达水平比较
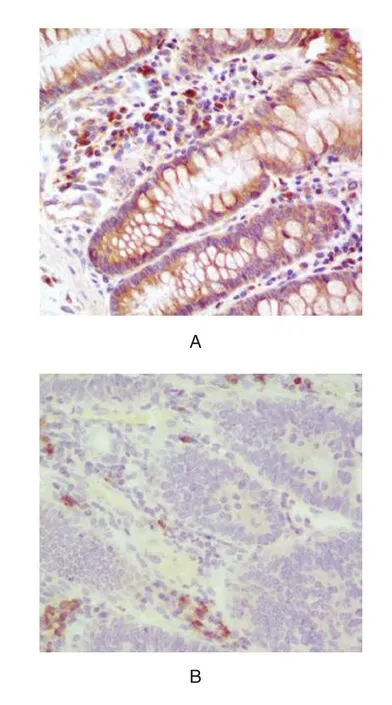
图1 免疫组化结果(SP,×200)
2.2 P2X7受体不同表达患者的3年生存情况比较 随访3年,P2X7受体低表达组患者的死亡率高于高表达组,差异有统计学意义(P<0.05,表2)。生存分析结果显示,P2X7受体低表达组患者的生存时间长于高表达组患者,差异有统计学意义(Log Rank χ2=4.652,P=0.031,图2)。

表2 不同P2X7受体表达患者的3年随访情况比较
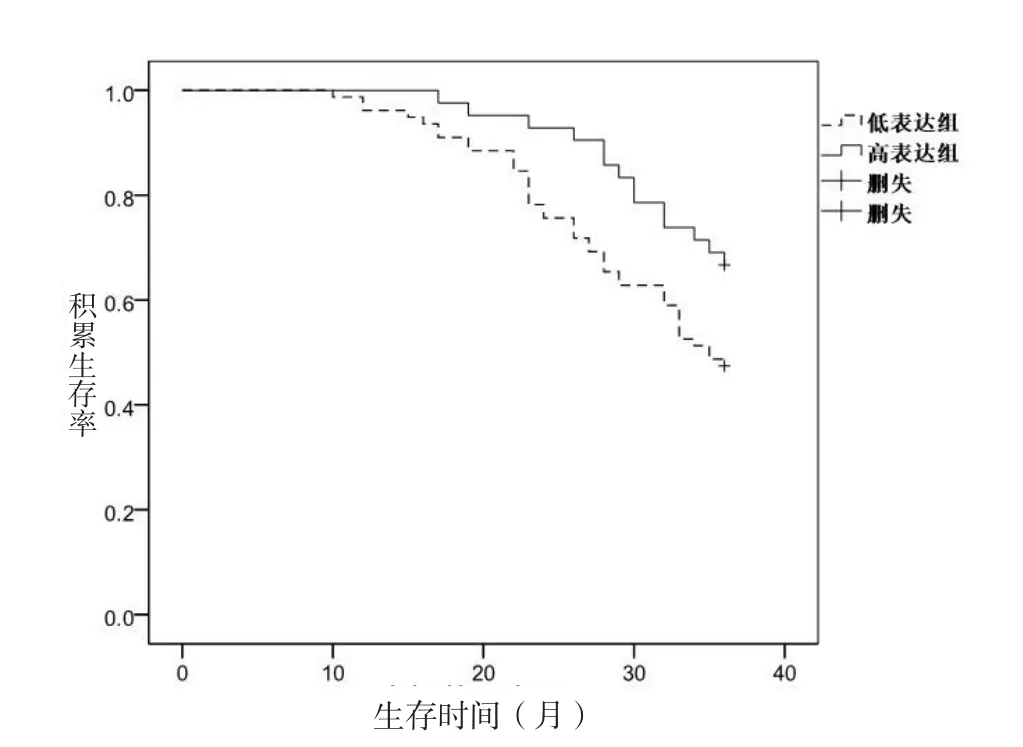
图2 P2X7低表达组与高表达组的生存曲线
2.3 单因素分析结果 存活组与死亡组患者的肿瘤分化程度、TNM分期、切缘阳性率、淋巴结转移情况、脉管浸润情况比较,差异有统计学意义(P<0.05);两组年龄、性别、肿瘤部位、病灶直径、术后化疗情况比较,差异无统计学意义(P>0.05),见表3。
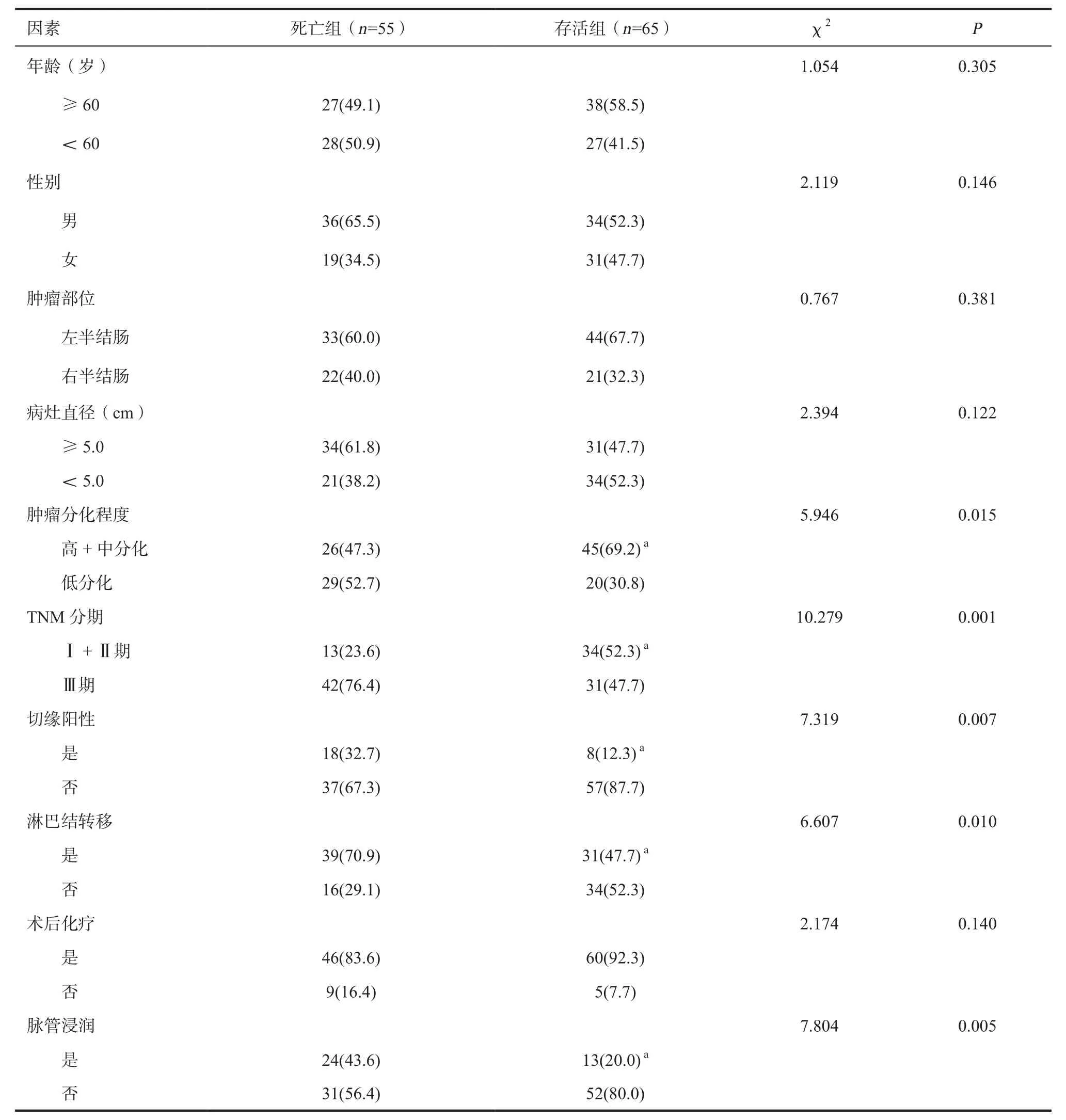
表3 单因素分析结果[n(%)]
2.4 多因素分析 以患者3年随访结局为因变量(生存=0、死亡=1),以肿瘤分化程度(高+中分化=0、低分化=1)、TNM分期(Ⅰ+Ⅱ期=0、Ⅲ期=1)、切缘阳性(否=0、是=1)、淋巴结转移(否=0、是=1)、脉管浸润(否=0、是=1)、P2X7受体(低表达=0、高表达=1)作为自变量,进行Logistic回归分析,结果显示:TNM分期高、切缘阳性、淋巴结转移阳性、脉管浸润、P2X7受体低表达是结肠癌患者不良预后的独立危险因素(P<0.05),见表4。

表4 Logistic回归分析结肠癌患者不良预后的影响因素
3 讨论
P2X7受体是炎症反应的重要介质之一,葡聚糖硫酸造模的结肠炎小鼠病灶组织内存在P2X7受体高表达情况,结肠炎诱导的结肠肿瘤病灶内也可见P2X7受体高表达情况[7]。但近年研究显示,P2X7受体虽然具有促急性肠炎发生的发展的能力,但也可抑制结肠炎相关性结肠癌进展[8-9]。动物实验显示,对炎症性疼痛大鼠加以干预,通过使P2X7受体表达下调,进而产生镇痛效应[10]。本研究发现,结肠癌组织中P2X7受体高表达率低于癌旁组织,差异有统计学意义,可以发现P2X7受体低表达与结肠癌病理变化密切相关。P2X7受体是肿瘤腺苷三磷酸(ATP)信号转导的关键节点,其介导的P2X7受体及P2X7受体信号路径对肿瘤细胞生长、自噬以及存活/凋亡平衡具有重要影响[11]。有研究发现,P2X7受体可通过激活NLRP3/IL-1β信号通路,参与了大鼠炎性疼痛的形成[12]。还有研究发现,宫颈癌黏膜表面可见明显P2X7受体低表达,推测P2X7受体低表达可能是宫颈癌病变的重要危险因素,同时也可能是宫颈癌靶向治疗的新方向[13]。
本研究发现,随访3年,P2X7受体低表达组患者的死亡率为52.6%,高于高表达组的33.3%,差异有统计学意义;此外,P2X7受体低表达组患者的生存时间短于高表达组患者,差异有统计学意义,这表明P2X7受体表达水平还与结肠癌患者预后密切相关,P2X7受体检测可能是结肠癌患者预后评估的重要方法。分析P2X7受体抑制结肠癌进展,改善患者预后的机制可能为:1)P2X7受体活化可直接阻滞肿瘤细胞生长、分裂[14];2)P2X7受体可诱导肠道IL-1β表达,并促使信号传导与转录激活因子3(STAT3)活化,提示P2X7受体可增强肠道细胞免疫功能,进而抑制肿瘤细胞活性[15];3)P2X7受体活化后将生成非选择性阳离子通道,并诱使Ca2+及Na+内流,K+外流,这将介导多种信号路径:Na+内流,K+外流将激活ASPK/JNK路径,并诱导细胞凋亡;Ca2+内流将诱导磷脂酶D表达,并促使溶酶体与吞噬小体结合,进而对细胞内病原体形成灭杀;Ca2+内流还可诱导丝裂原活化蛋白激酶p38及细胞外信号调节酶1/2(ERK1/2)表达,进而介导下游COX-2和诱导型一氧化氮合酶(iNOS)炎性蛋白基因表达,同时参与炎症反应[16]。iNOS在肿瘤中的效应不一,而P2X7受体可通过调节iNOS表达来抑制结肠炎相关性结肠癌。K+外流则可诱导炎性小体3表达,并活化含半胱氨酸的天冬氨酸蛋白水解酶-1(Caspase-1),进而诱导白细胞介素-1β(IL-1β)及白细胞介素 -18(IL-18)合成[17];4)P2X7受体可抑制TGF-β1表达,而后者具有促上皮细胞增殖、抑制肿瘤特异性细胞毒性T细胞活性等功能;5)Wnt/β-catenin信号路径与结肠上皮细胞增殖及瘤变密切相关。而P2X7受体可对GSK-3β生成抑制效应,进入阻滞Wnt/β-catenin信号路径活化,抑制结肠肿瘤生长、增殖[18]。Logistic回归分析结果显示:TNM分期越高、切缘阳性、淋巴结转移阳性、脉管浸润、P2X7受体低表达是结肠癌患者不良预后的独立危险因素,临床可通过检测这些指标来分析结肠癌患者的预后。
综上所述,结肠癌组织中的P2X7受体呈低表达,并且是患者预后不良的独立危险因素之一,临床或可通过监测患者P2X7受体水平来评估患者的预后。
