西维来司他对急性肺损伤小鼠NLRP3炎症小体的作用研究*
2021-12-27韩艳奇高志丹陈清杰黄翠萍
韩艳奇,高志丹,陈清杰,黄翠萍
(1.湖北科技学院药学院,湖北 咸宁 437100;2.湖北科技学院糖尿病心脑血管湖北省重点实验室;3.湖北科技学院护理学院)
西维来司他(sivelestat,SV)是一种选择性中性粒细胞弹性蛋白酶抑制剂,已被报道对内毒素诱导的仓鼠、豚鼠和绵羊肺损伤有效[3-4]。在日本进行的Ⅲ期和Ⅳ期研究显示[5-6],SV能缩短患者机械通气时间和重症监护病房的停留时间,延长急性肺损伤患者的生存期。但SV与NLRP3炎症小体的关系研究甚少,本研究通过脂多糖LPS复制急性肺损伤小鼠模型,检测肺组织NLRP3炎症小体及其相关信号分子的表达变化,探讨SV对急性肺损伤小鼠肺组织的作用和机制。
1 材料与方法
1.1 试剂与仪器
1.1.1 主要试剂与动物
32只7周龄雄性C57BL/6小鼠,体质量为22~26g,购自辽宁长生生物技术股份有限公司。LPS购自北京索莱宝科技有限公司(L8880-10mg);OLT 1177购自上海易汇科技有限公司(HY-W011082);SV购自上海易汇科技有限公司(HY-17443);ELISA试剂盒购自武汉赫尔生物科技有限公司(SU-BN20174);NLRP3抗体购自CST(15101S);CASPASE-1购自ABclonal(A0964);p-NF-κB抗体购自ABclonal(AP0123);NE(ELANE)购自ABclonal(A13015);IL-18购自Immunoway(YN1926);IL-1β购自Immunoway(YT2322);β-actin抗体购自ABclonal(AC026);BCA蛋白定量试剂盒,购自上海翊圣生物科技有限公司。
1.1.2 仪器
水平摇床(海门市其林贝尔仪器制造有限公司);电泳槽、电转膜仪(Bio-Rad公司);多功能酶标仪(美国Bio-Tek 公司);化学发光凝胶成像系统(Bio-Rad公司);研磨仪(武汉塞维尔生物科技有限公司)。
1.2 方法
1.2.1 动物模型与实验分组
将32只C57BL/6小鼠在标准动物饲养间内,给予无菌水和食物饲养一周,随机分为4组(每组8只):正常对照组(CON)、模型组(LPS)、模型+SV组(LPS+SV)、模型+NLRP3抑制剂组(LPS+OLT)。正常对照组腹腔注射生理盐水(20mg/kg);模型组腹腔注射LPS (20mg/kg),制备急性肺损伤(ALI)模型;SV治疗组在造模前5d每天腹腔注射SV(100mg/kg);NLRP3抑制剂组在造模前12h内腹腔注射OLT 1177(200mg/kg),分5次给药,最后一次腹腔注射OLT 1177(40mg/kg)1h后,腹腔注射LPS(20mg/kg)。4组小鼠均12h后处死,留取标本,进行下一步实验。
2.1 开发主体环保意识薄弱 旅游资源作为一种资源,不论是可再生还是不可再生,在其使用过程中不可避免会受到破坏,绝大多数生态旅游资源都具有破坏容易恢复难的特性。随着景区知名度的提升,加上游客日益多样化的需求,旅游目的地不得不想办法对资源进行深度的挖掘和再次开发。受经济利益的驱使,常常使得旅游开发具有盲目性,可能会使得资源过度开发而超过自身恢复限度。张家界国家森林公园,由于对修建性建设项目控制不够,造成水质污染,曾被联合国教科文组织亮出黄牌警告,当地政府为了恢复景区原貌,花费了上亿元人民币。
1.2.2 肺含水量测定
取右肺上叶,吸水纸吸干表面水分及血液,称重。置于80℃烘箱72h后称量肺干重,计算湿干重之比(W/D)。
1.2.3 小鼠肺组织中IL-1β表达水平
小鼠颈椎脱臼处死,取右肺下叶部分组织,称重,加入PBS缓冲液(组织∶PBS=1∶9),冰上剪碎组织,采用研磨仪充分匀浆,收集上清。通过酶联免疫法检测肺组织中IL-1β的表达水平,操作均按ELISA试剂盒说明书进行。
1.2.4 小鼠肺组织中NLRP3炎症小体相关蛋白以及中性粒细胞弹性蛋白酶表达水平
取适量肺组织,称重,加入一定体积比例(组织∶RIPA=1∶30)的RIPA裂解液、PMSF、磷酸酶抑制剂A液、磷酸酶抑制剂B液混合液(RIPA∶PMSF∶PA∶PB=100∶1∶1∶1),在碎冰上剪碎组织,冰上静置20min,裂解小鼠肺组织,利用研磨仪匀浆,离心,取上清,酶标仪562nm波长条件下进行蛋白定量,蛋白含量采用BCA试剂盒检测。定量后的蛋白样品取10μL进行上样,采用8%~15%的SDS-PAGE分离胶进行蛋白电泳,PVDF膜转膜2h,室温下用5%脱脂奶粉进行封闭1h,用ECL化学发光显影,凝胶成像系统检测NLRP3、p-NF-κB、CASPASE-1、IL-1β、IL-18、NE蛋白的表达变化。
1.2.5 肺组织病理损伤观察
取各组小鼠右肺中叶组织,迅速放入4%多聚甲醛液中固定,脱水,石蜡包埋,切片,然后用苏木精-伊红(hematoxylin-eosin,HE)染色,光学显微镜下观察。
1.3 统计学方法

2 结 果
2.1 各组小鼠临床表现
CON组小鼠活动状态正常,正常摄食、正常饮水。模型组在腹腔注射LPS 12h时,出现步态蹒跚、精神萎靡、呼吸浅快或深快、节律不齐,时有呼吸困难、眼神涣散。小鼠均存活,无死亡。
2.2 肺含水量比较
与CON组相比,LPS组小鼠肺W/D升高,差异有统计学意义(P<0.05);与LPS组比较,LPS+SV组显著下降,差异有统计学意义(P<0.05);LPS+OLT组与LPS组比较有所下降,但无统计学差异(P>0.05)。见图1。

与CON组比较,*P<0.05;与LPS组比较,#P<0.05
2.3 肺组织中炎症因子IL-1β含量的比较
ELISA法测定结果显示,与CON组比较,LPS组IL-1β表达水平显著升高(P<0.05);LPS+SV组IL-1β表达水平较LPS组高,而LPS+OLT组IL-1β表达水平较LPS组低(P<0.05),作用与CON组相当(见图2),此结果表明,SV不能够抑制NLRP3炎症小体下游的炎症因子IL-1β的释放。

与CON组比较,*P<0.05;与LPS组比较,#P<0.05
2.4 SV对NE蛋白的影响
如图3所示,Western blotting结果显示:与CON组相比,LPS组中性粒细胞弹性蛋白酶(NE)表达显著性增多(P<0.05);SV作为一种选择性中性粒细胞弹性蛋白酶抑制剂,与LPS组相比较,能够显著性抑制NE的表达(P<0.05),且治疗作用与CON组相当;而NLRP3炎症小体抑制剂并没有降低NE的表达。

与CON组比较,*P<0.05;与LPS组比较,#P<0.05
2.5 SV对p-NF-κB蛋白的影响
Western blotting法检测各组小鼠肺组织中的p-NF-κB蛋白表达变化,结果见图4。与CON组比较,LPS组p-NF-κB蛋白表达明显增多(P<0.05);与LPS组相比,LPS+SV组p-NF-κB蛋白表达明显减少(P<0.05);同时,OLT 1177作为NLRP3炎症小体特异性抑制剂,抑制了p-NF-κB蛋白表达,但统计学上无意义(P>0.05)。
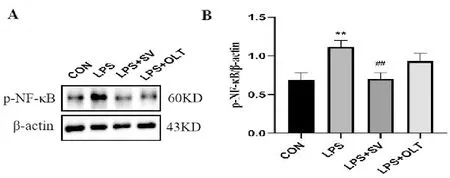
与CON组比较,**P<0.01;与LPS组比较,##P<0.01
2.6 SV对NLRP3炎症小体相关蛋白的影响
Western blotting法检测各组小鼠肺组织中NLRP3炎症小体相关蛋白NLRP3、CASPASE-1、IL-18以及IL-1β的表达情况,结果如图5所示。与CON组相比,LPS组NLRP3蛋白表达显著性增多(P<0.01),CASPASE-1、IL-18以及IL-1β蛋白表达均显著性增多(P<0.05);与LPS组相比,LPS+SV组中NLRP3蛋白表达明显下调(P<0.001)、CASPASE-1蛋白表达明显减少(P<0.05)、IL-18蛋白表达显著性降低(P<0.01)、IL-1β蛋白的表达变化并没有降低(P>0.05),LPS+OLT组中的IL-1β蛋白表达显著性降低(P<0.05)。此结果说明,SV能够部分抑制NRLP3炎症小体的活化。

与CON组比较,**P<0.01;与LPS组比较,#P<0.05,##P<0.01,###P<0.001
2.7 SV对LPS诱导的小鼠肺组织病理学改变的影响
光学显微镜下观察,HE染色结果显示(图6,封二):CON组肺泡结构清晰完整,无异样;LPS组出现明显病理学改变,包括炎性细胞浸润、肺泡水肿、肺泡壁增厚以及肺泡紊乱;而LPS+SV组以及LPS+OLT组明显抑制了肺组织的病理学改变。
3 讨 论
急性肺损伤是指在严重感染、创伤、烧伤、休克等各种致病因素下诱发的急性、进行性呼吸功能不全等症状,其主要病理改变为肺泡-毛细血管通透性增加、炎性细胞聚集,临床上会出现明显的呼吸窘迫以及顽固性低氧血症。因其发病机制极为复杂,急性肺损伤仍然是现代危重病医学的重大难题,目前尚无有效的治疗方法。
据报道[7],炎症在ALI中起着关键作用,炎症小体是炎症相关疾病的重要治疗靶点。炎症小体是由多种蛋白质组成的复合体,其中NLRP3炎症小体是当代研究热点之一,可以被细菌脂多糖(LPS)、K+外流、Ca2+信号、活性氧(ROS)、线粒体功能障碍和溶酶体破裂等多种成分活化[8]。NLRP3受体蛋白含有PYD、NACHT、LRR三个结构域。当激动剂接触受体蛋白时,NLRP3的PYD结构域与ASC的PYD结构域结合,进而ASC中的CARD结构域与效应蛋白CASPASE-1的CARD结构域结合,从而活化NLRP3炎症小体,释放IL-1β和IL-18,诱导免疫细胞的浸润及其他细胞因子的产生,导致相应组织发生炎性损伤[9]。相关研究[10]表明,通过生物信息学预测,含有3 (NLRP3)的类节点受体被认为是miR-495的一个可能靶点,miR-495启动子的甲基化可以抑制miR-495的表达,过表达miR-495可以抑制NLRP3炎性小体的激活,最终抑制LPS诱导的ALI的发展。Zhang 等研究[11]显示,在发生急性肺损伤的小鼠体内,NLRP3炎症小体被显著激活并释放了大量的IL-1β和有活性的CASPASE-1,褪黑素能够通过抑制细胞外组蛋白而抑制NLRP3炎症小体的激活;Cao等[12]认为,促红细胞生成素可以通过抑制EPOR/JAK2/STAT3信号通路有效抑制NLRP3炎症小体活化来减轻LPS诱导的急性肺损伤;枸杞多糖通过介导SIRT1抑制NLRP3炎症小体的活化而减轻高氧诱导的急性肺损伤[13]。以上研究充分证明了抑制NLRP3炎症小体的活化是治疗急性肺损伤的关键。本研究结果显示,在LPS诱导的急性肺损伤小鼠体内,NLRP3、CASPASE-1等蛋白表达明显增多,NLRP3炎症小体明显被活化,释放的IL-18以及IL-1β介导了急性肺损伤的发生发展。应用NLRP3特异性抑制剂预处理后,显著降低了NLRP3、CASPASE-1、IL-18以及IL-1β等炎症小体相关蛋白的表达,进一步改善了肺组织的炎症浸润,从而对急性肺损伤起到保护作用。
作为中性粒细胞弹性蛋白酶抑制剂,SV可竞争性抑制中性粒细胞的活化,减少急性呼吸窘迫综合征过程中的中性粒细胞浸润,从而对肺部起到保护作用[14]。近年来,国内外多个动物肺损伤模型均表明SV对肺损伤有保护作用,主要机制是减少肺泡中以中性粒细胞为主的炎症细胞浸润,抑制NE产生,并改善肺损伤的症状[15-16],但其与NLRP3炎症小体的作用尚未明确。本研究结果提示,SV能够显著降低LPS引起的肺损伤小鼠的湿干比,明显改变肺组织的炎症浸润、中性粒细胞聚集等病理学改变,抑制肺组织中p-NF-κB、NLRP3、CASPASE-1、IL-18以及NE蛋白的表达水平,对LPS诱导的急性肺损伤起到保护作用,但不能减低肺组织中IL-1β蛋白的表达水平。这些结果表明,SV作为中性粒细胞弹性蛋白酶抑制剂,能够抑制NF-κB介导的p-NF-κB/NLRP3/CASPASE-1/IL-18通路,部分缓解急性肺损伤引起的NLRP3炎症小体活化。
综上所述,SV不仅能通过抑制中性粒细胞弹性蛋白酶的作用来减轻LPS诱导的急性肺损伤,还能通过部分抑制NLRP3炎症小体活化而缓解急性肺损伤引起的炎症作用。
