基于T2WI影像组学模型产前预测胎盘植入性病变
2021-12-26张天悦李缃琦郭爱文刘思耘
路 涛,张天悦,李缃琦,郭爱文,宋 彬,刘思耘
(1.四川省医学科学院·四川省人民医院放射科,四川 成都 610072;2.四川大学华西医院放射科,四川 成都 610037;3.GE医疗,北京 100176)
胎盘植入性病变(placenta accrete spectrum disorders, PAS)为胎盘绒毛不同程度侵入子宫肌层所致,是引起产科大出血的主要原因之一。影像组学可从形态学影像中提取高通量的定量信息,更具客观性,有利于分析病变特征。本研究评估基于产前MR T2WI的影像组学模型预测PAS的价值。
1 资料与方法
1.1 一般资料 回顾性分析2018年1月—2020年3月于四川省人民医院就诊的241例单胎妊娠孕妇,年龄19~45岁,平均(30.7±4.9)岁;孕22~38周,平均(32.05±3.98)周。纳入标准:具有PAS高危因素或超声提示PAS。排除标准:①患高血压、糖尿病及肾脏疾病;②严重幽闭恐惧症;③以引产结束妊娠;④资料不完整;⑤图像质量差。
术中诊断PAS标准:剖宫产术中见胎盘紧密粘连于子宫内膜,剥离胎盘时发生难以控制的出血;或需用钳刮术清除植入子宫肌层的胎盘组织;或肉眼可见胎盘组织侵入子宫壁全层,甚至超出子宫范围而侵犯周围器官[1]。病理诊断PAS标准:光镜下见胎盘绒毛侵入子宫肌层表面或侵入子宫肌层内,或见绒毛达子宫浆膜层或浆膜层外组织。
1.2 仪器与方法 采用Siemens Aera 1.5T MR仪,配备16通道体部相控表面线圈,嘱孕妇仰卧、足先进,行盆部扫描,范围自膈肌至耻骨联合。采用半傅里叶采集单次激发快速自旋回波(half-Fourier acquisition single-shot turbo spin-echo, HASTE)序列采集轴位及冠状位、矢状位T2WI,FOV 420 mm×420 mm,层厚5 mm,层间隔为1 mm,矩阵272×320,TR 1 300 ms,TE 93 ms,扫描时间50 s;真实稳态进动快速成像(true fast imaging with steady-state precession, TrueFISP)序列扫描,FOV 420 mm×420 mm,层厚5 mm,层间隔1.5 mm,矩阵234×384,TR 4.11 ms,TE 1.63 ms,扫描时间48 s。
1.3 影像组学分析
1.3.1 图像分割和特征提取 将HASTE-T2WI和TrueFISP-T2WI原始图像分别导入ITK-SNAP软件(3.6.0, open source, www.itksnap.org),由1名具有2年妇产科疾病MRI诊断经验的主治医师(医师1)逐层手动勾画胎盘边缘,由另1名具有10年以上经验的副主任医师(医师2)进行修改、确认,保存感兴趣容积(volume of interest, VOI),见图1,并测量宫颈管长度及胎盘厚度。将原始图像及VOI导入A.K.软件(GE Healthcare,version 3.3.0)提取特征。由另1名具有3年工作经验的影像科医师(医师3)随机抽取80例独立勾画胎盘VOI,提取其影像组学特征。以一致性相关系数(inter-class correlation coefficient,ICC)评价观察者间提取影像组学特征的一致性,ICC>0.75为一致性较好。

图1 勾画VOI示意图 手动逐层于轴位(A)、矢状位(B)、冠状位(C)HASTE序列图像上勾画胎盘(红色区域)边缘,形成融合VOI(红色区域)图(D)
1.3.2 影像组学特征的孕周校正 采用单因素线性回归对非PAS组的影像组学特征行孕周线性拟合[2],对PAS组影像组学特征行孕周校正。
1.3.3 筛选特征及建立模型 对训练集影像组学特征进行预处理,剔除一致性差者;以Spearman相关性分析及最小绝对收缩和选择算子(least absolute shrinkage and selection operator, LASSO)算法去除冗余特征,进一步筛选特征、实现数据降维,并采用后向逐步Logistic回归方法建立不同序列诊断PAS的影像组学模型,获得影像组学评分(Radscore)公式。
1.4 统计学分析及建立临床-影像组学模型 采用3.6.1版R软件(http://www.r-project.org)行统计分析。以±s表示符合正态分布的计量资料,以中位数(上下四分位数)表示不符合者,行独立样本t检验或Mann-WhitneyU检验。采用χ2检验比较计数资料。分别以单因素和多因素Logistic回归筛选PAS的临床危险特征,建立临床模型;采用Logistic回归方法对不同序列影像组学模型的Radscore及临床模型特征进行联合分析,获得不同临床-影像组学模型。于验证集对各模型进行验证。采用受试者工作特征(receiver operating characteristic, ROC)曲线和校准曲线评估模型的预测效能,以Delong检验比较不同模型曲线下面积(area under the curve, AUC)的差异。采用决策曲线分析(decision curve analysis, DCA)评估模型的临床应用价值。P<0.05为差异有统计学意义。
2 结果
241例中,131例接受剖宫产,110例顺产;其中116例PAS(PAS组),125例非PAS(非PAS组)。将所有患者按7∶3比例分为训练集(n=168)和验证集(n=73),训练集中77例PAS,91例非PAS;验证集中39例PAS,34例非PAS。
2.1 临床模型 单因素分析显示,年龄、孕周、前置胎盘、胎盘位置、流产史及流产次数、剖宫产史及剖宫产次数、妊娠次数、生产次数、宫颈管长度及胎盘厚度组间差异均有统计学意义(P均<0.05),见表1。经单因素及多因素Logistic回归分析,前置胎盘、流产史、剖宫产史及宫颈管长度是PAS的危险因素(P均<0.05,表2、3),由此建立临床模型。

表1 疑诊PAS孕妇临床特征比较(n=241)
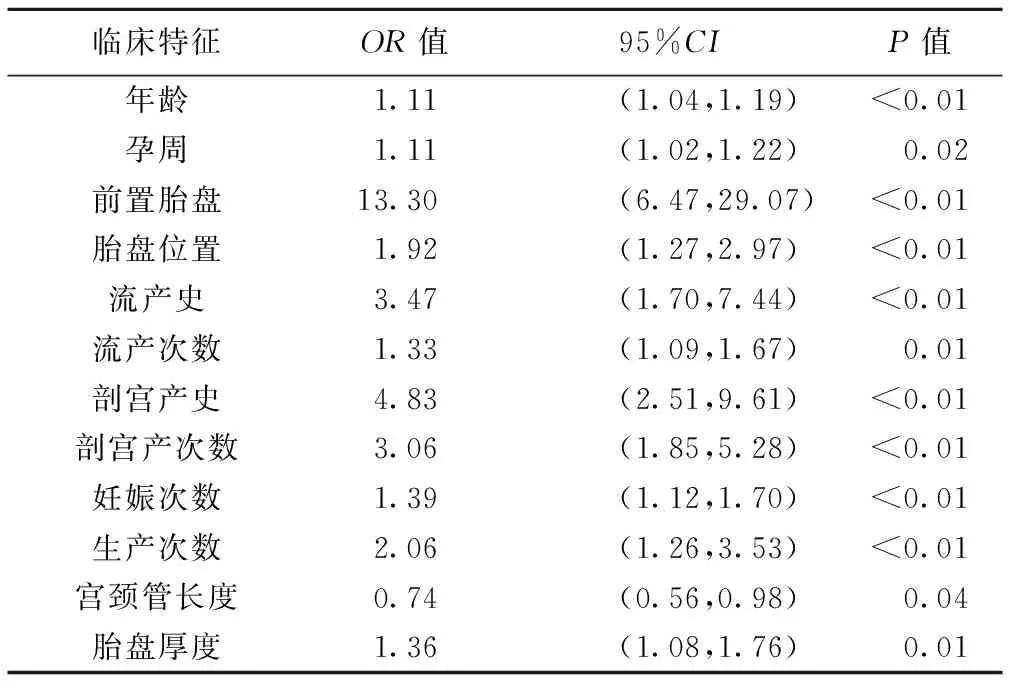
表2 PAS临床特征:单因素Logistic回归分析结果
2.2 影像组学模型 分别自各序列图像中提取1 130个影像组学特征,剔除601个一致性差者,保留529个特征。经LASSO算法等处理(图2),各筛选出9个影像组学特征,以之构建HASTE序列及TrueFISP序列影像组学模型,并构建影像组学及临床联合模型,包括HASTE联合TrueFISP影像组学模型、临床-HASTE影像组学模型、临床-TrueFISP影像组学模型及临床-HASTE-TrueFISP影像组学模型。

图2 筛选影像组学特征示意图 A、B.基于HASTE序列图像采用LASSO算法筛选影像组学特征(A)及得到特征的LASSO系数剖面图(B); C、D.基于TrueFISP序列图像采用LASSO算法筛选影像组学特征(C)及得到特征的LASSO系数剖面图(D)

表3 PAS临床特征:多因素Logistic回归分析结果
2.3 模型性能评估 ROC曲线(图3)显示,验证集中,临床模型、HASTE影像组学模型、TrueFISP影像组学模型诊断PAS的AUC分别为0.882、0.968和0.930(P均>0.05);HASTE-TrueFISP影像组学模型的AUC为0.990,高于临床模型(Z=-2.36,P=0.02)、HASTE影像组学模型(Z=-2.48,P=0.02)及TrueFISP影像组学模型(Z=-2.43,P=0.02),其特异度为86.50%,敏感度为94.40%;临床-HASTE-TrueFISP影像组学模型的AUC为0.995,与HASTE-TrueFISP影像组学模型差异无统计学意义(Z=-0.85,P=0.40),但高于HASTE及TrueFISP影像组学模型(Z=-2.64、-2.47,P均<0.05),其特异度为91.90%,敏感度为88.90%。
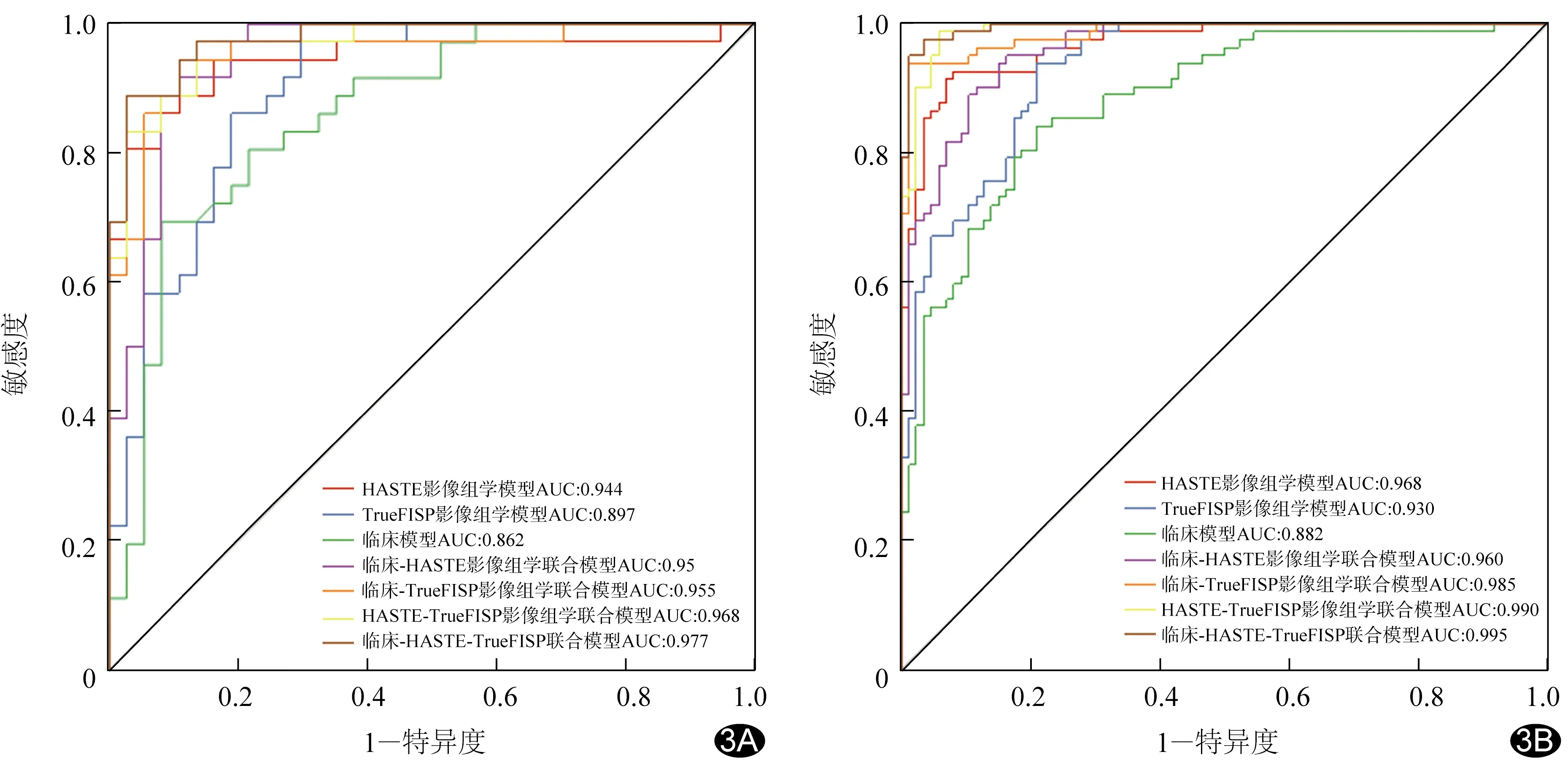
图3 各模型诊断PAS的ROC曲线 A.训练集; B.验证集
校准曲线显示,临床模型之外的各模型在验证集中的校准度均较好(贴近45°斜线),见图4;DCA显示,阈值取0~0.6时,其在验证集数据中的临床净获益均大于临床模型,见图5。

图4 训练集(A)和验证集(B)中各模型的校准曲线

图5 训练集(A)和验证集(B)中各模型的DCA
3 讨论
国际妇产科协会于2018年提出PAS的概念[3],包括胎盘粘连、胎盘植入及穿透性胎盘植入。既往研究[4]认为子宫手术史可致子宫内膜-肌层交界面缺损、相应子宫区域缺乏正常子宫蜕膜化,引起绒毛外滋养细胞浸润、绒毛组织侵入子宫肌层深面及血管内,甚至可侵犯周围盆腔器官,导致不同程度胎盘植入。MRI为诊断PAS的主要影像学方法之一,其主要依据为形态学及信号强度改变[5-6],但仍具有主观性。影像组学能从医学图像中提取大量的量化特征并进行分析,可用于评价胎盘的异质性。
熊星等[7]发现,基于临床特征及常规胎盘MRI征象的Logistic回归模型列线图可作为术前预测胎盘植入的辅助工具。CHEN等[8]将纹理分析方法用于诊断PAS,发现正常组与PAS组间像素强度及分形分析的标准差存在差异。ROMEO等[9]结合机器学习和纹理分析评价前置胎盘孕妇发生胎盘植入的可能,认为该方法有助于临床识别胎盘植入的发生。SUN等[1]以纹理分析和机器学习分析前置胎盘MRI表现,发现通过拉普拉斯变换和纹理分析可定量评价胎盘不均匀度,区分胎盘成熟所致异质性改变,有利于预测胎盘植入及协助临床制定决策。但上述研究样本量较小,且仅基于单一序列图像。
HASTE和TrueFISP序列均为快速成像序列,常用于胎盘MR扫描[10-11]。HASTE序列多用于评价子宫层次、胎盘结构、胎儿解剖和邻近器官,有利于增加胎盘内血管对比度;TrueFISP序列可区分子宫和胎盘流空血管与T2WI低信号带。本研究基于HASTE和TrueFISP图像进行分析,筛选出9个与PAS相关性较高的影像组学特征,并建立单一HASTE或TrueFISP影像组学模型及HASTE-TrueFISP影像组学模型。经多因素回归结果显示,前置胎盘、流产史、剖宫产史及宫颈管长度为PAS的独立危险因素,据此分别建立诊断PAS的临床模型和临床-影像组学联合模型。校准曲线显示,临床模型之外的其他各模型在验证集中的校准度均较好;ROC曲线发现,临床-HASTE-TrueFISP影像组学联合模型对验证集的诊断效能最高,与HASTE-TrueFISP影像组学模型相当;DCA显示,阈值取0~0.6时,上述模型对验证集的临床净获益均大于临床模型,提示HASTE-TrueFISP影像组学模型可用于预测PAS。
综上所述,基于产前HASTE及TrueFISP序列图像的联合影像组学模型有助于预测PAS。本研究的主要局限性:①为单中心回顾性研究,存在选择性偏倚;②样本量小,未进一步分析不同程度PAS。
