超微血管成像和超声造影评估多发性大动脉炎活动性
2021-12-26王亚红田新平葛志通杨云娇李建初
王亚红,田新平,葛志通,王 莹,李 菁,张 莉,陈 钰,杨云娇,李建初*
(1.中国医学科学院 北京协和医学院 北京协和医院超声医学科 疑难重症及罕见病国家重点实验室,2.风湿免疫科,3.放射科,北京 100730)
多发性大动脉炎(Takayasu arteritis, TA)是主要累及主动脉及其分支的慢性非特异性炎症,多见于青年女性,起病隐匿、病程长,患者多需长期服用免疫抑制剂。为控制病情进展、减少药物不良反应,临床需根据TA炎症活动状态不断调整药物种类和剂量,但目前尚缺乏评价TA炎症活动性的特异性血清学指标[1]。目前多种形态及功能影像学方法已被用于评估TA炎症活动性[1]。18F-FDG PET/CT评价TA活动性具有较高敏感度及特异度[2],但费用高昂且有辐射。MR血管成像和超声造影(contrast-enhanced ultrasonography, CEUS)安全性高,有助于判定TA活动性[3-4]。超微血管成像(superb microvascular imaging, SMI)无需注射造影剂即可显示微米级血管,已成功用于评估各组织、器官及病灶[5]。本研究采用SMI及CEUS评估TA活动性。
1 资料与方法
1.1 研究对象 纳入2020年11月—2021年4月47例于北京协和医院确诊的TA患者,均为女性,年龄18~48岁,平均(30.1±7.0)岁;均符合文献[6]诊断标准;单侧7例、双侧 40例共87支颈总动脉受累;16例累及主动脉弓及分支(Ⅰ型),3例累及升主动脉、主动脉弓及分支(Ⅱa型),4例累及腹主动脉以上的主动脉及分支(Ⅱb型),24例广泛累及主动脉(Ⅴ型,其中2例伴肺动脉受累)[7]。根据TA活动性进行分组[8]:活动期组21例,年龄18~48岁,平均(30.1±7.9)岁,共38支颈动脉受累;稳定期组26例,年龄18~40岁,平均(31.5±6.1)岁,共49支颈动脉受累。检查前患者均签署知情同意书。
1.2 仪器与方法 采用Philips iU22彩色多普勒超声诊断仪,9L线阵探头,频率3~9 MHz,常规扫查颈动脉,记录受累节段,于纵切面多点测量管壁厚度,确定最厚处管壁厚度及变化值(当前管壁厚度与前次随访管壁厚度的差值)、管腔最窄处内径、外径及内/外径比值。根据病情决定随访间隔,每次随访均测量管壁厚度,并确定最厚处管壁厚度变化值,测量3次,取平均值作为最终结果。
1.2.1 CEUS 选择内置造影条件行颈动脉CEUS。将Brocco声诺维与5 ml无菌生理盐水制成混悬液,经肘静脉进行弹丸式注射,随后以生理盐水冲洗;每次注射1.2 ml,观察单侧颈动脉3 min以上,记录增厚管壁内造影剂灌注情况;2次注射之间间隔15 min以上。根据颈动脉增厚管壁增强情况将其分为3级[9]:0级,无增强;Ⅰ级,增厚管壁内可见散在稀疏点线状造影微泡填充(1~4个点状增强或1~2条短线状增强),即轻度增强;Ⅱ级,增厚管壁内可见弥漫性点线状或片状造影剂微泡填充(>4个点状增强或>2条短线状增强),即明显增强。
1.2.2 SMI 于CEUS同日行SMI。采用佳能Aplio900彩色多普勒超声诊断仪,PLT-704SBT线阵探头,频率4~11 MHz。检查期间保持参数设置一致,采用mSMI条件,根据颈动脉增厚管壁内微细血流分布情况将其分为3级[9]:0级,无血流信号;Ⅰ级,可见1~4个点状或1~2条短线状血流信号;Ⅱ级,可见>4个点状或>2条短线状血流信号(图1、2)。

图1 患者女,30岁,活动期组 A.CEUS图示颈动脉增厚管壁内可见多处点线状造影微泡填充(箭),为Ⅱ级; B、C.SMI于增厚管壁内可见多处短线状血流信号(箭),为Ⅱ级
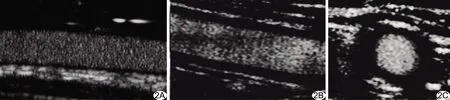
图2 患者女,23岁,稳定期组 A.CEUS图示增厚的动脉壁内未见造影微泡填充,为0级; B、C.SMI于增厚管壁内未见血流信号,为0级
以上检查均由2名具有5年以上工作经验的超声医师完成,意见存在分歧时经讨论决定。
1.3 临床资料 记录7日内实验室检查结果,包括红细胞沉降率(erythrocyte sedimentation rate, ESR)、高敏C反应蛋白(high sensitivity C reactive protein, hs-CRP)、白细胞介素-6(interleukin-6, IL-6)及肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)。
1.4 统计学分析 采用SPSS 23.0统计分析软件。以±s表示符合正态分布的计量资料,组间行独立样本t检验;以中位数(上下四分位数)表示不符合正态分布的计量资料,组间行秩和检验。以Pearson相关性分析评价CEUS与SMI对于增厚颈动脉管壁分级标准的相关性,│r│≥0.8呈高度相关,0.5≤│r│<0.8呈中度相关,0.3≤│r│<0.5呈低度相关,│r│<0.3呈弱相关。绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC),评价CEUS及SMI指标评估TA活动性的效能。P<0.05为差异有统计学意义。
2 结果
2.1 基本资料 活动期组与稳定期组患者年龄差异无统计学意义(t=-0.73,P=0.47);组间ESR、hs-CRP、IL-6、TNF-α差异均无统计学意义(P均>0.05),见表1。

表1 活动期与稳定期TA患者实验室检查比较
2.2 常规超声 组间受累颈动脉管壁厚度、管壁厚度变化值、管腔内径及内/外径比值差异均有统计学意义(P均<0.05),外径差异无统计学意义(P>0.05),见表2。以管壁厚度评估TA活动性的AUC为0.680,截断值取2.75 mm时,敏感度为46.67%,特异度为87.23%;以管壁增厚幅度评估TA活动性的AUC为0.680,截断值取0.15 mm时(管壁厚度变化值为负数时,增厚幅度记为0),敏感度为63.33%,特异度为89.36%,见图3。
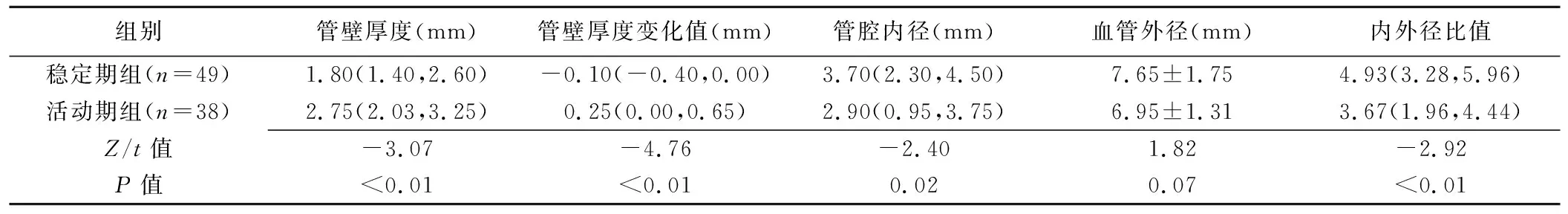
表2 活动期与稳定期TA患者受累颈动脉常规超声参数比较

图3 超声评估TA活动性的ROC曲线
2.3 CEUS和SMI CEUS和SMI对于受累颈动脉的分级结果见表3。SMI与CEUS分级标准呈中度相关(r=0.70,P<0.01)。以CEUS分级评估TA活动性的AUC为0.773,CEUS Ⅱ级(明显增强)判断活动期TA的敏感度为60.52%,特异度为95.92%;以CEUS 0级(无增强)判断稳定期TA的敏感度为28.57%,特异度为86.84%。以SMI分级评估TA活动性的AUC为0.712,以SMI Ⅱ级判断活动期TA的敏感度23.68%、特异度100%,SMI 0级判断稳定期TA的敏感度53.06%、特异度为78.95%。见图3。

表3 活动期与稳定期TA患者受累颈动脉CEUS和SMI分级
3 讨论
目前主要依靠临床综合指标评估TA活动性,仅凭临床表现、血清学或影像学指标难以获得理想效果。除ESR、hs-CRP外,IL-6及TNF-α等血清学指标预测TA活动性和转归均具一定价值[10]。本研究活动期组ESR高于稳定期组,其他指标组间并无显著差异。
影像学检查中,PET/CT可明确诊断TA活动性[2],超声指标如管壁厚度、血管外径及回声强度等指标也具有一定诊断价值[11]。本研究分析TA累及颈动脉管壁厚度变化值,发现以管壁厚度增加0.15 mm作为判断TA活动性的指标具有较高特异度(89.36%),提示超声可作为监测TA病情的有效影像学方法,尤其在国内TA患者锁骨下动脉和颈动脉受累最为常见的背景下,超声评估TA活性具有明显优势[12]。
动脉壁滋养血管在TA发生、发展中具有重要作用。在TA活动期,滋养血管扩张充血、管壁通透性增加,炎细胞释放各种细胞因子,使滋养血管增殖、数量增加;而在稳定期,纤维细胞和纤维组织增生,动脉壁有功能的滋养血管减少[13]。因此,评估滋养血管有望间接反映TA炎症活动状态。
2011年,MAGNONI等[14]将CEUS用于1例TA患者,发现受累增厚的颈动脉管壁内出现弥漫性增强;此后CEUS对于TA的研究逐渐深入。CEUS判定TA活动性具有一定价值[4,15],且与PET/CT的一致性较好[16]。李民等[17]以CEUS存在明显增强作为判定TA活动性的标准,敏感度为50%,特异度达100%;以无增强作为判定TA非活动性的标准,敏感度为95%,特异度达100%。本研究根据CEUS所示受累颈动脉壁增强程度判断活动期TA的特异度较高,但未达100%,而以无增强判断稳定期TA的敏感度不足,考虑与稳定期组颈动脉管壁较厚、 Ⅰ级(轻度增强)比例较高有关。另外,本研究以CEUS明显增强判断活动期TA的敏感度为60.52%,与既往研究[17-18]类似,可能与病变严重程度有关:本组初诊TA较少,多已规范用药,对炎症反应程度有所影响。
与CEUS相比,SMI亦可观察动脉管壁微细血管,且无需注射造影剂,更为便捷。本研究中以SMI Ⅱ级判断活动期TA的特异度达100%,提示当颈动脉增厚管壁内出现大量微细血流信号时,预示TA处于活动期。王丽娟等[9]采用SMI与CEUS评估TA活动性,发现二者评价活动期TA具有良好一致性(Kappa=0.768,P<0.01),而对稳定期组的一致性不佳(P>0.05)。本研究结果显示,SMI和CEUS对于受累颈动脉的分级标准中度相关,可能由于SMI对微细血流的分辨力不如CEUS,且易受动脉搏动的影响,使两者难以达到高度一致。
综上,CEUS及SMI均有望成为评估TA活动性和随访的常规检查方法;SMI更加便捷、价廉,适用范围更广。本研究的主要不足之处在于CEUS和SMI分级标准难以实现严格标准化,且未获得病理证实。
