常规超声联合超声造影鉴别诊断甲状腺恶性与炎性病灶
2021-12-26朱天彤庄连婷马孝芬赵傲雪
朱天彤,庄连婷,马孝芬,赵傲雪,黄 瑛
(中国医科大学附属盛京医院超声科,辽宁 沈阳 110004)
甲状腺疾病是最常见的内分泌疾病之一,人群患病率约20%~50%,包括甲状腺功能异常、甲状腺炎症及甲状腺肿瘤等[1]。超声是最常用于诊断甲状腺疾病的影像学手段,具有较高的准确率、敏感度及特异度;但甲状腺炎性病变[如亚急性甲状腺炎(subacute thyroiditis, SAT)及桥本甲状腺炎(Hashimoto thyroiditis, HT)]与部分恶性病灶[如甲状腺乳头状癌(papillary thyroid carcinoma, PTC)及原发性甲状腺淋巴瘤(primary thyroid lymphoma, PTL)]二维超声均可表现为边缘模糊的低回声灶,导致鉴别诊断困难[2]。超声造影(contrast-enhanced ultrasound, CEUS) 可较为客观地反映实质性器官正常组织及病变的血流灌注情况,有助于诊断甲状腺疾病[3]。本研究观察常规超声联合CEUS鉴别诊断甲状腺恶性与炎性病灶的价值。
1 资料与方法
1.1 研究对象 选取2020年3月—2021年3月78例于中国医科大学附属盛京医院接受甲状腺常规超声及CEUS检查的甲状腺疾病患者,男14例,女64例,年龄18~69岁,中位年龄46岁;病灶最大径5~42 mm,中位最大径9.50(6.00,15.00)mm。根据病理结果将其分为恶性组及炎性组:恶性组61例,男12例、女49例,年龄23~69岁,中位年龄44岁,病灶最大径8.00(6.00,13.00)mm,其中59例为PTC、2例为PTL;炎性组17例,男2例、女15例,年龄18~57岁,中位年龄48岁,病灶最大径14.00(11.00,17.00)mm,其中12例为SAT、5例为HT。纳入标准:①经活检和/或术后病理确诊;②未接受甲状腺相关手术;③CEUS资料清晰且完整。检查前患者均签署知情同意书。
1.2 仪器与方法 采用Philips IU22超声诊断仪,L12-5线阵探头、频率3~9 MHz,L9-3探头、频率3~9 MHz;Mindray Resona7超声诊断仪,L11-3U线阵探头,频率3~9 MHz。嘱患者平卧、头后仰,充分暴露甲状腺区,扫查甲状腺,观察病灶最大径、回声(极低回声、低回声、等或高回声)、边缘、纵横比及钙化等;之后将59 mg声诺维冻干粉(Bracco公司)与5 ml生理盐水混合、振荡制成混悬液,经静脉团注2 ml悬液,并推注5 ml生理盐水冲管;选取甲状腺病灶最大切面或血供最丰富切面进行动态观察,持续2 min。
1.3 图像分析 以常规超声见病灶内的点状强回声、后方不伴声影及彗星尾征为微钙化;病灶内见最大径≥0.1 cm的点状或团状强回声、后方伴声影为粗钙化。
根据CEUS所示甲状腺病灶增强的一致性,将其分为均匀增强和不均匀增强;根据增强程度分为高增强、等增强和低增强,病灶呈不均匀增强时,依据其内大部分的增强程度进行判断;根据增强模式分为向心性增强和非向心性增强;根据造影剂到达病灶的时间,分为快进型(早于周围正常腺体组织)、同进型(与周围正常腺体组织基本一致)及慢进型(造晚于周围正常腺体组织);根据造影剂廓清时间,分为快退型(早于周围正常腺体组织)和同退型或慢退型(与周围正常腺体组织基本一致或晚于周围腺体组织)。
1.4 统计学分析 采用SPSS 26.0统计分析软件。以±s表示符合正态分布的计量资料,采用独立样本t检验进行组间比较;以频数和率表示计数资料,组间行χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 常规超声 2组病灶最大径、钙化及纵横比差异均有统计学意义(P均<0.05),患者性别及病灶回声、边缘差异均无统计学意义(P均>0.05),见表1。

表1 甲状腺恶性与炎性病灶患者一般资料及超声特征
2.2 CEUS 2组造影剂到达时间、病灶增强模式及程度差异均有统计学意义(P均<0.05),而增强一致性及造影剂廓清时间差异均无统计学意义(P均>0.05),见图1、2和表2。

表2 甲状腺恶性与炎性病灶的CEUS特点
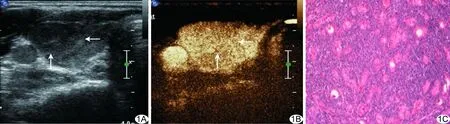
图1 炎性组患者,女,39岁,HT A.超声声像图示甲状腺右叶14 mm×11 mm×9 mm低回声灶,边缘模糊; B.CEUS示病灶呈同进型弥漫性均匀等增强; C.病理图,光镜下见滤泡上皮细胞核呈空泡状,胞浆丰富,粉染,周边淋巴组织增生,部分区域可见淋巴滤泡(HE,×400) (箭示病灶)
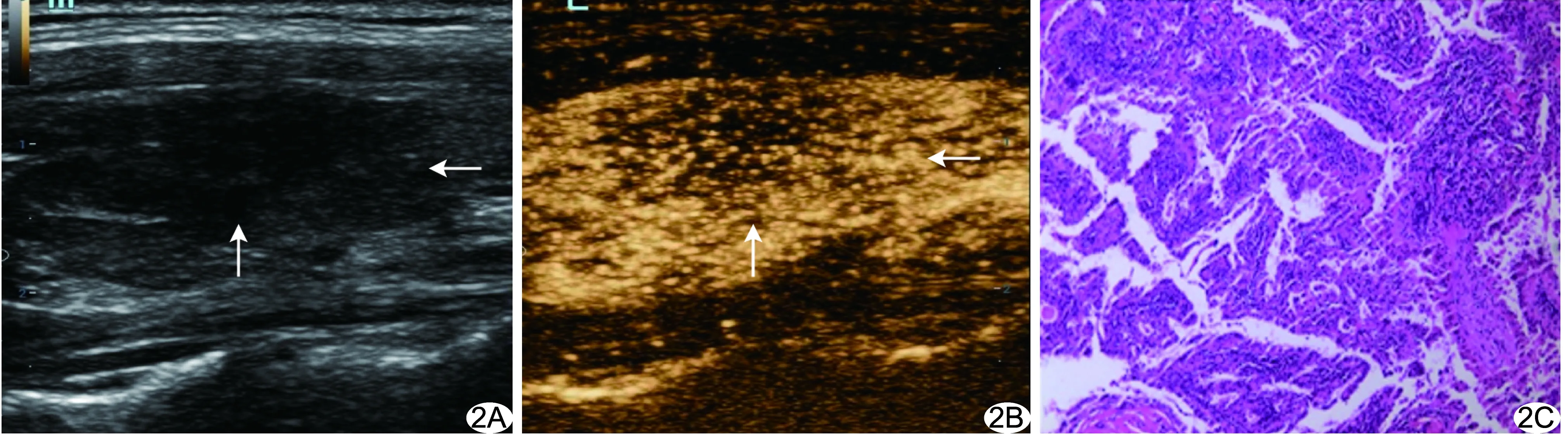
图2 恶性组患者,女,37岁,PTC A.超声声像图示甲状腺右叶16 mm×11 mm×10 mm低回声灶,边缘模糊; B.CEUS示病灶呈慢进型向心性不均匀低增强; C.病理图,光镜下见上皮乳头状增生,细胞核呈磨玻璃状(HE,×400) (箭示病灶)
2.3 回归分析 将病灶最大径<10 mm、微钙化、纵横比>1、慢进型增强、向心性增强及低增强纳入回归分析,结果显示病灶最大径<10 mm(OR=130.319,P<0.001)、慢进型增强(OR=6.177,P=0.013)、微钙化(OR=10.886,P=0.001)及向心性增强(OR=12.922,P<0.001)为甲状腺恶性病灶的预测因子,其曲线下面积(area under the curve, AUC)分别为0.828[95%CI(0.740,0.916)]、0.703[95%CI(0.575,0.832)]、0.638[95%CI(0.501,0.775)]及0.630[95%CI(0.491,0.768)]。见图3。

图3 甲状腺病灶最大径<10 mm、慢进型增强、伴微钙化及向心性增强预测其为恶性的ROC曲线
3 讨论
SAT又称为肉芽肿性甲状腺炎,为病毒感染破坏甲状腺滤泡细胞、形成小脓肿,并释放胶体物质,导致炎症细胞(尤其是巨噬细胞)浸润而形成的甲状腺炎症性疾病[4]。HT又称慢性淋巴细胞性甲状腺炎,是免疫功能异常致甲状腺滤泡细胞破坏、并发生淋巴细胞和浆细胞浸润的自身免疫性甲状腺炎[5]。PTC是最常见的甲状腺原发性恶性肿瘤,其中约65%~99%为甲状腺微小乳头状癌[6]。
SAT超声表现与疾病进展有关,急性期和中期常表现为甲状腺内部边缘模糊的低回声,恢复期则可见甲状腺实质内部高回声光点[7]。HT超声多见甲状腺腺体回声不均,伴条索样高回声,局限型HT亦可表现为边缘模糊的低回声区[8],难以与恶性病灶相鉴别。本研究炎性组二维超声多可见甲状腺低回声灶、边缘模糊。此外,甲状腺病灶伴微钙化是恶性预测因子,SAT恢复期可能出现类似表现,与恶性病灶难以鉴别。
既往CDFI研究[9]发现SAT病灶周边血流较丰富,而内部多无明显血流信号,可能原因在于炎症导致细胞水肿,而CDFI敏感性较低,无法明确显示病灶内部血供情况。声诺维微泡平均直径仅为2.5 μm[10],以之行CEUS成像有助于观察微血管,可弥补CDFI的不足。PTC的主要CEUS表现包括慢进型增强、低增强、不均匀增强、向心性增强及快退型增强[10-12];而PTL 则以向心性增强、不均匀增强及低增强为其特点[13]。甲状腺恶性肿瘤CEUS表现与其新生血管特点有关。在甲状腺癌早期,血管呈低功能和不完全开放状态,病灶表现为低增强[14];随着疾病进展,肿瘤外周区域新生血管相对密集而中心区域相对缺乏,内部出现不同程度的液化、坏死及硬化,导致造影剂进入病灶而呈向心性增强,内部则呈不均匀增强;最后,由于血管形态及排列紊乱,周边血管纤细、弹性较差,导致血管阻力增加,造影剂进入阻力增高,病灶呈慢进型增强[6,15]。甲状腺炎性病灶的血管粗大,微泡进入阻力较小,故其CEUS多表现为等增强、同进型增强及非向心性增强。此外,本研究结果发现甲状腺恶性与炎性病灶的造影剂到达时间、病灶增强模式及程度差异均有统计学意义;多因素分析结果提示慢进型增强及向心性增强是甲状腺恶性病灶的预测因子,其AUC分别为0.703及0.630。
综上所述,常规超声联合CEUS有助于鉴别诊断甲状腺恶性与炎性病灶,病灶伴微钙化、慢进型增强及向心性增强为恶性病灶的预测因子。本研究多因素回归分析显示,病灶最大径<10 mm也是恶性病灶的预测因子,可能与本研究中样本存在选择偏倚有关,对于个体病例来说,不能将最大径作为判断病灶良恶性的参考指标。此外,本研究样本量小,所获结论有待累积更多病例后进一步深入观察。
