补肾法对肺癌骨转移微环境影响的机制研究*
2021-12-24付淑娟张士强吴婷婷李芸钟薏蒋海燕周张杰曹晟成潘平生庄红文
付淑娟,张士强,吴婷婷,李芸,钟薏,蒋海燕,周张杰,曹晟成,潘平生,庄红文
1 上海中医药大学附属上海市中西医结合医院 上海 200082 2 上海中医药大学 上海 200032 3 上海市松江区方塔中医医院 上海 201699
据国家癌症中心发布的最新全国癌症统计数据显示,肺癌在我国前五位恶性肿瘤中的发病率和死亡率中都占据第一位,仍是威胁人民健康的首个恶性疾病[1]。骨转移在肺癌远处脏器转移中最常见,晚期肺癌患者中约30%~40%会出现骨转移[2]。骨转移临床多表现为疼痛、病理性骨折等骨相关事件,严重威胁患者的生活质量及缩短患者生存期,而目前抗骨转移治疗仅能延缓骨转移的进展,是临床治疗难点之一。
近年来,针对骨转移骨微环境的变化及分子机制的研究有了更深入精准的认识。骨微环境中细胞丰富,最具代表的细胞有成骨细胞、破骨细胞、骨髓基质细胞、免疫细胞、血管内皮细胞等。骨微环境中的各种细胞相互作用,相互调控加速骨转移的发生发展。肺癌骨转移以溶骨性转移为主,其中成骨细胞与破骨细胞是肿瘤骨转移过程中引起溶骨性转移的关键因素[3-4]。肺癌细胞分泌的促破骨细胞生成因子刺激成骨细胞前体分化为成熟的成骨细胞,成骨细胞分泌的细胞核因子κB配基受体激活剂(receptor activator of nuclear factor-κB ligand,RANKL)通 过RANKL信号通路激活破骨细胞,活化的破骨细胞一方面提高骨的重吸收介导转移灶的骨质破坏,另一方面释放骨基质存储的生长因子等刺激肺癌细胞的再增殖[5]。由成骨细胞合成的骨保护素(osteoprotegerin,OPG)会和RANKL产生竞争性结合RANK,从而起到抑制破骨细胞分化、成熟的作用[6],RANK/RANKL/OPG信号系统中RANKL与OPG分泌的量直接影响着破骨进程。
通过对骨微环境、肺癌骨转移的机制进行分析研究,恢复骨微环境平衡,抑制肿瘤破骨进程,对骨转移的治疗具有指导意义。本文通过观察益肾固骨方对小鼠肺癌骨转移模型及OPG和RANKL表达的影响,探究该方对骨微环境的影响,揭示该方治疗肺癌骨转移的主要作用机制,为临床的应用提供实验依据。
材料与方法
1 材料
1.1 药物 益肾固骨方组成为熟地、山萸肉、骨碎补等。颗粒剂购自华润三九医药股份有限公司,用蒸馏水配制成含生药浓度为1.17g/mL的冲剂;顺铂(20mg/支)购自齐鲁制药有限公司,用生理盐水配成10%浓度。
1.2 细胞株 Lewis小鼠肺癌细胞株购自中国科学院上海生命科学研究院细胞库,用含10%胎牛血清培养基培养并置于37℃、5%CO2的培养箱中。
1.3 动物 30只6周龄C57BL /6 雄性小鼠,体重(20±2)g,SPF 级,购自上海斯莱克实验动物有 限 责 任 公 司(SCXK(沪)2017-0005),饲 养 于上海中医药大学动物实验中心动物房(合格证号:20170005006029)。
1.4 试剂 胎牛血清、DMEM培养基、胰酶、PBS缓冲液,购自于美国GIBCO公司,TRAP染色试剂盒购自于美国Invitrogen公司,PCR引物由上海英潍捷基贸易有限公司合成,氯仿购自于国药集团化学试剂有限公司,OPG一抗(YBio),RANKL一抗(Abcam),GAPDH一抗(CST),HRP标记山羊抗兔IgG(明睿生物),Trizol试剂盒购自于invitrogen,RT试剂(TAKARA Sybr green)购自于TAKARA公司,氯仿购自于国药集团化学试剂有限公司等。
1.5 仪器 显微镜(CX41),日本奥林巴斯株式会社;荧光倒置显微镜 (DMI3000B),德国Leica公司;酶标仪(BioTek);低温冰箱(SANYOCO);电泳仪(DYY-6D),北京六一生物;全自动化学发光/荧光图像分析系统(上海天能科技);通用型离心机Z366K(HERMLE);高速冷冻离心机(centrifuge 5417R),德国EPPENDORF公司;低温冰箱(MDF-292),SANYO 公司;高压蒸气消毒器(YXQ.SGH.280),上海医用核子仪器厂等。
2 方法
2.1 分组 30只C57BL /6 雄性小鼠随机分为5组,每组6只。空白对照组在左后肢股骨处注射等剂量PBS作假手术。其余4组(模型对照组、益肾固骨方组、顺铂组、联合用药组)均以Lewis肺癌细胞建立肺癌股骨局部骨转移模型[7]:麻醉小鼠,左后肢股骨部位脱毛,剪开皮肤,暴露股骨端。从股骨下端用1ml注射器沿着股骨长轴方向旋转进针,分别接种20uL/只 Lewis细胞悬液(含细胞1×106个)。注射完,稍留针后缓慢拔出,消毒缝合伤口。
2.2 给药 造模后第2天起给予药物干预,共21d。益肾固骨方组按每天3g/kg中药颗粒剂剂量0.1mL/10g灌胃处理,顺铂组按隔日2mg/kg[8]腹腔注射顺铂剂量0.1mL/20g处理,联合用药组按每天3g/kg中药颗粒剂剂量0.1mL/10g灌胃+2mg/kg腹腔注射顺铂剂量0.1mL/20g处理。其中模型对照组仅予等剂量及方法生理盐水灌胃、腹腔注射处理。
3 检测指标与方法
第22天,麻醉处死小鼠后分离左下肢股骨,每组随机取3块股骨组织放入液氮中保存备用,另外3块股骨组织放入4%多聚甲醛固定48h,PBS冲洗,放入脱钙液中进行3周的持续震荡脱钙,最后进行常规脱水、包埋。
3.1 TRAP染色法 将股骨组织切片烘干后,根据TRAP染色试剂盒说明指示进行,光镜下(200倍)观察破骨细胞形态和数量。阳性破骨细胞胞浆呈酒红色,核呈阴性。
3.2 RT-PCR法 采用荧光实时定量PCR法检测股骨OPG和RANKL mRNA。Trizol法提取定量骨组织总RNA,根据反转录试剂盒的说明进行逆转录。引物由上海英潍捷基贸易有限公司合成,引物序列见表1。荧光定量PCR仪设定如下条件进行扩增:95℃ 5s,60℃ 34s,40个循环。以GAPDH作为内参,对各组样品进行校正后采用2-ΔΔCt法 (RQ值)计算各基因相对表达量。
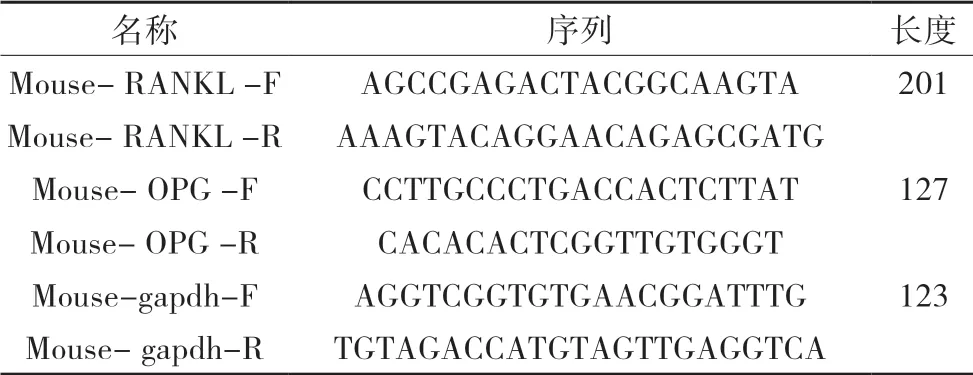
表1 各基因引物序列
4 免疫组织化学法
检测股骨组织中OPG、RANKL蛋白表达,按照免疫组织化学染色SP方法,先将切片脱蜡水化;然后PBS清洗5min后进行抗原修复;用3%H2O2滴加到切片上,封闭5~10min去除内源性过氧化物酶。PBS洗5min×3,3%过 氧 化 氧 孵 育10min,PBS洗5min×3,一抗作用37℃2h,PBS洗5min×3,二抗作用37℃Ih,PBS洗5min×3,显色,复染,脱水透明,封片。在200倍显微镜视野下,统计棕色阳性物质的光密度值。
5 统计学方法
实验数据采用SPSS 24.0统计软件进行统计学处理。计量资料用±s表示,则采用单因素方差分析进行统计。P<0.05为差异有统计学意义。
结果
1 小鼠股骨组织TRAP病理
通过股骨病理切片观察到各组骨组织的形态变化。空白对照组的骨组织病理切片显示,骨结构完整,骨皮质连续,骨小梁排列规则,骨质内细胞完整。模型对照组的骨质破坏严重,骨质内可见2~3个被染成酒红色的破骨细胞,排列紊乱,细胞核增大,异型性明显。益肾固骨方组、顺铂组和联合用药组骨髓腔内可见少量破骨细胞,联合用药组骨破坏明显减轻。见图1。
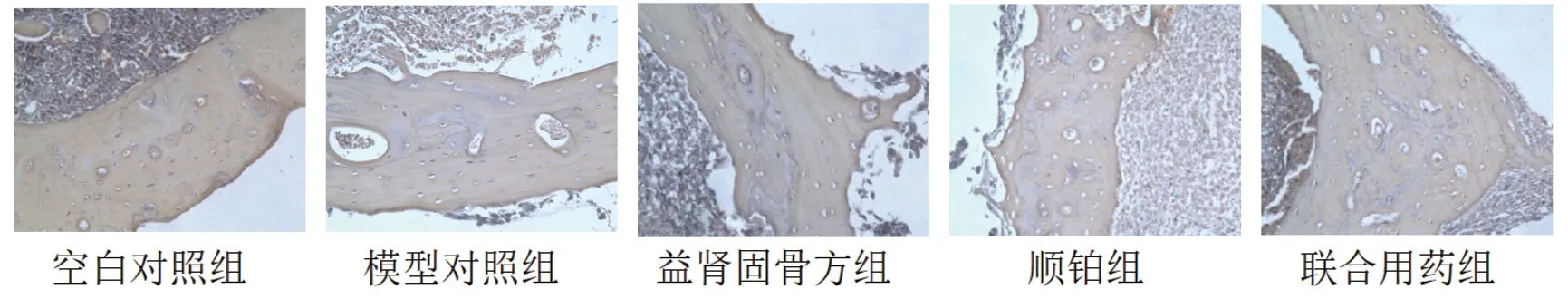
图1 各组小鼠股骨病理TRAP染色(×200)
2 小鼠股骨组织中RT-PCR法检测结果
小鼠股骨组织进行RT-PCR法检检测结果显示,与模型对照组比较,益肾固骨方组及联合治疗组OPG mRNA表达有所增加,但无明显统计学意义(P>0.05)。与模型对照组比较,顺铂组及联合治疗组RANKL mRNA表达呈下降趋势,但无明显统计学意义(P>0.05)。与空白对照组比较,各造模组OPG、RANKL mRNA表达均明显降低(P<0.05),而OPG/RANGKL比值无明显变化(P>0.05)。(表2,图2)

图2 各组小鼠股骨RT-PCR法检测结果
表2 各组小鼠股骨OPG和RANKL mRNA表达比较(±s)
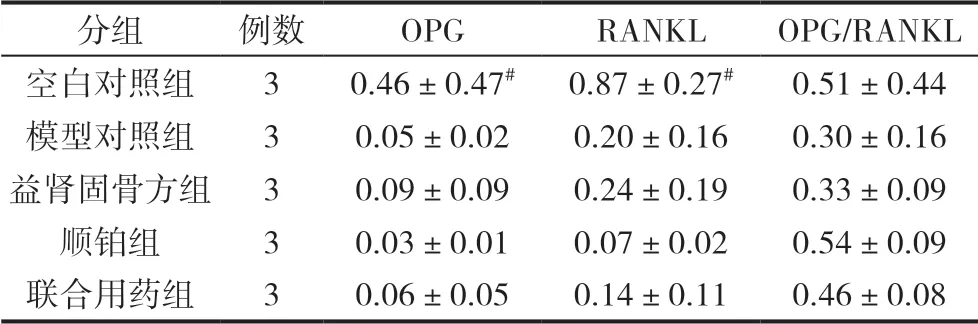
表2 各组小鼠股骨OPG和RANKL mRNA表达比较(±s)
注:经LSD分析,与空白对照组比较,#P<0.05
分组 例数 OPG RANKL OPG/RANKL空白对照组 30.46±0.47# 0.87±0.27# 0.51±0.44模型对照组 30.05±0.020.20±0.160.30±0.16益肾固骨方组 30.09±0.090.24±0.190.33±0.09顺铂组 30.03±0.010.07±0.020.54±0.09联合用药组 30.06±0.050.14±0.110.46±0.08
3 免疫组化检测小鼠股骨OPG、RANKL蛋白的表达
与空白对照组比较,模型对照组、益肾固骨方组OPG蛋白表达上调,但无明显统计学意义(P>0.05);与空白对照组比较,模型对照组、益肾固骨方组RANKL蛋白明显上调(P<0.05)。与模型对照组比较,顺铂组、联合用药组OPG蛋白表达明显下调(P<0.05),益肾固骨方组能上调OPG蛋白,但无明显意义(P>0.05);与模型对照组比较,顺铂组和联合用药组能明显下调RANKL蛋白(P<0.05)。
表3 各组小鼠股骨OPG和RANKL 蛋白表达比较 (±s)

表3 各组小鼠股骨OPG和RANKL 蛋白表达比较 (±s)
注:经LSD分析,与空白对照组比较,DP<0.01;与模型对照组比较,#P<0.05;
分组 例数 OPG RANKL OPG/RANKL空白对照组 34.38±2.510.61±0.44# 9.75±5.39模型对照组 36.30±0.7422.12±6.46D 0.30±0.07益肾固骨方组 36.55±0.7017.47±2.45D 0.38±0.07顺铂组 31.33±0.97# 0.08±0.06# 27.4±26.14#联合用药组 32.86±2.71# 0.45±0.30# 9.31±8.80
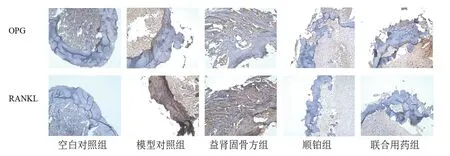
图3 各组小鼠股骨组织中蛋白表达(×200)
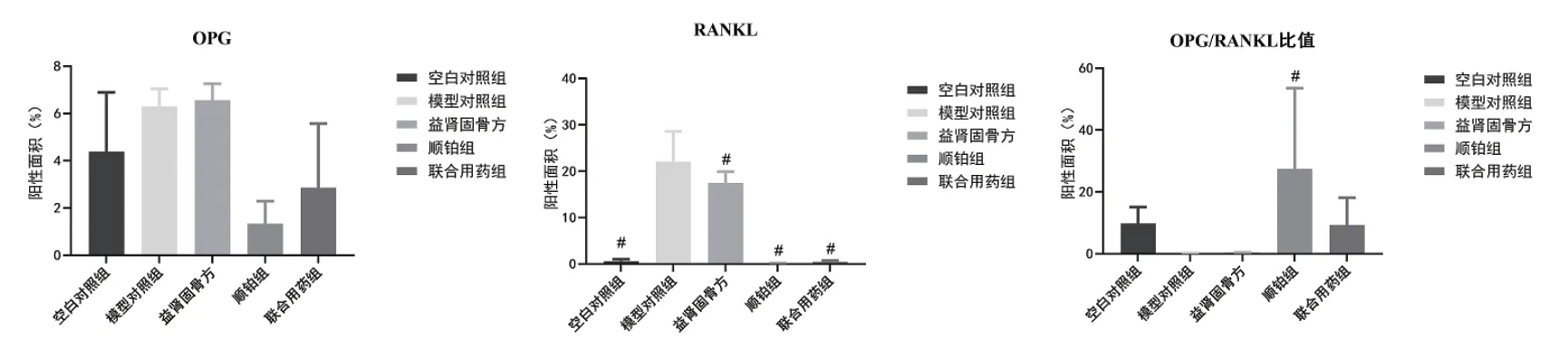
图4 各组小鼠股骨组织中OPG、RANKL蛋白阳性面积
讨论
肺癌属中医学“积聚”“肺积”范畴,《黄帝内经》云:“邪之所凑,其气必虚”,肺癌发生发展与人体正气的虚实密切相关。随着年龄增长,正气渐虚,肾气衰败,如《素问·上古天真论篇》曰:“女子七岁,肾气盛,齿更发长……丈夫八岁,肾气实,发长齿更 ……五八肾气衰,发坠齿槁”。肺癌晚期,肾精亏虚,骨失所养,癌毒滞留骨所失养之处,日渐凝聚,痰湿瘀血日积,则发为骨转移。中医学中有肾主骨生髓理论,肺癌骨转移当从益肾论治。上海市虹口区名中医钟薏教授在“扶正治癌”思想及“肾主骨”理论指导下提出“补肾法”治疗肺癌肿瘤骨转移。本次实验采用益肾固方验证,该方由熟地、山萸肉、骨碎补等组成,具有补益肾精,强骨止痛的功效,为“补肾法”临床实践的代表方,临床疗效良好。
对于其他转移而言,骨转移特点在于在于转移灶是代谢活跃的骨组织。肿瘤骨转移过程,除肿瘤细胞表现外,还包括骨微环境破坏与肿瘤细胞增殖通过释放各种生长因子相互促进[9],包括包括白细胞介素-6(interleukin-6,IL6)、转化生长因子-β(transforming growth factor-β,TGF-β)、甲状旁腺激素相关蛋白(parathyroid hormone-related protein,PTHrP)等。各种生长因子作用于成骨细胞,诱导OPG-RANKLRANK信号轴,进而影响破骨细胞,促进肿瘤细胞破骨进程,打破骨微环境平衡,诱导骨转移。RANKL作为成骨细胞表达分泌的重要因子,存在于成骨细胞表面或者由成骨细胞分泌入骨微环境,主要起调节骨改建过程的作用[10]。OPG 通过与RANKL竞争性结合阻断与RANK的结合,从而抑制骨吸收,维持骨代谢平衡,OPG/RANKL比值可作为衡量骨量及骨健康的重要指标[11]。RANK/RANKL/OPG信号的高表达与人类非小细胞肺癌骨转移并形成溶骨性骨破坏的潜能有关[12]。文献报道[13],肺癌患者骨转移后溶骨性癌组织中检测到RANKL、OPG表达上调,同时发现RANKL与OPG呈高比值;实验将重组人 RANKL和RANKL cDNA基因转染后,观察到OPG增加减弱,癌细胞向体内外转移潜能和迁移能力明显增强,文中揭示肿瘤细胞可能通过直接产生 RANKL或 OPG,或通过间接刺激成骨细胞/细胞基质分泌 RANKL或OPG的其他因子实现改变破骨细胞的活化能力。
本研究结果显示,各治疗组TRAP阳性的破骨细胞数量较模型对照组减少。与模型对照组比较,益肾固骨方与顺铂联用时,能够明显下调RANKL蛋白表达(P<0.05);益肾固骨方组在一定程度能够上调OPG蛋白及基因表达,但无统计学意义(P>0.05)。因此推测,补肾法中药对肺癌骨转移模型具治疗作用,其机制可能通过调节骨微环境,抑制RANKL的表达、增加OPG 表达从而抑制肺癌骨转移的发展。本实验仅针对骨微环境中成骨细胞与破骨细胞的OPG、RANKL表达开展研究,希望初步揭示补肾中药通过改善肿瘤生存微环境,达到抑制肿瘤进展的目的。肺癌骨转移后,癌细胞和骨组织微环境间进行复杂的相互作用,有多种相关信号通路参与其中,课题组未来也将进一步深入研究的,探索肺癌骨转移后骨破坏过程的完整机制。
