上流式厌氧污泥床(UASB)启动运行性能及其不同高度微生物群落的研究
2021-12-24杨雅茹李帅东姜冬梅
杨雅茹,李帅东,白 林,姜冬梅
(1.宜宾学院,四川 宜宾 644000;2.宜宾职业技术学院,四川 宜宾 644000;3.四川农业大学,四川 雅安 625000)
本研究利用上流式厌氧污泥床(UASB)处理来自猪场的高浓度有机废水,探究其启动运行性能和微生物在UASB 反应器不同高度的分布情况,以期为UASB的性能优化提供参考。
1 材料与方法
1.1 UASB 反应器装置 UASB 反应器由直径为0.2 m的圆柱体有机玻璃构成,上部为三相分离器和出水口,底部进水,反应器总高度为1.4 m,从三相分离器下端到反应器底部从上到下均匀分布四个取样口A、B、C、D,两个取样口之间相隔0.25 m,有效体积36 L。
1.2 启动运行控制 本试验水质为猪场废水,取自四川农业大学养猪场,化学需氧量(COD)达到8 000~10 000 mg∕L,pH 值为6.8~7.8;接种污泥为四川农业大学污水处理厂ABR 反应器排出的厌氧污泥,污泥量占反应器总体积的21%。
UASB 启动方案:在常温下(20~30 ℃)采用连续进水的方式,初始进水流量设置为18 L∕d,流量设置及对应的水力停留时间(HRT)如表1 所示。在第一个水力停留时间,进水浓度不断升高,直至升到6 000 mg∕L。出水浓度和去除率达到稳定后,提高进水流量为28.8 L∕d,进入HRT2阶段,出水浓度COD再次稳定后,继续减少HRT,使之达到设计水流量72 L∕d。每日定时监测出水pH值,保证其在7.2~7.8之间。
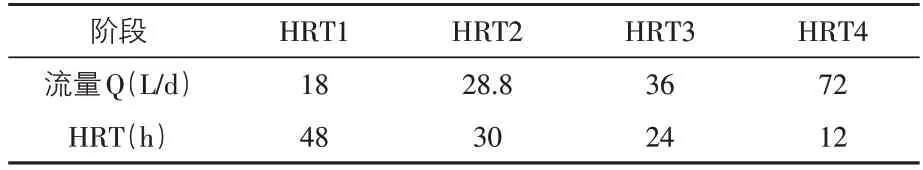
表1 不同进水流量对应的水力停留时间(HRT)
1.3 不同高度污水、污泥样品的采集 在每个HRT 对反应器从上到下O、A、B、C、D、I 六个取样口的污水(含污泥)取样,样品置于高温灭菌的聚乙烯瓶中,冰上保存并及时运送至实验室。
1.4 测定项目及方法
1.4.1 废水水质指标 检测方法主要依据中华人民共和国国家标准测定法及《水和废水监测分析方法》。本研究主要检测的水质指标及方法见表2。

表2 水质监测指标及方法
1.4.2 16S rDNA 测序 利用提取污泥和废水的DNA 试剂盒对样品进行DNA 提取,将废水、污泥样品总DNA通过Illumina Miseq技术测序平台对16S rDNA V4区的PCR产物进行高通量测序。
1.5 微生物测序结果分析 使用QIIME1.8.0 软件过滤测序数据。通过Flash软件将有Overlap的一对Reads 进行拼接,并对其数目进行统计。根据97%相似性使用Uclust 软件对序列聚类成为OTUs(Operational Taxonomic Units),代表是一组来源于某一个相同分类单元的序列。从同一OTUs 中取一条代表性序列,使用RDP Classifier进行下游的物种注释分析。
2 结果与讨论
2.1 UASB 启动及运行 反应器共运行了96 d,整个试验过程COD去除情况见图1。在水力停留时间为48 h(HRT1)阶段,随着进水COD 浓度升高,出水口的COD 浓度缓缓降低,最低COD 浓度为336 mg∕L,COD 去除率最高能达到89.58%,此时的容积负荷从0.16 kgCOD∕m3·d 升高到1.4 kgCOD∕m3·d,这样以高频小幅的方式提升,可缩短调试期。
在水力停留时间为30 h、24 h和12 h(HRT 2、HRT3和HRT4)阶段,进水浓度维持在6 000 mg∕L左右时,每个HRT 的出水COD 呈现先升高后降低的趋势,最终趋于稳定。经过4 个HRT 的运行,COD去除率最终能达到80%以上。
沼气产率如图1 所示。在整个启动阶段,沼气产率一共有四个波峰,分别对应四个运行阶段。在第一个阶段,随着反应器运行,沼气产率不断升高,最高升到了0.886 4 L∕L·d,但是当HRT降低为30 h时,最高产率只有0.418 4 L∕L·d;后两个HRT 阶段的沼气最高产率又恢复到0.9 L∕L·d左右,分别为0.890 1 L∕L·d、0.899 8 L∕L·d。说明在第二阶段的时候,反应器正在适应高浓度的COD,因此可以推测当反应器从固定HRT、升高浓度进水变为保持固定高浓度进水、降低HRT这个转变过程会影响沼气产率。

图1 UASB反应器启动期间进水COD、出水COD和产气率
启动中后期,容积负荷变化范围为2.62~10.95 kgCOD∕m3·d。本次试验中,用UASB处理常温下的猪场废水,最高容积负荷和产气率都较高,表明反应器不同的设计参数和运行情况会影响产气率。
2.2 UASB 启动阶段反应器不同高度微生物群落的变化分析
2.2.1 微生物群落丰富度和多样性分析 根据97%相似性聚类成的OTU数目和Alpha多样性分析结果来看(见图2),发现在UASB启动期间的每个HRT 阶段,微生物群落的丰富度指数(Chao1)和多样性指数(Shannon)会沿着反应器高度呈现不同的差异性[1]。HRT1阶段,微生物群落丰富度表现为中下部>顶部>中上部>底部(C1>A1>B1>D1);微生物多样性则表现为中上部>顶部>中下部>底部(B1>A1>C1>D1)。当缩短水力停留时间为30 h(HRT2阶段)时,微生物群落丰富度沿着UASB 反应器高度增加而下降;微生物多样性表现为底部最高,中下部最低。HRT3 阶段,微生物群落丰富度变化趋势为顶部>中下部>中上部>底部(A3>C3>B3>D3);微生物多样性沿着反应器高度增加而升高。HRT4 阶段,微生物群落的丰富度指数表现为中下部>中上部>顶部>底部(C4>B4>A4>D4);多样性指数和HRT3阶段的变化趋势一致。

图2 OTU、Chao1和Shannon统计图
2.2.2 物种注释分析 采用RDP Classfier 对每一条OUTs的一条代表性序列进行下游物种注释分析,共得到60 个门、133 个纲、233 个目、253 个科、590 个属水平的细菌和一些无法归类的细菌。利用UASB 反应器处理猪场废水时,不同启动阶段优势菌群在门水平上是相似的,分别为属于古菌的广古菌门(Euryarchaeota)和属于细菌的拟杆菌(Bacteroidetes)、变形菌门(Proteobacteria)、厚壁菌门(Fimicutes)、绿弯菌门(Chloroflexi)、阴沟单胞菌门(WWE1),属水平上为甲烷丝菌属(Methanosaeta)、拟杆菌目(Bacteroidales)和互养菌属(Syntrophus),但占细菌总数的百分比不同。在细菌16S rRNA测序中发现了古菌,这是由于细菌和古菌在此基因序列上有较高的同源性[2]。
本试验中广古菌门(Euryarchaeota)启动初期就是优势菌,与徐锐[3]的研究不一致,可能是因为接种污泥自身就带有Euryarchaeota。Euryarchaeota的甲烷丝菌属(Methanosaeta)在属水平上也是反应器的优势菌,Methanosaeta是专性乙酸营养型产甲烷古菌,可利用多种代谢底物产生甲烷(如乙酸、氢气∕二氧化碳),适于生活在高负荷和中性pH 条件下[4]。在启动时期不同HRT 下,Methanosaeta的丰度沿着反应器的高度被量化,在前三个HRT 下,其最高值都位于反应器中下部,只有在启动末期沿反应器高度自下而上呈现降低趋势。乙酸型产甲烷古菌的生长与颗粒生物膜密切相关,启动末期底部最高,说明大部分颗粒污泥都集中在底层,若颗粒退化,其生物丰度也会降低[5]。
启动初期和末期,拟杆菌(Bacteroidetes)都集中在中上部和顶部,启动中期会有一段时间集中在反应器底部(如HRT2)。Bacteroidetes的拟杆菌目(Bacteroidales)在目水平上是优势菌,在UASB反应器不同高度的丰度变化趋势和Bacteroidetes一致,只有在启动中后期依然保持底部较高水平,表明Bacteroidales在降解反应器有机底物(如蛋白质和多糖)中起到了非常关键的作用,可为甲烷的产生提供更多的底物[6]。
有研究表明变形菌门(Proteobacteria)在去除有机物中起了非常重要的作用[7-8],主要参与消耗乙酸、丙酸和丁酸等有机酸,若Proteobacteria量少,有机酸产生量可能也会少。在启动初期,Proteobacteria主要在反应器顶部聚集,在中后期直至末期,反应器不同高度的Proteobacteria都没有较明显的差异,表明厌氧反应器在启动初期产生有机酸的位置可能是在反应器顶部。在启动中后期,Proteobacteria的量远远低于启动的其他时期,我们猜想有可能在启动中后期会有一段产酸的抑制时期。Proteobacteria在属水平上的互养菌属(Syntrophus)是启动期反应器的优势菌,对产甲烷能力的提升有重要作用。有研究表明,Syntrophus是具有直接种间电子传递能力的细菌之一,可以提升厌氧反应器中有机物转化成甲烷的速率[9]。在反应器启动初期和末期,Syntrophus集中在底部,沿反应器高度增加量逐渐减少,表明启动初期和末期主要是底部的Syntrophus在进行种间电子传递,从而提高产甲烷的速率。启动中期,不仅反应器不同高度Syntrophus的量没有明显差异,而且Syntrophus的总量也低于启动前期和后期,表明启动中期Syntrophus产甲烷速率可能有所降低,这也与本试验中启动中期(HRT2)产气能力下降一致。但启动中后期产甲烷能力是非常高的,表明在启动中后期对产甲烷能力起主要作用的菌不是Syntrophus,而是其他细菌或(和)古菌。
厚壁菌门(Fimicutes)是一种细胞壁较厚的细菌,其肽聚糖可以通过产生内孢子抵抗极端环境,因此对高有机负荷环境具有高耐受性[10]。猪场废水恰好属于高有机负荷的废水,因此,Fimicutes属于反应器中的第三优势菌。Fimicutes在反应器不同高度的量会随着启动阶段的不同表现出一定的差异。在启动初期和末期,反应器不同高度的Fimicutes量没有明显差异,但启动中后期在反应器顶部,Fimicutes的量增加。有研究证明Fimicutes的变化趋势与甲烷产量呈现正相关,因其极有可能会降解蛋白质、多糖或腐殖酸[6]。本试验启动中后期(HRT3),Fimicutes的量高于前面几个阶段,和产甲烷量最多一致,表明此阶段Fimicutes最重要的一个功能有可能就是产甲烷。但是微生物群体之间存在协同作用,若其中一些群体的功能失效,另外一些群体将补偿该特定功能(代偿性)[11]。因此,不排除Fimicutes有可能此时在补偿某些产甲烷菌群的功能。
绿弯菌门(Chloroflexi)具有产生水解酶的功能,主要降解的是可溶性微生物产物,如可溶性蛋白和可溶性多糖等。在UASB 反应器中,Chloroflexi基本都集中在反应器底部,只有在启动中期会有一段时间在反应器中上部,表明反应器中可溶性的微生物产物大部分位于反应器底部,颗粒污泥也是大部分位于反应器底部。阴沟单胞菌门(WWE1)是Chouari 在2005 年从城市污水处理厂发现并命名为候补门,后被重新命名为“Cloacimonetes”,其广泛存在于猪的消化道以及厌氧反应器中[12]。本研究中WWE1 在启动初期和末期,反应器底部的量高于中部和顶部,但这两段启动时期的总量都小于启动中期。而启动中期反应器不同高度的丰度有差异,启动的中前期,WWE1 主要聚集在反应器中下部,顶部较少,启动中后期,反应器不同高度的WWE1 量没有明显变化,但总量高于其余启动时期。因此,推测WWE1可能是启动中后期提升产甲烷能力的主要细菌。
3 结论
3.1 采用设计的UASB 处理猪场废水,容积负荷从0.16 kgCOD∕m3·d 升高到1.4 kgCOD∕m3·d,设计的反应器可处理6 000 mg∕L COD浓度的粪水,产气率最高能达到0.9 L∕L·d左右,COD去除率最高为89.58%。
3.2 UASB 反应器在启动时期的不同高度,优势菌种类没有变化,在门水平上为属于古菌的广古菌门和属于细菌的拟杆菌、变形菌门、厚壁菌门、绿弯菌门、阴沟单胞菌门,属水平上为甲烷丝菌属、拟杆菌目和互养菌属。但优势菌会有量的差异:广古菌门、绿弯菌门和阴沟单胞菌门主要位于反应器底部和中下部;拟杆菌、变形菌门、厚壁菌门主要位于反应器中部和上部;甲烷丝菌属和互养菌属主要位于反应器底部和中下部,拟杆菌目主要位于反应器中部和上部。
