藜麦复合物调控SIRT1/PGC-1α通路改善糖尿病小鼠肝细胞损伤
2021-12-23胡媛媛姜广建祝嘉健暴雪丽连娟段小华刘羽桐刘佳贤
胡媛媛 姜广建 祝嘉健 暴雪丽 连娟 段小华 刘羽桐 刘佳贤



〔摘要〕 目的 基于SIRT1/PGC-1α通路探討不同藜麦含量的藜麦复合物对糖尿病小鼠肝损伤的防治作用。方法 将23只雄性C57BL/6J小鼠随机分为正常对照组(ZC,n=6)、模型组(MX,n=6)、藜麦复合物1组(LM1,n=6)、藜麦复合物2组(LM2,n=5)。采用高脂饮食联合链脲佐菌素诱导建立2型糖尿病小鼠模型。给药12周后,全自动生化仪检测血清甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)、谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、空腹血糖(fasting blood glucose, FBG)、空腹胰岛素(fasting insulin, FINS)含量,并计算胰岛素抵抗指数(insulin resistance index, IRI)。免疫组化及Western blot测定肝脏组织中沉默信息调节因子1(silent information regulator 1, SIRT1)和过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α, PGC-1α)蛋白的表达水平;HE染色检测肝脏病理变化。结果 与ZC组比较,MX组ALT、AST、TC、FBG含量及IRI均升高(P<0.01或P<0.05),TG、FINS含量均有升高趋势(P>0.05)。与MX组比较,LM1组AST、TG、FBG、FINS含量及IRI明显降低(P<0.01或P<0.05);LM2组ALT、AST、FBG、FINS含量及IRI明显降低(P<0.01或P<0.05)。病理结果显示MX组小鼠肝细胞呈明显脂肪病变,局灶性坏死并伴有炎性细胞浸润;LM1和LM2组可见脂肪空泡和炎性细胞不同程度上明显减少,细胞坏死损伤减轻,肝细胞病变程度显著轻于MX组,其中LM2组改善最明显。免疫组化与Western blot结果均显示,与ZC组比较,MX组肝脏组织SIRT1及PGC-1α蛋白表达水平明显降低(P<0.01或P<0.05));与MX组比较,LM1及LM2组PGC-1α蛋白表达明显升高(P<0.01或P<0.05)。免疫组化结果显示,LM1组SIRT1的蛋白表达水平明显升高(P<0.05)。结论 藜麦复合物可能通过促进SIRT1/PGC-1α的表达来改善胰岛素抵抗和糖脂代谢紊乱,从而减轻糖尿病肝损伤,且含量更高的藜麦复合物治疗效果更为显著。
〔关键词〕 糖尿病;肝损伤;非酒精性脂肪肝;沉默信息调节因子1;过氧化物酶体增殖物激活受体γ辅激活因子1α;藜麦复合物
〔中图分类号〕R259 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.12.009
Quinoa Compound Regulates SIRT1/PGC-1α Pathway to Ameliorate Hepatocellular
Injury in Diabetic Mice
HU Yuanyuan1, JIANG Guangjian1, ZHU Jiajian1, BAO Xueli2, LIAN Juan1, DUAN Xiaohua3, LIU Yutong3, LIU Jiaxian4*
(1. College of Traditional Chinese Medicine, Beijing University of Chinese Medicine, Beijing 100029, China; 2. The Third Affiliated Hospital, Beijing University of Chinese Medicine, Beijing 100029, China; 3. Gansu Chunjie Plateau Agricultural Science and Technology Co., Ltd, Wuwei, Gansu 730000, China; 4. Beijing Zhongli Biological Technology Co., Ltd, Beijing 101200, China)
〔Abstract〕 Objective Based on the SIRT1/PGC-1α pathway to explore the preventive and therapeutic effects of quinoa compound with different quinoa content on liver injury in diabetic mice. Methods A total of 23 male C57BL/6J mice were randomly divided into four groups: normal control group (ZC, n=6), model group (MX, n=6), quinoa compound 1 group (LM1, n=6), quinoa compound 2 group (LM2, n=5). A high-fat diet combined with streptozotocin was used to establish a type 2 diabetic mice model. After 12 weeks of drug administration, the levels of triglyceride (TG), total cholesterol (TC), alanine aminotransferase (ALT), aspartate aminotransferase (AST), fasting blood glucose (FBG) and fasting insulin (FINS) were measured by automatic biochemical analyzer, and then the insulin resistance index (IRI) was calculated. The protein expression levels of silent information regulator 1 (SIRT1) and peroxisome proliferator-activated receptor γ coactivator-1α (PGC-1α) were determined by immunohistochemistry and Western blot, and the pathological changes of liver tissues were detected by HE staining. Results Compared with the ZC group, the MX group showed an increase in serum ALT, AST, TC, FBG and IRI (P<0.01 or P<0.05), TG and FINS contents showed an increasing trend (P>0.05). Compared with the MX group, the levels of AST, TG, FBG, FINS and IRI in the LM1 group were all significantly decreased (P<0.01 or P<0.05); the levels of ALT, AST, FBG, FINS and IRI in LM2 group were significantly decreased (P<0.01 or P<0.05). Pathological results showed that liver cells in MX group showed obvious fatty lesion, focal necrosis and inflammatory cell infiltration. In LM1 group and LM2 group, fat vacuoles and inflammatory cells were significantly reduced to varying degrees, cell necrosis and injury were alleviated, and the degree of hepatocellular lesion was significantly lighter than that in MX group, among which the improvement was most obvious in LM2 group. Immunohistochemical and Western blot results showed that SIRT1 and PGC-1α protein expression levels were significantly decreased in MX group compared with ZC group (P<0.01 or P<0.05); compared with MX group, the expression of PGC-1α in LM1 group and LM2 group was significantly increased (P<0.01 or P<0.05). Immunohistochemical results showed that the protein expression level of SIRT1 in LM1 group was significantly increased (P<0.05). Conclusion The quinoa compound may alleviate diabetic liver injury by ameliorating insulin resistance and glycolipid metabolism disorders by promoting the expression of SIRT1/PGC-1α, and the effect was more significant with higher quinoa content.
〔Keywords〕 diabetes; liver injury; nonalcoholic fatty liver disease; silent information regulator 1; peroxisome proliferator-activated receptor γ coactivator-1α; quinoa compound
糖尿病(diabetes mellitus, DM)已成为全球最具挑战性的公共卫生问题之一,到2045年全球DM发生预计将达到7亿[1]。越来越高的患病率和死亡率要求更有效的治疗药物,尤其是DM并发症,DM肝损伤是近年来引起重视的DM主要并发症。2型DM的主要致病基础为胰岛素抵抗造成的糖脂代谢紊乱,作为糖脂代谢重要靶器官的肝脏主要表现为非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)病变。研究证实,沉默信息调节因子1(silent information regulator 1, SIRT1)和过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α, PGC-1α)与糖脂代谢关系密切,并参与体内脂肪酸和葡萄糖的合成、代谢和输出,在DM肝损伤发病过程中起着重要作用[2-3]。除了应用常规药物治疗DM外,选择低血糖生成指数食物也是DM患者控制血糖的关键性措施之一,可有效降低DM并发症的发生率。
藜麦性温味苦,是苋科藜属一年生双子叶植物[4]。研究表明,藜麦属于低血糖生成指数食物,可有效降低碳水化合物的水解及葡萄糖的生物利用率、降低总胆固醇及低密度脂蛋白浓度,具有降低血糖、抑制肥胖、抗氧化、抗炎、抗肿瘤等重要作用[4-7]。葛根是一种常见的“药食同源”植物,为豆科植物野葛的干燥根。《中华人民共和国药典》[8]记载:“葛根味甘、辛,性凉,具有解肌退热、透疹、生津止渴等功效,主治外感发热,麻疹不透,阴虚消渴等症。”荞麦亦是一种“药食同源”作物,为蓼科荞麦属双子叶植物。《本草纲目·谷部·荞麦》记载:“荞麦……甘、平、寒、无毒……降气宽肠,磨积滞,消热肿风痛,除白浊白带,脾积泄泻。”
本研究采用高脂高糖饮食结合链尿佐菌素(streptozotocin, STZ)诱导建立2型DM小鼠模型,探讨不同藜麦含量的藜麦复合物对DM肝损伤的作用及其对肝脏组织中SIRT1及PGC-1α表达的影响。
1 材料与方法
1.1 实验动物和饲料
23只8周龄雄性C57BL/6J小鼠,体质量(22±2) g,购自北京斯贝弗生物技术有限公司,动物许可证号:SCXK(京)2016-0002。动物饲养于北京中医药大学SPF级动物房,可随意饮用自来水和食物。光/暗循环为12 h/12 h,室温控制在(23±2) ℃,相对湿度为(55±10)%。高脂饮食(MD12032)和标准饮食(MD12031)均来自江苏医药生物医学有限公司。本实验均符合北京中医药大学实验动物伦理学相关规定的要求。
1.2 實验药物
藜麦(批号:SC10162062300206)、荞麦(批号:SC10162062300206)均购于甘肃纯洁高原农业科技有限公司,葛根购于北京同仁堂药材有限公司。藜麦复合物1:藜麦50%+葛根10%+荞麦10%。藜麦复合物2:藜麦占比70%+葛根10%+荞麦10%,其余成分均需保密。藜麦复合物1和藜麦复合物2的制备在北京中医药大学DM研究中心实验室进行。用电动搅拌机将藜麦、葛根、荞麦等成分打成粉末按比例混合,制作成标准鼠粮大小的食物,4 ℃储存。
1.3 主要试剂及仪器
STZ(批号:S0130)购自美国Sigma公司;PGC-1α(批号:10004320)、SIRT1(批号:00077161)抗体均购自美国Proteintech公司;BCA蛋白定量检测试剂盒(批号:CR2101016)购于武汉塞维尔生物科技有限公司;DAB显色试剂盒(批号:2010A1201)、兔二步法检测试剂盒(批号:2004B1209)、小鼠二步法检测试剂盒(批号:2023B1124)均购于北京中杉金桥公司;苏木素染色液(批号:20190909)、伊红染色液(批号:20190318)均购自北京索莱宝生物科技有限公司;全自动生化仪(型号:BS-420,深圳迈瑞生物医疗电子股份有限公司);轮转式切片机(型号:RM 2255,德国Leica Biosystems公司);全自动多功能酶标仪(型号:FLUOstar Omega,德国BMG Labtech公司)。
1.4 动物分组与处理
适应性喂养一周后,随机选取6只小鼠作正常对照组(ZC),继续以标椎饲料饲养。在文献[9]的基础上略作修改复制动物模型:高脂饲料喂养4周后,禁食12 h,给予一次性腹腔注射链脲佐菌素(100 mg/kg)。ZC组予以同体积柠檬酸缓冲液。在第5周和第6周通过尾静脉取血测定小鼠的空腹血糖。2次空腹血糖水平均不低于11.1 mmol/L的小鼠视为造模成功的DM小鼠[10]。将DM小鼠随机划分为模型组(MX,高脂饲料,n=6),藜麦复合物1组(LM1,藜麦复合物1,n=6),藜麦复合物2组(LM2,藜麦复合物2,n=5),继续喂养12周,期间自由饮食饮水。
1.5 标本采集
实验结束,将所有小鼠禁食不禁水处理12 h,摘眼球取血,迅速分离血清,保存于-80 ℃冰箱用于生化指标检测;切取肝脏,部分固定于4%多聚甲醛溶液用于病理切片,剩余肝脏组织置于液氮中冷冻后保存在-80 ℃冰箱用于后续蛋白检测等。
1.6 观察指标
1.6.1 血清生化指标测定 采用全自动生化仪测定血清甘油三酯(triglyceride, TG)、总胆固醇(total chol⁃
esterol, TC)、谷丙转氨酶(alanine aminotransferase,
ALT)、谷草转氨酶(aspartate aminotransferase, AST)、空腹血糖(fasting blood glucose, FBG)及空腹胰岛素(fasting insulin, FINS)含量;胰岛素抵抗指数(insulin resistance index, IRI)=空腹血糖×空腹胰岛素/22.5[11]。
1.6.2 肝脏组织病理学检查 肝脏组织常规固定脱水、透明、包埋、切片,行苏木素-伊红染色,光镜下观察肝脏病理形态学改变。
1.6.3 免疫组织化学观察肝脏组织中SIRT1、PGC-1α蛋白的表达 肝脏组织切片,脱蜡,抗原修复,山羊血清封闭1 h,加入一抗[PGC-1α(1∶200)、SIRT1(1∶200)],4 ℃过夜,室温下滴加聚合物辅助剂孵育30 min,PBS洗涤之后滴加二抗,室温下孵育30 min,DAB显色,苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封片。拍照,并采用Image Pro Plus v6.0软件测定SIRT1、PGC-1α的平均积分光密度值。
1.6.4 Western blot检测肝脏组织中SIRT1、PGC-1α蛋白的表达 取50 mg冻存的肝脏组织,加入1 mL RIPA裂解液提取总蛋白,12 000 r/min离心10 min(离心半径为6.5 cm),收集上清液即为总蛋白溶液,使用BCA蛋白定量检测试剂盒测定蛋白浓度。各组取40 μg蛋白量上样,转膜至PVDF膜上。将膜封闭1 h后,加入一抗[SIRT1(1∶800)、PGC-1α(1∶5000)] 4 ℃过夜,洗膜,相应二抗(1∶5000)室温孵育1 h,显色,拍片。采用ImageJ对图像进行分析,灰度值以IntDen表示,将目的蛋白与内参灰度值的比值作为蛋白的表达量进行统计分析。
1.7 统计学方法
数据资料采用GraphPad Prism 8.0.2统计软件进行处理,计量资料用“x±s”表示,对正态分布、方差齐的数据进行单因素方差分析检验(One-Way ANOVA),对非正态分布或方差不齐的数据进行非参数(Kruskal-Wallis)检验。以P<0.05为差异有统计学意义。
2 结果
2.1 藜麦复合物对DM小鼠肝功能、糖脂代谢及胰岛素抵抗的影响
与ZC组比较,MX组ALT、AST、TC、FBG含量及IRI均升高(P<0.01或P<0.05),TG、FINS含量均有升高趋势(P>0.05)。与MX组比较,LM1组AST、TG、FBG、FINS含量及IRI均降低(P<0.01或P<0.05),ALT、TC含量均有降低趋势(P>0.05);LM2组ALT、AST、FBG、FINS含量及IRI均降低(P<0.01或P<0.05),TG、TC含量均有降低趋势(P>0.05)。見表1-2。
2.2 藜麦复合物对DM小鼠肝脏形态学改变的影响
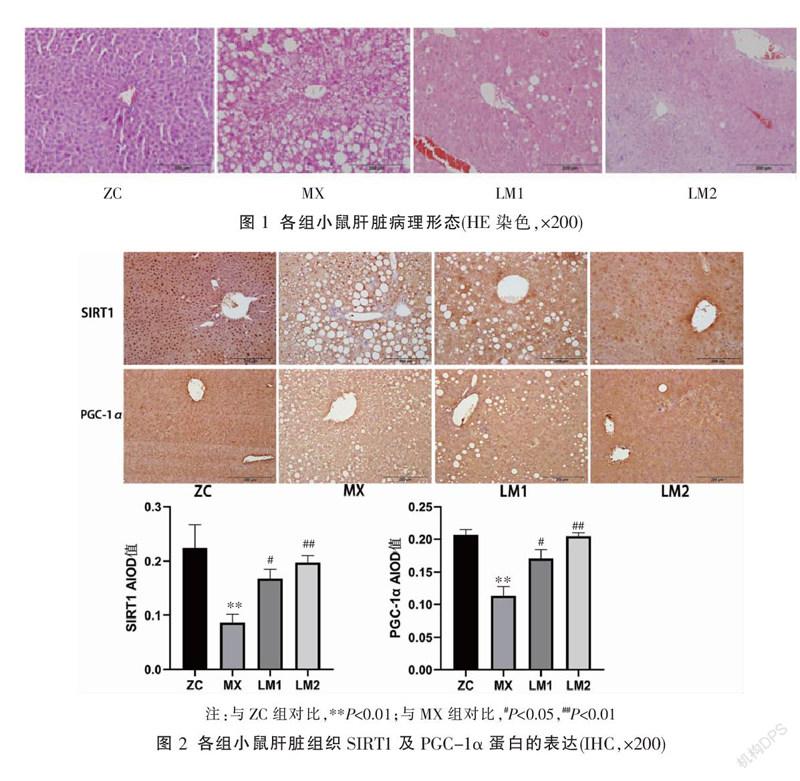
HE染色结果显示,ZC组小鼠肝小叶结构清晰,细胞呈多边形,大小形态一致;MX组小鼠肝细胞呈明显脂肪病变,可见肝细胞体积增大,部分细胞核变型和核偏位,局灶性坏死,坏死区和汇管区可见程度不一的炎性细胞浸润;LM1和LM2组可见脂肪空泡和炎性细胞不同程度上明显减少,细胞坏死损伤减轻,肝细胞病变程度显著轻于MX组,其中LM2组改善最明显。见图1。
2.3 免疫组织化学法检测DM小鼠肝脏组织中SIRT1和PGC-1α蛋白的表达
与ZC组比较,MX组肝脏组织SIRT1及PGC-1α表达水平均降低(P<0.01)。与MX组比较,LM1及LM2组SIRT1及PGC-1α表达均升高(P<0.01或P<0.05)。见图2。
2.4 Western blot检测DM小鼠肝脏组织中SIRT1和PGC-1α蛋白的表达
与ZC组比较,MX组小鼠肝脏组织的SIRT1和PGC-1α蛋白表达水平降低(P<0.01或P<0.05)。与MX组比较,LM1组PGC-1α的蛋白表达升高(P<0.05),SIRT1的蛋白表达水平有升高趋势(P>0.05);LM2组SIRT1和PGC-1α的蛋白表达水平均升高(P<0.01或P<0.05)。见图3。
3 讨论
DM属中医学“消渴病”范畴,“消渴”又称“消瘅”“消中”“肺消”。中医学多认为消渴病的病机主要在于阴津亏损(阴虚为本)、燥热偏胜(燥热为标),病位主在肺、胃、肾[12]。因此,多以滋阴法或滋阴益气法论治消渴病。葛根“主治消渴身大热者,从胃府而宣达水谷之津”,可直接生津液,而补胃阴以治消渴。《灵枢·五变》认为“五藏皆柔弱者,善病消瘅”,指出五脏功能虚弱易致“消渴”,而荞麦“续精神,炼五脏滓秽”,可增强五脏功能以防治消渴。古代中医更有“五谷为养”“精生于谷”的思想,藜麦可通过养护五脏之精,以达到防治疾病的功效。现代药理研究显示,葛根素为葛根的主要活性成分,具有抗炎、解热、降血压、降血脂、降血糖、抗癌、保肝等药理作用,临床广泛应用于高血压、DM及其并发症、心脑血管疾病、肿瘤、炎症等方面[13];荞麦营养价值丰富,含有其他禾谷类粮食缺乏的黄酮类生物活性成分,具有抗炎、降血糖、降血脂、抗肿瘤、抗癌等功能,可用于治疗高血压、DM、炎症、肿瘤等疾病[14-15];藜麦富含多不饱和脂肪酸,其中欧米伽3脂肪酸含量很高,不仅能促进脑细胞和神经的发育,还能显著降低甘油三酯和血胆固醇,增加胰岛组织β细胞活性,广泛用于抑制高血压、高血脂、DM等疾病[16]。基于此,选择以复合物的形式进行干预,起到协同增效的作用。
已知2型DM与肝损伤有着复杂的联系,其引起的肝损伤以NAFLD最为常见。NAFLD现已被公认为全球最常见的慢性肝病,是一种以肝脏脂肪沉积过多为特征的疾病状态[17]。NAFLD常见于2型DM和肥胖症患者,与胰岛素抵抗和血脂异常密切相关。已证实NAFLD的发展过程与许多代谢因素相关,但仍未知该疾病的具体发病机制[18]。研究发现藜麦[19-21]、葛根[22]能够改善胰岛素抵抗和糖脂代谢紊乱。本实验结果显示,DM会引起小鼠肝损伤,表现为血清ALT、AST水平显著升高(P<0.01)和典型肝脏组织病理学改变。同时,藜LM1和LM2可不同程度降低血清AST、FGB、FINS含量及IRI(P<0.01或P<0.05),改善胰岛素抵抗和糖脂代谢紊乱。HE染色结果显示藜麦复合物能够减轻肝细胞脂肪样变性和炎性细胞浸润,其中藜麦含量更高的LM2更能改善DM小鼠肝损伤。
SIRT1是一类腺嘌呤二核苷酸依赖性去乙酰化酶,已被证明与NAFLD的病理生理相关[2]。SIRT1参与各种细胞生理过程,例如维持脂质和葡萄糖的稳态,是代谢的关键调节因子。该酶在肝脏中高度表达,抑制SIRT1会上调糖异生和脂肪生成相关基因的表达,从而导致细胞内糖脂质代谢紊乱[23]。研究发现SIRT1蛋白的表达在胰岛素抵抗DM和NAFLD患者中均降低[24]。可通过增加SIRT1的表达,改善胰岛素抵抗进而减轻氧化应激达到治疗NAFLD的效果[25]。研究表明[26],过表达SIRT1可通过PGC-1α转导通路改善脂质代谢。PGC-1α活性受SIRT1的调节,并且二者都是维持细胞能量稳态的关键[27]。因此,SIRT1/PGC-1α可能是肝损伤的关键靶点。PGC-1α是一种核转录共激活因子,研究表明[3],在糖脂质代谢过程中PGC-1α与胰岛素抵抗、肝糖原异生和脂肪酸代谢关系密切,并且通过影响线粒体呼吸的关键酶在能量代谢中发挥重要作用,并且这些已经被公认是参与NAFLD的重要发生机制。体外实验亦证实可通过上调SIRT1/PGC-1α蛋白的表达,改善NAFLD[28]。
本研究结果提示藜麦复合物可能通过上调SIRT1和PGC-1α蛋白的表达,进而调节肝脏糖脂质代谢,改善胰岛素抵抗,从而发挥对肝脏的保护作用,改善DM肝损伤。且藜麦含量更高的藜麦复合物2对DM肝损伤的保护作用更为显著。
参考文献
[1] SAEEDI P, PETERSOHN I, SALPEA P, et al. Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045: Results from the International Diabetes Federation Diabetes Atlas, 9th edition[J]. Diabetes Research and Clinical Practice, 2019, 157: 107843.
[2] YOUSEFI Z, NOURBAKHSH M, ABDOLVAHABI Z, et al. micro
RNA-141 is associated with hepatic steatosis by downregulating the sirtuin1/AMP-activated protein kinase pathway in hepatocytes[J]. Journal of Cellular Physiology, 2020, 235(2): 880-890.
[3] 方诗蓉,傅玉才,周小辉.PGC-1α与非酒精性脂肪肝病关系的研究进展[J].国际消化病杂志,2009,29(6):390-392.
[4] 于 跃,顾音佳.藜麦的营养物质及生物活性成分研究进展[J].粮食与油脂,2019,32(5):4-6.
[5] AN T, LIU J X, YANG X Y, et al. Supplementation of quinoa regulates glycolipid metabolism and endoplasmic Reticulum stress in the high-fat diet-induced female obese mice[J]. Nutrition and Metabolism, 2021, 18(1): 95.
[6] FERNANDES J M, MADALENA D A, VICENTE A A, et al. Influence of the addition of different ingredients on the bioaccessibility of glucose released from rice during dynamic in vitro gastrointestinal digestion[J]. International Journal of Food Sciences and Nutrition, 2021, 72(1):45-56.
[7] SAMPAIO S L, FERNANDES A, PEREIRA C, et al. Nutritional value, physicochemical characterization and bioactive properties of the Brazilian quinoa BRS Piabiru[J]. Food and Function, 2020, 11(4):2969-2977.
[8] 國家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2020:347.
[9] 李 俊,代留玲,李 晔,等.miR-221对糖尿病肾病小鼠胰岛β细胞功能的保护作用及其机制[J].吉林大学学报(医学版),2016,42(5):905-909.
[10] 张译心,王 鑫,刘 博,等.2型糖尿病气阴两虚病证结合动物模型的制备及评价指标的建立[J].中国实验动物学报,2021,29(2):219-229.
[11] 张跃辉,赵 微,韩延华,等.黄连素对痰湿型多囊卵巢综合征大鼠的治疗作用及疗效机制研究[J].中华中医药学刊,2019,37(8):1807-1812.
[12] 吴勉华,王新月.中医内科学[M].3版.北京:中国中医药出版社,2012:384-385.
[13] 曹 盼,张樱山,魏学明,等.葛根素药理作用研究新进展[J].中成药,2021,43(8):2130-2134.
[14] 章洁琼,邹 军,卢 扬,等.不同荞麦品种主要功能成分分析及评价[J].种子,2020,39(2):107-112,117.
[15] 何伟俊,曾 荣,白永亮,等.苦荞麦的营养价值及开发利用研究进展[J].农产品加工,2019(23):69-75.
[16] TANG Y, LI X H, CHEN P X, et al. Characterisation of fatty acid, carotenoid, tocopherol/tocotrienol compositions and antioxidant activities in seeds of three Chenopodium quinoa Willd. genotypes[J]. Food Chemistry, 2015, 174: 502-508.
[17] DANFORD C J, LAI M. NAFLD: A multisystem disease that requires a multidisciplinary approach[J]. Frontline Gastroenterology, 2019, 10(4): 328-329.
[18] AHMAD A, ALI T, KIM M W, et al. Adiponectin homolog novel osmotin protects obesity/diabetes-induced NAFLD by upregulating AdipoRs/PPARα signaling in ob/ob and db/db transgenic mouse models[J]. Metabolism Clinical and Experimental, 2019, 90: 31-43.
[19] SELMA-GRACIA R, HAROS C M, LAPARRA LLOPIS J M. Inclusion of Salvia hispanica L. and Chenopodium quinoa into bread formulations improves metabolic imbalances derived from a high-fat intake in hyperglycaemic mice[J]. Food and Function, 2020, 11(9):7994-8002.
[20] 李兆钊,吴卫国,廖卢艳,等.杂粮中辅助调节血糖功效成分研究进展[J].中国粮油学报,2020,35(7):195-202.
[21] CAO Y N, ZOU L, LI W, et al. Dietary quinoa (Chenopodium quinoa Willd.) polysaccharides ameliorate high-fat diet-induced
hyperlipidemia and modulate gut microbiota[J]. International Journal of Biological Macromolecules, 2020, 163: 55-65.
[22] YANG L H, CHEN J, LU H Y, et al. Pueraria lobata for diabetes
mellitus: Past, present and future[J]. The American Journal of Chinese Medicine, 2019, 47(7): 1419-1444.
[23] TOBITA T, GUZMAN-LEPE J, TAKEISHI K, et al. SIRT1
disruption in human fetal hepatocytes leads to increased accumulation of glucose and lipids[J]. PLoS One, 2016, 11(2): e0149344.
[24] ARAB SADEGHABADI Z, NOURBAKHSH M, PASALAR P, et al. Reduced gene expression of sirtuins and active AMPK levels in children and adolescents with obesity and insulin resistance[J]. Obesity Research and Clinical Practice, 2018, 12(2): 167-173.
[25] 李 楠,徐 静,成淑英,等.吡格列酮对2型糖尿病合并非酒精性脂肪肝大鼠肝组织SIRT1、UCP2表达的影响[J].山西医科大学学报,2018,49(12):1432-1437.
[26] PURUSHOTHAM A, SCHUG T T, XU Q, et al. Hepatocyte-specific deletion of SIRT1 alters fatty acid metabolism and results in hepatic steatosis and inflammation[J]. Cell Metabolism, 2009, 9(4): 327-338.
[27] 王明珠,符德玉.基于SIRT1/PGC-1α/线粒体轴探讨高血压靶器官损害机制的研究进展[J].中華中医药学刊,2020,38(4):139-144.
[28] 冯盼盼.体外实验证实利拉鲁肽通过上调Sirt1/PGC1α改善非酒精性脂肪肝[D].重庆:重庆医科大学,2019:1-45.
〔收稿日期〕2021-09-17
〔基金项目〕国家自然科学基金项目(81774171);北京中医药大学横向课题(2180071720024)。
〔作者简介〕胡媛媛,女,在读硕士研究生,研究方向:中西医结合防治糖尿病。
〔通信作者〕*刘佳贤,男,硕士,助理研究员,E-mail:Jiaxian-Liujxliu89@gmail.com。
