经典途径细胞焦亡模型的构建
2021-12-23傅心雨石玉华郑梦洁师福山
傅心雨,石玉华,郑梦洁,吕 倩,师福山
(浙江大学 动物科学学院,浙江 杭州 310058)
细胞焦亡(pyroptosis)是一种依赖Caspase(含半胱氨酸蛋白水解酶)的具有促炎性的程序性细胞死亡,其特征是细胞膜失去完整性并形成孔洞,导致细胞肿胀破裂,该过程在抵抗微生物感染中起到重要作用[1]。细胞焦亡的发生可分为经典途径和非经典途径,分别依赖Caspase-1和Caspase-4/5/11[2]。当细胞中的模式识别受体(PRR)接受病原刺激信号后,炎症小体组装并导致自身激活以及Caspase-1的活化,活化的Caspase-1一方面切割Pro-IL-1β产生成熟的IL-1β,另一方面切割GSDMD产生N端GSDMD(GSDMD-p30)并在细胞膜上形成孔洞,导致细胞肿胀破裂,为经典途径的细胞焦亡[3-5]。非经典途径为小鼠Caspase-11或人Caspase-4/5的前体直接识别并结合脂多糖(LPS)从而导致Caspase-4/5/11活化并直接切割GSDMD,导致细胞焦亡[6-7]。因此,细胞焦亡被认为是GSDMD介导的程序性细胞死亡,其中GSDMD属于Gasdermin家族,在哺乳动物中高度保守,并在不同组织和细胞中广泛表达[2,8]。其N端结构域与C端结构域形成自抑制结构,导致静息状态下的GSDMD没有活性,仅当活化的Caspase-1或Caspase-4/5/11作用于天冬氨酸切割位点时,GSDMD才能被切割并且在胞膜上打孔[9-10]。GSDMD也与诸多基因性疾病相关,但其激活机制尚不清楚,本研究旨在构建经典途径的细胞焦亡体外模型,为进一步研究激活机制建立稳定的模型。
1 材料与方法
1.1 质粒、菌株及细胞株真核表达质粒p3×FLAG-CMV-7.1、pCMV-N-MYC、pcDNA3.1-MYC-C及人胚肾细胞HEK293T细胞株均由本实验室保存;感受态细胞E.coli.DH5α购于北京全式金生物技术有限公司。
1.2 主要试剂RNA-Quick Purification Kit购于上海奕杉生物科技有限公司;PCR试剂盒、反转录试剂盒及DNA Marker购于南京诺唯赞(Vazyme)生物科技有限公司;PCR产物纯化试剂盒购于生工生物工程(上海)股份有限公司;限制性内切酶EcoRⅠ、KpnⅠ、HindⅢ、Xba1及T4DNA连接酶购于NEB公司;10%一步法凝胶制备试剂盒购于杭州弗德生物科技有限公司;Lipo8000TM转染试剂、QuickBlockTMWestern封闭液、QuickBlockTMWestern一抗稀释液购于上海碧云天生物技术有限公司;anti-FLAG、anti-MYC抗体购于Sigma公司;HRP标记的山羊抗兔IgG及山羊抗鼠IgG购于Absin公司;LDH检测试剂盒购于Promega公司;PI染色检测试剂盒购于BD Pharmingen公司。
1.3 细胞总RNA提取及cDNA合成提取人THP-1细胞总RNA后,使用PrimeScript RT reagent Kit配制体系,PCR仪内按程序(37℃ 15 min→85℃ 5 s→16℃)完成反转录,合成cDNA。
1.4 引物设计NCBI数据库中查找人源Pro-Caspase-1、H-GSDMD-FL和H-GSDMD-P30的编码序列,根据要求设计不同引物并由生工生物工程(上海)股份有限公司合成。各个基因片段引物设计序列见表1。

表1 Pro-Caspase-1、H-GSDMD-FL和H-GSDMD-p30基因片段引物设计
1.5 PCR扩增以合成的cDNA为模板,通过PCR扩增Pro-Caspase-1、H-GSDMD-FL和H-GSDMD-p30基因,得到目的片段,反应体系如表2所示。设置循环参数:95℃预变性3 min;95℃变性15 s,60℃退火30 s,72℃延伸2 min,共35个循环;72℃彻底延伸5 min。反应完毕后,通过1.2%琼脂糖凝胶电泳验证产物。

表2 PCR扩增目的基因反应体系
1.6 质粒构建PCR产物经纯化试剂盒清洁回收后,将各DNA片段和空载分别使用相应酶进行双酶切,其中Pro-Caspase-1、H-GSDMD-FL片段及p3×FLAG-CMV、pCMV-N-MYC空载分别使用EcoRⅠ和KpnⅠ酶进行酶切;H-GSDMD-p30片段及pcDNA3.1-MYC-C空载体分别使用HindⅢ和Xba1酶进行酶切。双酶切完成后回收各个片段,将DNA片段和载体用T4DNA连接酶连接(16℃,12 h)。连接产物转化至大肠杆菌Ecoli.DH5α感受态细胞内,取适量菌液均匀涂布在含有相应抗生素的固体培养基上,37℃培养过夜后挑取单菌落于液体培养基中扩繁,37℃摇菌16 h后提取质粒,通过双酶切验证片段插入载体情况。另外,将重组质粒送至生工生物工程(上海)股份有限公司测序,将测序结果正确的质粒分别命名为p3XFLAG-CMV-Caspase-1、Myc-CMV-hGSDMD-FL和pcDNA3.1-Myc-hGSDMD-p30。
1.7 HEK293T细胞转染将HEK293T细胞约0.8×105/孔接种于24孔板内,待细胞贴壁密度达70%~80%后进行转染,转染前1 h更换新鲜的含10% FBS的DMEM培养液500 μL,置于37℃、5%CO2培养。每孔转染方法如下:二无DMEM培养液中加入0.8 μL Lipo8000TM及重组质粒混合至总体积25 μL,弃掉培养皿中25 μL培养基,将25 μL 转染工作液加入相应孔内,轻晃混匀。转染24 h后,弃培养基,加入RIPA蛋白裂解液提取细胞内蛋白,通过Western blot方法验证Pro-Caspase-1、H-GSDMD-FL和H-GSDMD-p30蛋白表达。
1.8 蛋白表达验证提取得到的细胞内蛋白与5×Loading buffer混合煮沸10 min后冰浴冷却,取20 μL 样品通过10% SDS-PAGE电泳分离,经300 mA 恒流电转至PVDF膜上,用QuickBlockTMWestern封闭液在室温下摇床孵育30 min,不同蛋白分别加入相应抗体置于4℃孵育过夜。次日用TBST溶液洗3次,每次10 min。随后加入对应二抗,室温下摇床孵育1 h。孵育结束后用TBST溶液洗3次,每次10 min。在ECL光化学成像仪内进行显色,检测目的蛋白表达情况。
1.9 质粒共转染HEK293T细胞约0.8×105/孔接种于24孔板内,待细胞贴壁密度达70%~80%后进行转染;共转染时所用质粒量分别为:Pro-Caspase-1 500 ng、H-GSDMD-FL 500 ng。转染24 h 后离心取上清,通过试剂盒检测LDH的释放情况,吸除剩余培养基,500 μL PBS清洗3次后,加入PI染料避光反应15 min,随后用PBS清洗3次,在荧光显微镜下观察结果。
1.10 数据分析数据采用GraphPad Prism 8.0软件进行分析作图,试验组比较采用t检验;*表示P<0.05,**表示P<0.01。
2 结果
2.1 Pro-Caspase-1、H-GSDMD-FL和H-GSDMD-p30基因片段扩增以合成的cDNA(THP-1)为模板,PCR方法扩增Pro-Caspase-1、H-GSDMD-FL和H-GSDMD-p30基因片段,产物通过1.2%琼脂糖凝胶电泳检测,由图1可见扩增条带大小与目的条带大小一致。

M.DL2000 DNA Marker;1.Rro-Caspase-1;2.H-GSDMD-FL;3.H-GSDMD-p30图1 PCR扩增Pro-Caspase-1、H-GSDMD-FL和H-GSDMD-p30基因
2.2 重组表达质粒的构建连接产物分别转化至EcoliDH5α感受态细胞内,挑取单菌落扩增后提取质粒,分别进行双酶切验证:重组质粒p3×FLAG-CMV-Caspase-1使用NotⅠ和SalⅠ进行双酶切,酶切产物分别为4 700,1 215 bp;重组质粒Myc-CMV-hGSDMD-FL使用SalⅠ和NotⅠ双酶切,酶切产物分别为3 776,1 452 bp;重组质粒pcDNA3.1-Myc-hGSDMD-p30使用HindⅢ和ApaⅠ双酶切,酶切产物分别为5 380,825 bp。产物经1.2%琼脂糖凝胶电泳结果如图2所示,各个重组质粒经酶切后均符合预期大小,测序结果正确进一步表明重组质粒均构建成功。
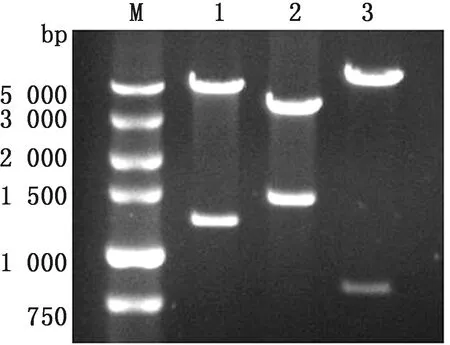
M.DL5000 DNA Marker;1.p3XFLAG-CMV-Caspase-1;2.Myc-CMV-hGSDMD-FL;3.pcDNA3.1-Myc-hGSDMD-p30图2 各重组质粒酶切验证
2.3 蛋白表达验证将构建成功的p3×FLAG-CMV-Caspase-1、Myc-CMV-hGSDMD-FL和pcDNA3.1-Myc-hGSDMD-p30质粒通过Lipo8000TM分别转染至HEK293T细胞中,24 h后提取细胞蛋白,通过Western blot方法检测各蛋白表达水平,融合蛋白p3×FLAG-CMV-Caspase-1大小为48.7 kDa、Myc-CMV-hGSDMD-FL大小为54.5 kDa、pcDNA3.1-Myc-hGSDMD-p30大小为32.0 kDa,(图3)。结果表明重组质粒p3×FLAG-CMV-Caspase-1和Myc-CMV-hGSDMD-FL可以在HEK293T细胞内成功表达,单独转染GSDMD-p30由于导致严重的细胞焦亡,胞浆内并不能检测到p30片段。

图3 Western blot检测各融合蛋白在HEK293T细胞中的表达
2.4 细胞焦亡模型的体外构建将Pro-Caspase-1、H-GSDMD-FL、Pro-Caspase-1+H-GSDMD-FL及H-GSDMD-p30质粒分别转染至HEK293T细胞中,24 h后离心收集上清液检测LDH含量,同时提取细胞中蛋白,通过Western blot验证蛋白表达情况,结果如图4所示。GSDMD-FL条带下方可见一条显著的切割条带,与GSDMD-p30大小相符,另外Caspase-1与GSDMD-FL共转的LDH结果也显著升高,与GSDMD-p30单独转染相似,表明Caspase-1将GSDMD切割成GSDMD-p30导致胞膜打孔,释放LDH,出现了显著的焦亡现象。此外,对细胞进行PI染色,在荧光显微镜下观察可见,共转组与GSDMD-p30单转组染色显著,如图5所示,与上述情况相一致。以上结果均表明HEK293T细胞中经典途径细胞焦亡模型的成功构建。

图4 质粒转染HEK293T细胞后上清中LDH含量及Western blot验证蛋白表达

图5 质粒转染HEK293T细胞后PI染色情况(100 nm)
3 讨论
细胞焦亡是一种促炎性的细胞程序性死亡方式,普遍存在于脊椎动物中,是先天性免疫效应机制[6,9,11]。在病原体相关分子模式(PAMP)及危险相关分子模式(DAMP)刺激下,细胞内的模式识别受体识别此类信号,通过接头蛋白ASC与Caspase-1前体结合形成多蛋白复合物,从而使得Caspase-1活化[2],为经典途径的细胞焦亡。据报道GSDMD是所有炎症性Caspase的底物,在细胞焦亡中起到关键作用[6,12]。而进一步探究GSDMD介导的细胞焦亡的激活机制,将有助于研究自身炎症性疾病的致病机制并为治疗方案提供新思路。因此,本研究通过构建经典途径细胞焦亡模型的相关质粒,并转染至HEK293T细胞中验证表达,最终成功构建经典途径的细胞焦亡模型,为进一步探究焦亡激活机制以及开发炎性疾病相关药物提供体外模型基础。
