胸膜肺炎放线杆菌 Apx Ⅳ 与多杀性巴氏杆菌 OmpH 基因的表位筛选及真核表达载体的构建
2021-12-23姚景丽武静桥范真玮张东超何敬文金天明
姚景丽,武静桥,范真玮,张东超,赵 微,陈 婷,何敬文,金天明
(天津农学院 动物科学与动物医学学院 天津市农业动物繁育与健康养殖重点实验室,天津 300384)
由胸膜肺炎放线杆菌(Actinobacilluspleuropneumoniae,APP)引起的猪传染性胸膜肺炎(porcine contagious pleuropneumonia,PCP)和多杀性巴氏杆菌(Pasteurellamultocide,Pm) 引起的猪萎缩性鼻炎(porcine infectious atrophic rhinitic,AR)以及猪肺疫(swine pneumonic pasteurellosis)是猪场常见的呼吸道传染病,常呈混合感染,因此,二联疫苗的研发具有现实必要性。
溶血外毒素(Apx)是 APP 引起宿主肺部感染最主要的毒力因子。目前,已经发现的 Apx 有 ApxⅠ/ApxⅡ/ Apx Ⅲ/ Apx Ⅳ 4种,研究发现,Apx Ⅳ 存在于 APP 所有血清型中,可使血清抗体效价较其他外毒素明显增加,功毒试验可提供完全保护[1]。猪巴氏杆菌 OmpH 作为菌体外膜蛋白的一种,可有效诱导动物产生特异抗体,从而发挥免疫保护作用。抗原表位又称抗原决定簇,是抗原分子中决定其特异性的化学基团。抗原表位与相应的淋巴细胞表面抗原受体相结合,进而激活淋巴细胞,引起免疫应答反应[2]。在免疫应答过程中,被 T 细胞受体(TCR)识别的表位称作T细胞表位,被 B 细胞受体(BCR)识别的表位称作 B 细胞表位[3]。表位疫苗是基于已知结构蛋白的核苷酸或氨基酸序列,利用计算机软件进行辅助分析,筛选抗原蛋白上 T、B 细胞所识别的优势抗原表位,经人工合成或借助基因工程技术制备含有优势抗原表位的多肽疫苗。抗原表位间插入柔性肽进行连接,所构建的新肽段,可以避免抗原表位间形成新的表位[4],有利于抗原结合。多表位疫苗技术现已成为当前疫苗研究领域的一种新型策略[5]。
本研究通过多种在线软件分析 Apx Ⅳ与 OmpH 基因序列的 B 细胞、T 细胞优势抗原表位,构建出新肽段 New,并对其进行抗原性分析。而后将 Apx Ⅳ、 OmpH 和 New 肽段构建至真核表达载体,并对所构建的载体进行分析评估。抽提所构建 3 种真核质粒按照一定比例混合,可制备传染性胸膜肺炎与多杀性巴氏杆菌二联疫苗,由于该疫苗中加入 New 表位序列,可发挥协同免疫作用。
1 材料与方法
1.1 基因的来源与序列合成OmpH 基因序列(GenBank:U52208.1)、ApxⅣA(559-1288aa)基因序列(GenBank:AF021919.1)、New表位序列由在线软件筛选构建,GV658 载体购自上海吉凯基因科技有限公司,以上序列均由上海捷瑞生物工程有限公司合成。
1.2 主要试剂限制性内切酶 BamHⅠ/ EcoRⅠ 购自赛默飞世尔科技(中国)有限公司;Bingds FLAG tag sequence antibody 购自 Abcam 公司;Goat anti-Rabbit IgG(HRP conjugate ) 购自成都正能生物技术有限责任公司;AlxaFlour 647 标记山羊抗兔 IgG(H+L) 购自上海碧云天生物技术有限公司;细胞总 RNA 提取试剂盒购自 TIANGEN 公司;TaKaRa OneStep RNA PCR kit(AMV) 购自 TaKaRa 公司;CCK8 Kit 购自上海碧云天生物技术有限公司。
1.3 抗原表位的筛选及连接B 细胞表位筛选,通过在线软件ABCPred[6]和IEBD[7],分别预测 Apx Ⅳ、OmpH B细胞表位,选择 2 个软件重叠且评分较高肽段作为目的表位。
T细胞表位筛选,通过 CTL 表位筛选软件 NetCTLpan[8]、IEDB(MHC Ⅰ binding)[9-10]和 THL 表位筛选软件 IEDB(MHC Ⅱ binding) 分别预测 Apx Ⅳ、OmpH 基因的表位,选择每种软件不同等位基因重叠的肽段,从中选出评分较高的肽段作为目标表位,然后将以上所选肽段通过 VaxiJen软件预测其免疫原性[11],同时用 ToxinPred软件预测是否具有细胞毒性[12], 最后选取评分高、免疫原性好且无细胞毒性肽段作为目标表位。
将上述筛选出来的 B 细胞和 T 细胞表位通过柔性肽 GPGPG 连接构建出新的肽段 New。
1.4 New 肽段免疫源性分析通过 DNAstar、SOPMA、ExPASY、VaxiJen、ALGPRDE 在线软件对 New 肽段进行二级结构、亲水性、柔性、抗原性和过敏性分析。
1.5 重组真核表达载体的构建
1.5.1同源重组引物设计 根据 OmpH 蛋白、Apx ⅣA、New 序列及线性化载体两端序列设计引物,扩增引物包含交换配对碱基、酶切位点(下划线标记)以及目的基因 5′端部分序列。引物由吉凯基因生 物科技有限公司合成。
1.5.2PCR 扩增目的基因及与载体进行连接 通过 PCR 反应进行目的基因扩增。依照表 2 中的反应体系,将上述 PCR 产物于冰浴中配制,用移液枪轻轻吹打混匀,瞬时离心,于 37℃反应 30 min,然后置于冰水中冷却 5 min 后立即进行转化,并进行载体连接。

表2 连接反应体系
1.5.3转化大肠杆菌 TOP10 感受态细胞 将以上成功构建的质粒 GV658-Apx Ⅳ、GV658-OmpH、GV658-New 分别转化至大肠杆 菌 TOP10 感受态细胞,通过卡那霉素抗性培养基挑选阳性克隆。
1.5.4重组质粒图谱 如图 1 所示,A/B/C/D 分别为质粒 GV658-空载、GV658-Apx Ⅳ、 GV658-New、GV658-OmpH。
1.6 重组质粒双酶切鉴定阳性克隆菌(加入卡那霉素)过夜培养后,抽提质粒,利用限制性内切酶 BamHⅠ和 EcoRⅠ分别对质粒 GV658-Apx Ⅳ、GV658-OmpH、GV658-New 进行双酶切,验证目的条带大小。
1.7 重组质粒转染 HNK293 细胞将 HNK293 细胞依照 1×105个/孔加入 6 孔细胞培养板,于含 10%FBS 的 MEM 培养基中培养细胞融合度至 60%~70%,利用转染试剂 GeneTwinTM基因转染试剂对 GV658-Apx Ⅳ、 GV658-OmpH、GV658-New 质粒进行转染,分别于 12,24,36,48 h 对转染后每组细胞在荧光显微镜下进行拍照,观察重组质粒在 HNK293 细胞中的表达情况。
1.8 RT-PCR 验证重组质粒在 HNK293 细胞中的转录水平重组质粒 GV658-Apx Ⅳ、GV658-OmpH、GV658-New 成功转染 HNK293 细胞培养 48 h 后,经 PBS 漂洗 2 次,按照试剂盒步骤提取总 RNA,然后通过反转录试剂盒获得 cDNA。以 cDNA 为模板,用表 1 中的引物,进行 PCR 反应(程序:95℃ 5 min;95℃ 30 s,60℃30 s,72℃ 1 min,共 35 个循环;73℃ 15 min),将上述 PCR 产物进行琼脂糖凝胶电泳,观察目的条带。

表1 引物信息
1.9 Western blot 验证重组质粒在 HNK293 细胞中蛋白的表达情况各组重组质粒成功转染 HNK293 细胞培养 48 h 后,经 PBS 漂洗2次,加入细胞裂解液,使其充分裂解后,收集至 2 mL 离心管中,加入4×蛋白上样缓冲液,于100℃煮沸 20 min, 使其充分变性,迅速冷却后备用。将上述蛋白经电泳、转膜、封闭、孵育一抗(Flag 标签的兔 IgG 抗体)、孵育二 抗(辣根过氧化物酶(HRP)标记的山羊抗鼠 IgG 抗体)漂洗后,避光加入显色液,在 Bio-Rad 凝胶成像仪中,进行拍照并保存。
1.10 免疫荧光(IF)验证重组质粒蛋白在细胞中的免疫定位根据组别,于 24 孔培养板中加入多聚赖氨酸,孵育 1~2 h,弃去液体后于培养箱中过夜。调整细胞浓度为 2.0×104个/mL,进行铺板,培养 24 h 后进行转染。转染后培养 48 h, 经 PBS 漂洗 2 次,加入 4%的多聚甲醛于 4℃固定;PBST 漂洗后加入 0.5%的 TritonX-100 进行细胞打孔;经 PBST 漂洗后加入 5%BSA 进行封闭;PBST 漂洗后加入一抗(Flag 标签兔单克隆抗体)孵育;PBST 漂洗后加入二抗孵育(AlxaFlour 647 标记的山羊抗兔多克隆抗体), PBST 漂洗后加入抗荧光淬灭剂,在荧光显微镜下观察并拍照。

A~D.分别为质粒 GV658-空载、GV658-Apx Ⅳ、GV658-New、GV658-OmpH图1 重组质粒图谱
1.11 CCK-8法评估重组质粒对细胞的安全性取浓度为 1.0×104个/mL 的 HEK293A 细胞,于 96 孔板进行铺板,待细胞覆盖率达到 60%~70%,将 GV658-OmpH、GV658-Apx ⅣA、GV658-New、GV658-空载质粒和转染试剂组, 按照4个质量浓度 25,50,100,200 μg/L 进行转染,分别于 24,48,96 h,加入 CCK8 溶液 100 μL,于 37℃避光孵育 0.5~1.0 h,用酶标仪在 450 nm 波长检测每孔的吸光值,计算细胞活力。
2 结果
2.1 抗原表位的筛选及连接对目的片段 Apx ⅣA 和 OmpH 进行 B 细胞、T 细胞表位预测,选取评分较高且 2~3 个软件重叠的肽段并进行抗原性分析,筛选结果如表 3。将筛选出的序列通过连接肽 GPGPG 连接,同时在 N 末端添加 Flag 标签,构建出的新肽段命名为 New,其序列为:
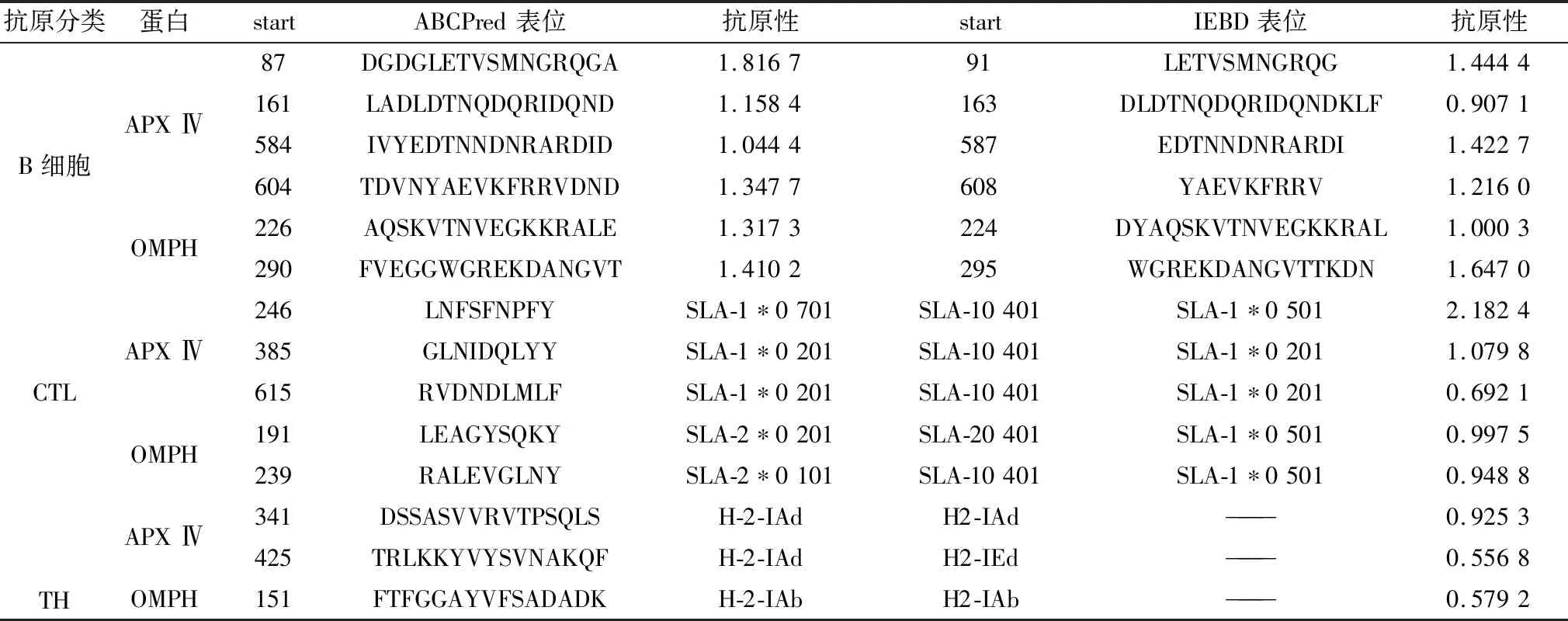
表3 Apx IVA 和 OmpH 序列 B、T 细胞表位预测结果
DGDGLETVSMNGRQGAGPGPGLADLDTNQD-QRIDQNDGPGPGIVYEDTNNDNRARDI DGPGPGTDVNYAEVKFRRVDNDGPGPGAQSKVTN-VEGKKRALEGPGPGFVEGGWGREKDANGVT-GPGPGLNFSFNPFYGPGPGGLNIDQLYYGPGP-GRVDNDLMLFGPGPGLEAGYSQKYGPGPGR-ALEVGLNYGPGPGDSSASVVRVTPSQLSGPG-PGTRLKKYVYSVNAKQFGPGPGFTFGGAYV-FSADADK
2.2 New 序列二级结构、抗原性和过敏性分析通过在线软件 SOPMA 对 New 序列进行二级结构分析,结果如图 2 所示,α螺旋为 0.4%, β转角为 3.59%,延伸连为 38.65%,无规则卷曲为 57.37%,表明该序列二级结构中较少的 α螺旋、β转角,结构松散有利于与免疫源结合;用 VaxiJen 软件预测 New 序列的抗原性, 评分为 1.334 5,分值大于 0.4 即为具有抗原性,该序列预测结果显示其抗原性较好;用 ALGPRDE 软件预测 New 序列的过敏性,结果显示 New 序列无过敏性(图 2)。

图2 New 序列二级结构分析
2.3 New 序列稳定性分析通过在线软件 ExPASY 对 New 序列进行分析,结果显示,该序列不稳定指数为 13.83%,脂肪指数为 53.19,脂肪指数高更具热稳定性;亲水性结果如图 3 所示,平均值(GRAVY)为-0.726。此结果表明 New 序列较稳定,亲水性较好。

图3 New 序列亲水性分析
2.4 重组质粒双酶切鉴定抽提 GV658-OmpH、GV658-Apx ⅣA 和 GV658-New 重组质粒,经 BamHⅠ、EcoRⅠ双酶切,酶切产物用 1%琼脂糖凝胶电泳检测,结果如图 4 所示,分别获得 960,2 190,756 bp 目的片段,与目的基因相符,经测序和同源性分析,未发现碱基缺失、增加及突变,表明 3 种重组质粒构建成功。

M.1 kb DNA Marker;1.GV658-New;2.GV658-ApxⅣA;3.GV658-OmpH图4 重组质粒双酶切结果
2.5 重组质粒在 HNK293 细胞中的表达情况荧光显微镜下观察,重组质粒 GV658-OmpH、GV658-Apx ⅣA 和 GV658-New 转染 HNK293 细胞,在 12 h 开始表达,表现出绿色荧光,且荧光强度在 24,36,48 h 逐步增强。 结果表明,各重组质粒在 HNK293 细胞中均可成功表达,48 h 表达效果最好(图 5)。

图5 重组质粒转染 NHK293A 细胞结果
2.6 RT-PCR 验证重组质粒在 HNK293 细胞中的转录水平将 3 种重组质粒转染 HNK293 细胞 48 h 后,提取总 RNA,经反转录试剂盒反转为 cDNA, 用表 1 中的引物进行 PCR,验证重组质粒在细胞中的转录水平。结果如图 6 所示,成功获 得 960,2 190,765 bp 的特异性条带,与预期完全一致,表明重组质粒转染 HEK293A 细胞后,目的基因在 HNK293 细胞中成功进行转录。
2.7 Western blot 验证重组质粒在 HNK293 细胞中的蛋白表达将 3 种重组和空载质粒转染 HNK293 细胞 48 h 后,用获得的蛋白进行 Western blot, 结果如图 7 所示,Apx ⅣA、OmpH、New 蛋白,分别在 83,38,30 kDa 处出现特异性条带,空载及未转染的 NHK293 细胞未出现特异性条带, GAPDH 内参各组均在 36 kDa 处出现特异性条带。结果表明,添加 Flag 标签的 Apx ⅣA、OmpH 蛋白及New基因蛋白在 HNK293A 细胞中能够成功表达,且特异性蛋白条带与目的基因相符。

M.DL2000 DNA Marker;1~3.分别为GV658-OmpH、GV658-Apx ⅣA 和 GV658-New图6 重组质粒 RT-PCR 结果
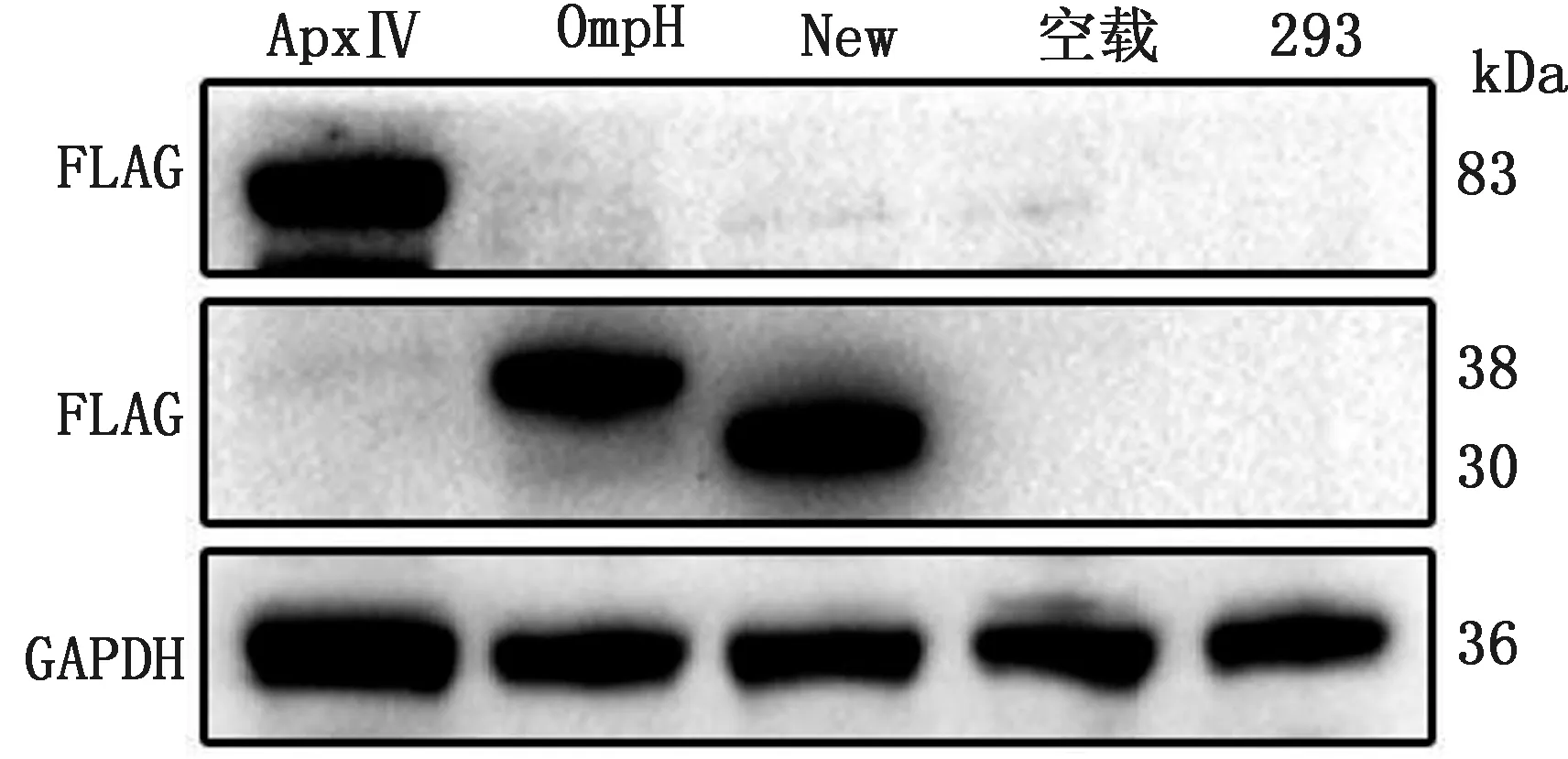
图7 重组质粒在 NHK293A 细胞中的蛋白表达情况
2.8 免疫荧光(IF)验证重组质粒 在HNK293 细胞中的免疫定位将3种重组和空载质粒转染 HEK293A 细胞,通过免疫荧光(IF)试验,在荧光显微镜 Cy5 荧光通道下观察,结果如图 8 所示,A、B、C 组可见较亮荧光且细胞形态清晰,D 组未见荧光,说明 A、B、C 组质粒在细胞中成功表达,D 组无特异性蛋白表达。由此说明重组质粒转染后,成功在 HEK293A 细胞中定位。
2.9 CCK-8法评估重组质粒对细胞活性的影响将 3 种重组质粒、空载质粒及转染试剂依照 25,50,100,200 μg/L 4个质量浓度转染 HNK293 细胞,转染试剂组作为对照组。结果如果图 9 所示(图 A~D,分别为转染 24,28,72 h 结果),转染后 24,48,72 h 后,不同质量浓度质粒转染细胞的活率差异显著(P<0.05),相同质量浓度组间差异不显著(P>0.05)。随着转染质粒质量浓度及转染试剂的增加,细胞活率降低,且空载组和转染试剂组出现相同规律。由以上结果分析可知,重组质粒对细胞无损伤作用,细胞活率降低由转染试的增加导致,且随着培养时间的增加,细胞自身生存活性降低,增加转染试剂的量,进一步影响细胞活率,72 h 时细胞活率最低。
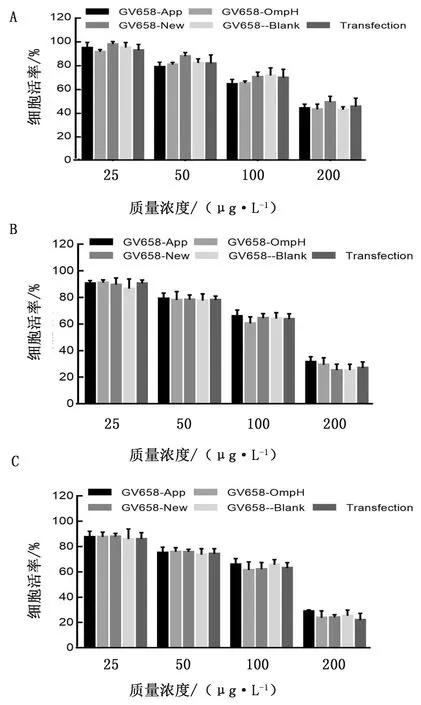
图9 CCK-8 试验结果
3 讨论
猪胸膜肺炎和猪肺疫是猪场常见的呼吸道系统传染病,这 2 种疾病的致病性及临床表现相似,常呈混合感染并难以区分均是一种以呼吸道症状为主的传染病,给养猪业带来巨大损失。 有研究显示,目前已报道的商品化疫苗,在保护以上两种疾病的感染并未取得令人满意的效果,最新的研究主要集中在寻找所有血清型中高度保守的抗原,可以作为亚单位疫苗研究的候选者,同时克服弱毒疫苗的突变及毒力反强的问题[13]。
A.GV658-OmpH;B.GV658-Apx IVA;C.GV658-New;D.空白对照图8 重组质粒在细胞中的免疫定位
多项研究证明了APP的Apx毒素在抵抗猪胸膜肺炎的保护性免疫中的重要性,针对Apx 毒素的中和抗体可以保护嗜中性粒细胞免于被杀死,从而使其能够有效清除侵入的细菌[14]。 Apx Ⅳ 存在于APP所有血清型中,有研究报道可使血清抗体效价较其他外毒素明显增加, 攻毒试验可提供完全保护[1];OmpH是Pm最主要的外膜蛋白,其即能诱导机体产生同源保护 有能产生异源保护,可有效诱导动物产生特异抗体,从而发挥免疫保护作用[15]。因此,本研究选取Apx Ⅳ和OmpH作为研究对象。
表位是宿主免疫系统识别抗原的关键区域,优势抗原表位的筛选是当前疫苗研发的新策 略。本研究中所筛选构建的New肽段,经在线软件预测具有较好抗原性,可作为疫苗研究的候选者,同时构建的3中重组质粒转染HNK239细胞后,均可正常表达,且重组质粒对HNK293 细胞均无明显损伤作用,随着浓度及时间的增加与对照组相比无明显差异,高浓度组质粒细 胞存活率较低浓度组低,可能由于转染试剂对应增加的影响导致。此结果的顺利获得,因构 建载体加入GFP荧光标签,有利于评估质粒是否成功转染;3段序列N末端均添加Flag标签, 可间接评估蛋白表达情况。本研究所构建的3种质粒可成功表达且对HNK293细胞无明显损 伤,因此,可利用以上3种质粒构建APP与Pm二联亚单位疫苗,对传染性胸膜肺炎与猪肺疫的防控具有一定的临床应用价值。
