菜粉蝶热激蛋白70(HSP70)基因的分子特性及其对杀虫剂胁迫的响应
2021-12-23丁朝阳李茂业
丁朝阳, 赵 乐, 刘 苏, 李茂业
(安徽农业大学植物保护学院, 作物有害生物综合治理安徽省重点实验室, 合肥230036)
热激蛋白(heat shock proteins, HSPs)又称热休克蛋白,是普遍存在于原核与真核生物的一类分子伴侣,其主要功能是帮助细胞内其他新生肽链正确折叠、减少肽链非正常聚集,以及帮助错误折叠的肽链降解(Feder and Hofmann, 1999)。生物体在外界不利环境因子(如低温、高温和紫外线辐射等)的胁迫下,蛋白功能受损,细胞稳态被破坏,此时HSPs大量表达,帮助生物体抵御外界胁迫,从而增强生物体的抗逆能力(Sørensenetal., 2003)。根据HSPs的分子量大小,可将其划分为4个家族:HSP90, HSP70, HSP60和小分子量HSP(King and MacRae, 2015)。其中HSP70家族又包括诱导型HSP70和组成型HSC70。诱导型HSP70在正常情况下表达量较低,但受到外界因子胁迫后其表达量迅速增加;而组成型HSC70在外界因子胁迫下表达量变化不显著(Moreira-de-Sousaetal., 2018)。
昆虫同样表达多个家族的HSPs(王海鸿和雷仲仁, 2005)。其中HSP70家族是最为保守的一类,该家族因为在昆虫抵御外界胁迫中的重要功能而受到广泛关注(King and MacRae, 2015)。如烟粉虱Bemisiatabaci受到高温胁迫后,1个HSP70基因表达量迅速上调,而利用RNA干扰技术沉默该基因后,试虫在高温胁迫下的死亡率显著升高(Wangetal., 2019)。又如大量失水使埃及伊蚊Aedesaegypti的1个HSP70基因的表达水平大幅提升,而沉默该基因后,试虫对失水胁迫的耐受性显著降低(Benoitetal., 2010)。此外,当昆虫遭受紫外线、杀虫剂、重金属、病原物以及天敌寄生等胁迫时,HSP70基因的表达量均迅速增加,以增强昆虫对这些胁迫因子的抵御能力(Chenetal., 2012; Huetal., 2019; 杨昌利等, 2019; Zhouetal., 2020)。还有一些研究表明,昆虫HSP70基因的表达受保幼激素调控,并参与昆虫的生殖与发育过程(Guetal., 2012; Luoetal., 2017)。
菜粉蝶Pierisrapae属鳞翅目(Lepidoptera)粉蝶科(Pieridae),是为害十字花科作物的重要害虫。菜粉蝶幼虫取食叶片,严重时叶片只剩叶脉和叶柄;幼虫排泄物能引起作物软腐病,严重影响作物的产量和质量(蒋杰贤等, 2002)。施用化学杀虫剂仍是目前控制菜粉蝶为害的有效措施,高效氯氟氰菊酯和氯虫苯甲酰胺是当前常用的两种药剂(王品舒等, 2017)。在其他昆虫中虽有一些研究表明HSP70在抵御杀虫剂胁迫中起作用,但菜粉蝶的HSP70是否参与对杀虫剂胁迫的响应,目前仍然未知。本研究鉴定了菜粉蝶3个HSP70基因,分析了它们所编码蛋白的分子特征,并检测了这些基因在不同发育阶段、不同组织以及在高效氯氟氰菊酯和氯虫苯甲酰胺胁迫下的表达谱,以期为进一步研究HSP70在菜粉蝶抵御杀虫剂胁迫中的功能和作用机制提供前期基础。
1 材料与方法
1.1 供试昆虫
供试菜粉蝶为本实验室饲养种群(Liuetal., 2017)。幼虫使用甘蓝叶片饲养,成虫饲喂10%(v/v)蜂蜜水,饲养温度为25±1℃,相对湿度为70%±5%,光周期为16L∶8D。收集2-5龄幼虫、蛹和雌雄成虫,其中2龄幼虫收集30头,其余龄期幼虫、蛹和成虫均为15头,分别为一个生物学重复。取4龄幼虫30头为一个生物学重复,在冰上解剖中肠、马氏管、脂肪体和体壁。各虫龄试虫和组织解剖试虫取样均设置3次生物学重复。所有样品均用液氮速冻,置于-80℃超低温冰箱保存备用。
1.2 杀虫剂处理
高效氯氟氰菊酯和氯虫苯甲酰胺原药购自德国Dr. Ehrenstorfer公司,纯度均大于95%。将两种杀虫剂分别溶于丙酮,并分别稀释至0.12和1.04 ng/μL。采用点滴法,将2种药剂分别点滴至菜粉蝶4龄幼虫腹部背板上,每头幼虫点滴1 μL。所用剂量均为这2种杀虫剂的LD20剂量(Liuetal., 2017)。对照组试虫点滴等量的丙酮。分别于处理后0, 6, 12, 18和24 h收集存活的试虫,液氮速冻后保存于-80℃超低温冰箱。实验设3次生物学重复,每个生物学重复包含30头试虫。
1.3 RNA提取和cDNA第1链合成
使用RNAiso Plus试剂(宝生物,大连)提取样本的总RNA。使用琼脂糖凝胶电泳和NanoDrop 2000超微量分光光度计(Thermo Scientific,美国)检测RNA的完整性和浓度。利用ReverTra Ace qPCR RT Master Mix with gDNA Remover反转录试剂盒(东洋纺,日本)合成cDNA第1链。
1.4 菜粉蝶HSP70基因鉴定与序列分析
以小菜蛾Plutellaxylostella的HSP70氨基酸序列为模板(夏晓峰等, 2013),使用BioEdit软件中的BLAST程序(TBLASTN算法,e-value=1×105),在菜粉蝶转录组unigene库(Qietal., 2016)中进行同源检索,获得菜粉蝶HSP70基因的cDNA序列。这些基因所编码蛋白质的分子量和等电点使用ExPASy在线工具计算(http:∥web.expasy.org/compute_pi/),亚细胞定位使用CELLO程序预测(http:∥cello.life.nctu.edu.tw/)。下载菜粉蝶全基因组DNA序列(Shenetal., 2016),使用Splign程序分析菜粉蝶HSP70基因在基因组框架(scaffold)上的位置及其外显子和内含子结构(https:∥www.ncbi.nlm.nih.gov/sutils/splign/splign.cgi)。多序列联配使用Clustal Omega程序进行(http:∥www.ebi.ac.uk/tools/msa/clustalo/),联配结果导入MEGA7.0软件,使用最大似然法(maximum likelihood)构建系统进化树(Kumaretal., 2016)。各分支置信度经Bootstrap法循环检验1 000次。
1.5 基因表达谱分析
使用实时荧光定量PCR检测菜粉蝶HSP70基因的表达谱。所用引物列于表1,使用菜粉蝶18S rRNA和β-actin基因作为双内参基因(Liuetal., 2017)。在预实验中,先利用反转录PCR和琼脂糖凝胶电泳确认这些引物的扩增产物均为单一条带,再将条带回收,送生物公司测序,确认扩增产物是目标片段。同时以不同浓度的cDNA第1链为模板进行扩增,以Ct值为纵坐标,模板浓度对数值为横坐标,进行直线拟合,根据直线的斜率计算引物扩增效率(表1)。
荧光定量PCR所用试剂为SYBR Green Real-time PCR Master Mix(东洋纺,日本),反应总体系(20 μL): SYBR Green Mix 10 μL, cDNA第1链模板(10 ng)1 μL, 上下游引物(10 μmol/L)各0.5 μL,无核酸酶的水8 μL。所用仪器为Bio-Rad公司CFX96型实时荧光定量PCR仪,热循环参数: 95℃ 30 s; 95℃ 5 s, 60℃ 25 s, 40个循环。热循环步骤结束后,温度从60℃逐步上升至95℃,记录熔解曲线,以检测是否存在引物二聚体和非特异性扩增。同时在每一轮反应中均设置无核酸酶的对照和无cDNA模板的对照,以检测反应液中是否存在污染。试验设置3次生物学重复,每个生物学重复中包含4次技术重复,使用相对定量法计算基因表达量(Pfaffl, 2001)。
1.6 数据分析
数据统计使用DPS数据处理系统v9.5版(Tang and Zhang, 2013)进行,采用单因素方差分析(one-way ANOVA)结合Tukey氏多重比较法分析多个样本之间的显著性差异,显著性水平设为P<0.05。

表1 本实验所用引物Table 1 Primers used in this study
2 结果
2.1 菜粉蝶HSP70基因序列分析
通过检索菜粉蝶转录组,获得了3个HSP70基因的cDNA序列,分别命名为PrHsp70-1,PrHsp70-2和PrHsp70-3(GenBank登录号分别为MW691114, MW691115和MW691116)。这3个PrHsp70基因编码的PrHSP70蛋白长度分别为628, 630和653个氨基酸,分子量分别为68.7, 69.2和71.7 kD。亚细胞定位预测结果表明,这3个PrHSP70蛋白均位于细胞质内。BLASTX最佳匹配结果表明,PrHSP70-1和PrHSP70-2分别与庆网蛱蝶Melitaeacinxia的HSP70-3(GenBank登录号: AGR84218)和HSP70-2(GenBank登录号: AGR84224)的氨基酸一致性最高,分别为85%和91%;而PrHSP70-3与小菜蛾HSC70(GenBank登录号: BAE48743)的氨基酸一致性最高,为92%。
多序列联配结果表明,3个PrHSP70蛋白中均含有HSP70家族的3个特征序列,前2个特征序列分别为IDLGTTYS和IFDLGGGTFDVSIL,第3个特征序列在PrHSP70-1和PrHSP70-2中为I/VVM/LVGGSTRIPKIQN/S,而在PrHSP70-3中为IVLVGGSTRIPRVQK(图1)。此外,3个PrHSP70蛋白羧基末端的4个氨基酸残基均为EEVD(图1)。
3个PrHsp70基因位于不同的基因组框架(scaffold)上,其中PrHsp70-1位于scaffold_7,而PrHsp70-2和PrHsp70-3分别位于scaffold_109和scaffold_95(图2)。PrHsp70-1和PrHsp70-2仅有1个外显子,无内含子,而PrHsp70-3在2个外显子之间有一段346 bp的内含子(图2)。
2.2 HSP70基因系统进化
基于不同种类昆虫的HSP70蛋白序列构建了系统进化树(图3)。从图中可见,昆虫HSP70被分为3个主要类群:胞质HSP70、内质网HSP70和线粒体HSP70。本研究鉴定的3个菜粉蝶PrHSP70均被划分至胞质HSP70类群,且被聚类至不同的进化分支中(图3)。菜粉蝶PrHSP70-1与庆网蛱蝶的McHSP70(GenBank登录号: AGR84218)亲缘关系最近,而PrHSP70-2所在的进化分支中有多个鳞翅目HSP70,如家蚕Bombyxmori的BmHSP70(GenBank登录号: NP_001296526)、斜纹夜蛾Spodopteralitura的SlHSP70(GenBank登录号: XP_022834808)和烟草天蛾Manducasexta的MsHSP70(GenBank登录号: XP_030032651)等。PrHSP70-3则与小菜蛾PxHSC70(GenBank登录号: BAE48743)和二化螟CsHSC70(GenBank登录号: BAE44308)处于同一进化分支(图3)。

图1 菜粉蝶PrHSP70氨基酸序列联配Fig. 1 Alignment of amino acid sequences of PrHSP70s of Pieris rapae3个HSP70特征序列和羧基末端的EEVE基序以方框标示。Three HSP70 signature motifs and the C-terminal EEVE motif are boxed.

图2 菜粉蝶PrHsp70基因的外显子和内含子结构Fig. 2 Exon-intron structure of PrHsp70 genes of Pieris rapae
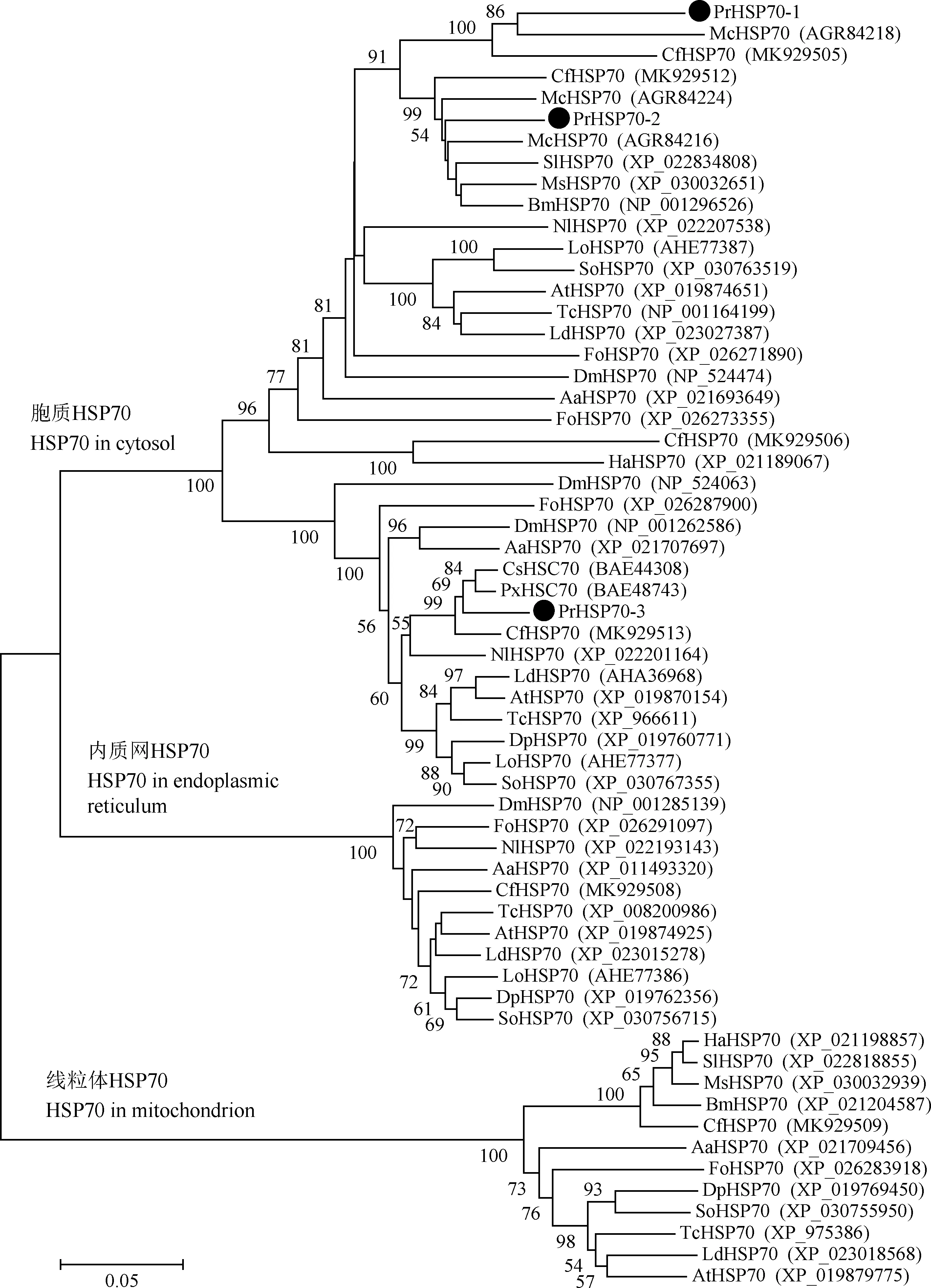
图3 基于氨基酸序列的昆虫HSP70系统进化分析Fig. 3 Phylogenetic analysis of insect HSP70s based on amino acid sequence蛋白来源物种名缩写Origin species abbreviation of proteins: Pr: 菜粉蝶Pieris rapae; Cs: 二化螟Chilo suppressalis; Px: 小菜蛾Plutella xylostella; Mc: 庆网蛱蝶Melitaea cinxia; Cf: 云杉卷叶蛾Choristoneura fumiferana; Bm: 家蚕Bombyx mori; Ms: 烟草天蛾Manduca sexta; Ha: 棉铃虫Helicoverpa armigera; Sl: 斜纹夜蛾Spodoptera litura; Tc: 赤拟谷盗Tribolium castaneum; Ld: 马铃薯甲虫Leptinotarsa decemlineata; Dp: 山松大小蠹Dendroctonus ponderosae; Lo: 稻水象甲Lissorhoptrus oryzophilus; So: 米象Sitophilus oryzae; At: 小蜂甲Aethina tumida; Fo: 西花蓟马Frankliniella occidentalis; Nl: 褐飞虱Nilaparvata lugens; Dm: 黑腹果蝇Drosophila melanogaster; Aa: 埃及伊蚊Aedes aegypti. 括号中为GenBank登录号; 3个PrHSP70蛋白以黑色圆圈标注。GenBank accession numbers are shown in parentheses. Three PrHSP70s are indicated by solid circles.
2.3 PrHsp70基因在不同发育阶段和不同组织的表达模式
实时荧光定量PCR结果表明,PrHsp70-1和PrHsp70-2基因具有相似的表达模式,即在低龄幼虫期表达量最低,在5龄幼虫期表达量最高,但在蛹期和成虫期表达量又显著降低(P<0.05)(图4: A, B);PrHsp70-3在供试的不同发育阶段样本中的表达量差异不显著(P>0.05)(图4: C)。PrHsp70基因在4龄幼虫不同组织中的表达模式不同,PrHsp70-1在脂肪体中的表达水平最高,且显著高于在其他组织中的(P<0.05)(图4: D),PrHsp70-2在中肠中的表达水平最高(图4: E),PrHsp70-3在体壁和脂肪体中的表达量均最高(图4: F)。

图4 菜粉蝶PrHsp70基因在不同发育阶段(A-C)和4龄幼虫不同组织(D-F)中的表达谱Fig. 4 Expression profiles of PrHsp70 genes in Pieris rapae at different developmental stages (A-C)and in different tissues of the 4th instar larvae (D-F)A, D: PrHsp70-1; B, E: PrHsp70-2; C, F: PrHsp70-3. 2nd: 2龄幼虫2nd instar larva; 3rd: 3龄幼虫3rd instar larva; 4th: 4龄幼虫4th instar larva; 5th: 5龄幼虫5th instar larva; P: 蛹Pupa; fA: 雌成虫Female adult; mA: 雄成虫Male adult; MG: 中肠Midgut; MT: 马氏管Malpighian tubules; FB: 脂肪体Fat body; IN: 体壁Integument. 图中数据为平均值±标准误;柱上不同小写字母表示基因表达量差异显著(P<0.05, 单因素方差分析和Tukey氏多重比较法)。Data in the figure are mean±SE. Different lowercase letters above bars indicate significant difference in the gene expression level (P<0.05, one-way ANOVA and Tukey’s test). 图5同The same for Fig. 5.
2.4 PrHsp70基因在LD20剂量杀虫剂胁迫下的表达模式
LD20剂量高效氯氟氰菊酯处理4龄幼虫后,PrHsp70-2响应最迅速,处理6 h后其表达量即显著高于丙酮处理的对照组(P<0.05)(图5: B),而PrHsp70-1和PrHsp70-3对高效氯氟氰菊酯的响应较迟缓,在处理12 h后才开始上调(图5: A, C)。PrHsp70-1在高效氯氟氰菊酯处理18 h后达到最大表达量,但在24 h时下调至正常水平,与对照组无显著差异(P>0.05)(图5: A)。PrHsp70-2在18 h时的表达量最高,在24 h时虽然下调,但仍显著高于对照组(图5: B)。PrHsp70-3在处理18 h后开始下调,处理24 h后其表达量显著低于对照组(P<0.05)(图5: C)。
LD20剂量氯虫苯甲酰胺处理4龄幼虫后,PrHsp70-1和PrHsp70-2的表达水平在4个时间段(6, 12, 18和24 h)均显著上调(P<0.05)(图5: D, E)。其中PrHsp70-1表达量在处理12 h后达到最大值(图5: D),而PrHsp70-2表达量在处理18 h后达到最大值(图5: E)。PrHsp70-3的表达量在处理6 h后显著上调,处理12 h和18 h后虽有下降,但仍显著高于对照组;该基因在处理24 h后恢复正常表达水平,与对照组无显著差异(P>0.05)(图5: F)。

图5 菜粉蝶4龄幼虫PrHsp70基因在LD20剂量的高效氯氟氰菊酯(A-C)和氯虫苯甲酰胺(D-F)胁迫下的表达谱Fig. 5 Expression profiles of PrHsp70 genes in the 4th instar larvae of Pieris rapae exposed toLD20 of lambda-cyhalothrin (A-C) and chlorantraniliprole (D-F)A, D: PrHsp70-1; B, E: PrHsp70-2; C, F: PrHsp70-3.对照组试虫点滴等体积丙酮。The test insects in the control group were dipped with equal volume of acetone.
3 讨论
本研究鉴定了菜粉蝶3个PrHsp70基因。这3个基因编码的PrHSP70蛋白的分子量均为70 kD左右,均与其他昆虫中注释的HSP70蛋白具有极高的氨基酸一致性,并且这3个PrHSP70蛋白均具有HSP70家族的3个特征序列(图1),表明它们属于HSP70家族成员(谭瑶等, 2017; 杨昌利等, 2019)。HSP70家族包含诱导型HSP70和组成型HSC70,Sonoda等(2006)和Zhang等(2015)分析了鳞翅目代表性昆虫二化螟和小菜蛾的HSP70和HSC70序列,认为“IVLVGGSTRIPKVQK”可能是鳞翅目HSC70的代表性特征。但本研究鉴定的3个PrHSP70蛋白均不具备该特征,因此这3个PrHSP70蛋白之中是否存在HSC70,尚需进一步研究。此外,3个PrHSP70蛋白羧基末端的4个氨基酸残基均为EEVD,此基序是热激蛋白的胞质定位信号,推测3个PrHSP70蛋白均位于胞质内(Rosenzweigetal., 2019),这一推论也与亚细胞定位预测和系统进化分析结果相符。PrHsp70基因序列的成功获得为后续研究这些基因在菜粉蝶生长发育及胁迫响应中的功能奠定了基础。
研究PrHsp70基因在菜粉蝶不同发育阶段和幼虫组织的表达模式,对于基因功能的预测有重要意义。本实验发现在供试的菜粉蝶不同发育阶段和幼虫组织样本中均能检测到PrHsp70基因的表达,表明这3个基因编码的蛋白广泛参与菜粉蝶不同发育阶段的生理活动中。在不同发育阶段菜粉蝶中,PrHsp70-1和PrHsp70-2的表达水平均随着幼虫龄期的增加而增加,但在蛹期和成虫期显著下降(图4: A, B),表明这2个基因在幼虫生长发育中起重要作用。相对于蛹期和成虫期,幼虫期的昆虫更容易遭受外界不利因子的胁迫(王泽华等, 2014; Stejskaletal., 2021),因而高量表达的PrHsp70基因可能也反映了幼虫期菜粉蝶受到的环境压力。本研究同时发现,PrHsp70-1在脂肪体的表达水平最高(图4: D),PrHsp70-2在中肠的表达水平最高(图4: E)。脂肪体是昆虫重要的新陈代谢器官,其较高的氧化水平可能会导致细胞压力增大(Lietal., 2019);中肠是昆虫重要的消化器官,中肠细胞需要应对食物中的植物次生化合物以及食物表面的环境污染物和病原微生物等(Terraetal., 2019),因此这些器官需要PrHSP70来保护并维持细胞的正常功能。在其他昆虫中,也发现很多在脂肪体和中肠大量表达的HSP70基因(夏晓峰等, 2013; 孙猛等, 2014)。PrHsp70-3既大量表达于脂肪体,也大量表达于体壁(图4: F)。昆虫体壁是内部器官与外界环境之间的屏障,外界不利环境因子直接作用于体壁之上(刘晓健等, 2019)。因此PrHsp70-3在体壁大量表达可能会提高菜粉蝶对逆境的耐受性。
对于昆虫来说,杀虫剂是最为重要的一类非生物胁迫因素。HSP70基因在昆虫抵御杀虫剂胁迫中的作用已有一些报道,如在褐飞虱Nilaparvatalugens中,吡虫啉胁迫显著增加了1个HSP70基因的表达水平,而沉默该基因后,试虫对吡虫啉的敏感性显著上升(Luetal., 2017);在亚洲玉米螟Ostriniafurnacalis中,HSP70蛋白能够结合苏云金芽孢杆菌杀虫晶体蛋白,增强害虫的抗性(Shabbiretal., 2020)。 此外,当西花蓟马Frankliniellaoccidentalis、苹果蠹蛾Cydiapomonella和灰飞虱Sogatellafurcifera等昆虫受到阿维菌素、啶虫脒、噻虫嗪等杀虫剂胁迫后,HSP70基因表达水平均显著上调(Wangetal., 2014; Yangetal., 2016; Zhouetal., 2020)。本研究发现LD20剂量高效氯氟氰菊酯和氯虫苯甲酰胺处理能够诱导3个PrHsp70基因不同程度上调表达(图5),它们的功能可能是在细胞内合成更多的PrHSP70蛋白,进而通过修复杀虫剂胁迫导致的细胞损伤,增强菜粉蝶对杀虫剂胁迫的抵御能力。另一方面,本研究发现LD20剂量高效氯氟氰菊酯处理24 h后,PrHsp70-3显著下调表达(图5: C)。外界胁迫诱导HSP70基因下调的现象在云杉卷叶蛾Choristoneurafumiferana和灰飞虱等昆虫中也存在(Quanetal., 2020; Zhouetal., 2020),这可能是昆虫应对杀虫剂胁迫的一种生理应激机制,因为HSP70蛋白行使功能需要消耗腺苷三磷酸(adenosine triphosphate, ATP),HSP70基因下调表达可以维持细胞内ATP合成与消耗之间的平衡(Quanetal., 2020)。
需要指出的是,本研究只探讨了菜粉蝶PrHsp70基因对杀虫剂胁迫的响应,未研究这些基因在温度胁迫下的表达模式。明确PrHsp70基因对温度胁迫的响应可以更好地区分诱导型和组成型HSP70家族成员,并有助于更好地理解该基因家族在抵御外界胁迫中的作用。此外,本研究只从基因表达层面分析了PrHsp70基因与杀虫剂胁迫之间的关系,未研究这些基因所编码的蛋白质在这一过程中的作用。在后续实验中,我们将利用蛋白异源表达和RNA干扰等技术,深入探讨PrHsp70基因响应杀虫剂及其他环境胁迫因子的生理与分子机制。
