C-型凝集素RfCTL-S1在红棕象甲幼虫免疫防御中的作用
2021-12-23鲁盛平刘惠惠苏治平刘倩霞侯有明石章红
鲁盛平, 刘惠惠, 苏治平, 刘倩霞, 侯有明, 石章红,*
(1. 福建农林大学, 闽台作物有害生物防控国家重点实验室, 福州 350002; 2. 生物农药与化学生物学教育部重点实验室,福州 350002; 3. 福建农林大学植物保护学院, 福建省昆虫生态学重点实验室, 福州 350002)
现有证据表明,昆虫体内的模式识别受体(pattern recognition receptors, PRRs)可以识别入侵微生物的病原相关分子模式(pathogen-associated molecular patterns, PAMPs),并在昆虫免疫反应的激活中扮演关键角色(Iwanagaetal., 2005; Zhanetal., 2016; Dawadietal., 2018)。在无脊椎动物中,已经鉴定到的PRRs包括以下6个家族:C-型凝集素(C-type lectins, CTLs)、肽聚糖识别蛋白(peptidoglycan recognition proteins, PGRPs)、革兰氏阴性细菌结合蛋白(Gram-negative bacteria-binding proteins, GNBPs)、含硫脂蛋白(thioester-containing proteins, TEPs)、Toll样受体(Toll-like receptors, TLRs)和半乳糖苷结合凝集素(galactoside-binding lectins, GALEs)(Medzhitov and Janeway, 2002; 邢建晓等, 2016; 余静等, 2017)。C-型凝集素(CTLs)是一类重要的模式识别受体,通过识别病原表面的糖配体广泛参与介导昆虫的体液免疫和细胞免疫(Brownetal., 2018; Dawadietal., 2018)。例如,黑腹果蝇Drosophilamelanogaster的DmCTL1能特异识别革兰氏阴性细菌大肠杆菌Escherichiacoli,在Ca2+存在时,可以与大肠杆菌发生凝集反应(Tanjietal., 2006)。重组表达的IML2可以激活酚氧化酶级联反应,进而触发烟草天蛾Manducasexta对寄生蜂卵的包囊和黑化反应(Yu and Kanost, 2000)。家蚕Bombyxmori的BmMBP属于“immulectin”型成员,对革兰氏阴性细菌、革兰氏阳性细菌和真菌都具有凝集活性(Zhanetal., 2006)。
红棕象甲Rhynchophorusferrugineus是我国的一种林业外来入侵害虫,严重危害棕榈科经济植物和甘蔗等农作物,并已造成严重的经济损失。因此,该害虫已被列为我国境内的一种高风险检疫性有害生物(鞠瑞亭等, 2006; Shietal., 2014)。除交配和产卵外,该害虫通常隐藏在棕榈植物的树干内生活。因此,在生产实践中,该害虫的危害症状十分隐蔽、通常很难被发现,从而造成巨大的防治困难(Shietal., 2014)。目前,化学防治是针对该害虫的主要应急防控措施。然而,现有证据表明该害虫已对多种农药产生较强的抗药性(Liuetal., 2021)。因此,发展基于信息素的诱捕技术和生物防治的绿色防控方案对该害虫的持续管理具有重要的实践意义(El-Suftyetal., 2007; Poorjavadetal., 2009)。已有研究发现,球孢白僵菌Beauveriabassiana和粘质沙雷氏菌Serratiamarcescens对红棕象甲幼虫有较好的杀虫活性(Dembilioetal., 2010; Puetal., 2017; Muhammadetal., 2019)。然而,红棕象甲如何抵御这些病原生物侵染的机理尚不清楚。因此,本研究综合运用生物信息学、RT-qPCR、细菌注射感染和RNAi等方法分析了红棕象甲C-型凝集素基因RfCTL-S1的序列特征、组织表达谱及其被沉默后对红棕象甲幼虫肠道和脂肪体中的抗菌肽(antimicrobial peptide, AMP)表达水平以及对其清除感染细菌能力的影响。本研究揭示了红棕象甲C-型凝集素在该害虫免疫防御中的作用角色,为生产实践中提升病原微生物对红棕象甲的防治效率提供了新的科学依据。
1 材料与方法
1.1 供试昆虫
红棕象甲的实验室种群饲养于人工气候培养箱(DRX-260,宁波赛福实验仪器有限公司),参数设置为:温度27±1℃,相对湿度75%±5%,光周期12L∶12D。成虫按1雌∶1雄配对置于圆柱状透明塑料盒(直径7 cm,高10 cm)内,盒盖有透气小孔。盒内放置新鲜的甘蔗片作为食物,然后将盒子放入培养箱,每3~4 d更换一次甘蔗片。更换甘蔗片后,将取出的旧甘蔗片小心剖开,用毛笔挑出虫卵置于直径为7 cm的玻璃培养皿中,皿中铺有润湿的滤纸,然后将培养皿装入纸盒避光放入培养箱待其孵化。待幼虫孵化后,将孵化出的小幼虫转移至新的培养皿,每皿1头幼虫,并加入新鲜甘蔗片,同样避光放入培养箱,每3~4 d更换一次甘蔗。幼虫化蛹后,取出培养皿中的甘蔗片,加入干净潮湿的甘蔗碎屑,继续放回培养箱待其羽化。其中部分4龄幼虫用于后续的试验。
1.2 红棕象甲RfCTL-S1的序列分析
基于实验室前期从红棕象甲转录组克隆获得的RfCTL-S1序列(GenBank登录号: MW538037),使用ORF finder tool(https:∥www.ncbi.nlm.nih.gov/orffinder/)和ExPASy-Translate tool (https:∥web.expasy.org/translate/)分别预测红棕象甲RfCTL-S1的开放阅读框和其编码的氨基酸序列,随后采用在线分析工具SMART(http:∥smart.embl-heidelberg.de/)预测RfCTL-S1所含有的保守结构域,使用软件MEGA 5.2中的最大似然法分析RfCTL-S1与其他同源蛋白的系统发育关系。
1.3 红棕象甲幼虫体内RfCTL-S1的组织表达谱分析
随机选取长势相同的红棕象甲4龄幼虫解剖获得其不同组织(头、体壁、前肠、中-后肠、血淋巴、脂肪体),每种组织取3个生物学重复,每个生物学重复含3头试虫。参照Dawadi等(2018)描述的方法步骤,然后采用TRIzol法(ThermoFisher Scientific,美国)从上述组织中提取总RNA。用微量分光光度计(NanoDrop 2000, Thermo)和琼脂糖凝胶电泳检测总RNA质量及浓度,符合要求的样品-80℃保存备用。用反转录试剂盒(B24403, 北京全式金生物科技有限公司)制备cDNA,保存在-20℃冰箱中备用。使用在线引物设计软件Primer Premier 3.0(http:∥bioinfo.ut.ee/primer3-0.4.0/)设计RT-qPCR引物(表1)。采用SYBR Green Master(Roche, Cat.No.04913850001)试剂盒在实时荧光定量PCR仪(Life Technology, 美国)上进行RT-qPCR。反应总体系(20 μL):上下游引物(10 μmol/L)各0.3 μL, cDNA模板1 μL, Super Mix 10 μL, 灭菌的去离子水8.4 μL。RT-qPCR温度程序: 95℃预变性10 min; 变性95℃ 15 s, 61℃退火延伸1 min, 40个循环。以红棕象甲的Rfβ-actin为内参基因(Dawadietal., 2018),采用2-ΔΔCt方法进行相对表达量的计算。

表1 本研究所用引物Table 1 Primers used in this study
1.4 细菌注射感染后红棕象甲幼虫肠道和脂肪体中RfCTL-S1表达量的测定
为明确RfCTL-S1对细菌感染的响应特征,我们使用大肠杆菌E.coliDH5α和金黄色葡萄球菌Staphylococcusaureus分别注射感染(注射1 μL OD600=1.6的菌液)红棕象甲的4龄幼虫,注射PBS作为对照,然后在感染后的6,12和24 h解剖获取肠道和脂肪体两个组织并提取总RNA。每种处理设置3个生物学重复,每个重复含3头试虫。每个处理取1 μg总RNA反转成cDNA模板。引物序列见表1,RT-qPCR体系、试剂、反应程序和相对表达量的计算方法同1.3节。
1.5 红棕象甲RfCTL-S1的RNAi效果检测
基于实验室前期从红棕象甲转录组克隆获得的RfCTL-S1全长序列(GenBank登录号: MW538037)和dsEGFP,使用在线软件E-RNAi (https:∥www.dkfz.de/signaling/e-rnai3/idseq.php)设计并评估筛选最佳引物(表1),使用MEGAscript®RNAi试剂盒(ThermoFisher Scientific, 美国)合成靶向该基因和dsEGFP的dsRNA。用无菌水清洗4龄幼虫虫体,并将其放于冰上进行冷冻麻醉处理3 min,然后用10 μL Hamilton注射器(WPI Corp., 美国)给每头4龄幼虫从腹部的节间膜注射1.5 μL dsRNA(667 ng/μL),对照组试虫注射等量的dsEGFP作为参照。注射处理的试虫放回人工气候箱内进行饲养,48 h后解剖收集肠道和脂肪体并提取总RNA,利用表1中的特异性引物进行RT-qPCR检测基靶因的沉默效率和该基因沉默对4个抗菌肽基因表达的影响,总RNA提取方法、RT-qPCR反应体系和反应条件同1.3节。每个处理4个生物学重复,每个重复含3头试虫。
1.6 RfCTL-S1被RNAi后红棕象甲幼虫血淋巴对细菌的清除能力检测
根据Dawadi等(2018)的方法,注射dsRNA后的红棕象甲4龄幼虫先在1.1节正常饲养条件下饲养45 h后,然后注射2 μL EGFP标记的大肠杆菌菌液(OD600=2.0)于幼虫体腔内,在1.1节饲养条件下饲养3 h后在超净工作台中抽取血淋巴。每头幼虫抽取100 μL血淋巴置于含有3 μL α-苯基硫脲溶液(alpha-phenylthiourea, PTU) (5 mmol/L)的无菌EP管中,用无菌PBS进行梯度稀释1 000倍,随后取稀释液100 μL均匀涂布于含AMP的LB平板,LB平板倒置放于37℃的恒温培养箱中培养12 h,然后在Nikon ECLIPSE NI显微镜下统计每个平板上的细菌菌落数并拍照记录,分析RfCTL-S1沉默对红棕象甲血淋巴清除注射感染细菌能力的影响。每个处理4个生物学重复,每个重复含3头试虫。
1.7 RfCTL-S1被RNAi后红棕象甲幼虫肠道中可培养细菌菌落数量检测
解剖1.5节注射dsRNA 48 h后的试虫获取肠道,放入装有1 mL无菌PBS缓冲液的无菌2 mL匀浆器,将混合液稀释1 000倍,取出50 μL研磨均匀涂抹在牛肉膏胰蛋白胨营养琼脂(nutrient agar, NA)平板上,于37℃恒温培养箱过夜培养(整个实验操作过程在超净工作台中进行),12 h后对菌落数进行计数。每个处理至少设置4个生物学重复,每个重复含有健康的4龄幼虫3头。
1.8 数据分析
采用单因素方差分析(ANOVA)检测RfCTL-S1在不同组织中的表达量是否存在统计学差异、注射细菌感染对RfCTL-S1在试虫的肠道和脂肪体中表达量的影响以及RNAi对试虫肠道和脂肪体中抗菌肽基因的表达影响。采用t检验检测处理组和对照组间RNAi效率、RNAi对注射细菌血淋巴清除能力和RNAi对肠道细菌的清除能力的差异显著性。所有统计分析使用SPSS 21.0软件完成,然后使用SigmaPlot 12.0软件作图。
2 结果
2.1 RfCTL-S1的序列特征
RfCTL-S1(GenBank登录号: MW538037)的cDNA序列全长为728 bp,其开放阅读框(ORF)长513 bp,编码170个氨基酸。保守结构域预测分析发现,该多肽没有跨膜结构域,含有一个由16个氨基酸组成的信号肽和一个保守的CRD结构域。与波斯果蝇Drosophilapersimilis、海德氏果蝇D.hydei、暗纹果蝇D.obscura和纳沃果蝇D.navojoaCTLs的多重序列比对发现,RfCTL-S1和它们具有4个相同的半胱氨酸残基,可以形成两个二硫键,并且都含有EPN(Glu111-Pro112-Asn113)基序(图1),该基序可特异性识别结合甘露糖(Drickamer, 1992)。系统发育分析发现,RfCTL-S1与米象Sitophilusoryzae的CTL聚为一支(图2),而且都是只含有一个CRD结构域的CTL。上述结构特征说明RfCTL-S1可能作为一种分泌型的可特异识别甘露糖的单CRD结构域C-型凝集素参与调控红棕象甲的免疫应答。
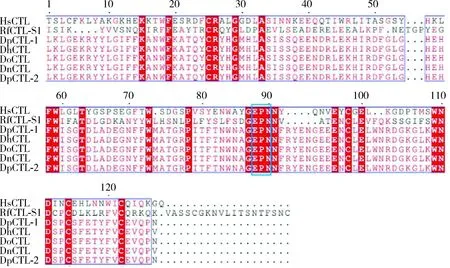
图1 红棕象甲RfCTL-S1氨基酸序列与其他昆虫CTLs的多重序列比对Fig. 1 Amino acid sequence alignment of RfCTL-S1 of Rhynchophorus ferrugineus with CTLs of other insectsCTLs的来源物种和GenBank登录号Origin species of CTLs and their GenBank accession numbers: HsCTL: 人Homo sapiens, EAW86204.1; DpCTL-1: 波斯果蝇Drosophila persimilis, XP_002026132; DhCTL: 海德氏果蝇Drosophila hydei, XP_023164840; DoCTL: 暗纹果蝇Drosophila obscura, XP_022226692; DnCTL: 纳沃果蝇Drosophila navojoa, XP_017957399; DpCTL-2: 波斯果蝇Drosophila persimilis, XP_026849736. 红色表示完全保守氨基酸残基;粉红色表示相对保守氨基酸残基;蓝色方框表示EPN基序。Identical and similar amino acid residues are shaded in red and pink, respectively. The EPN motif is highlighted in a blue box.
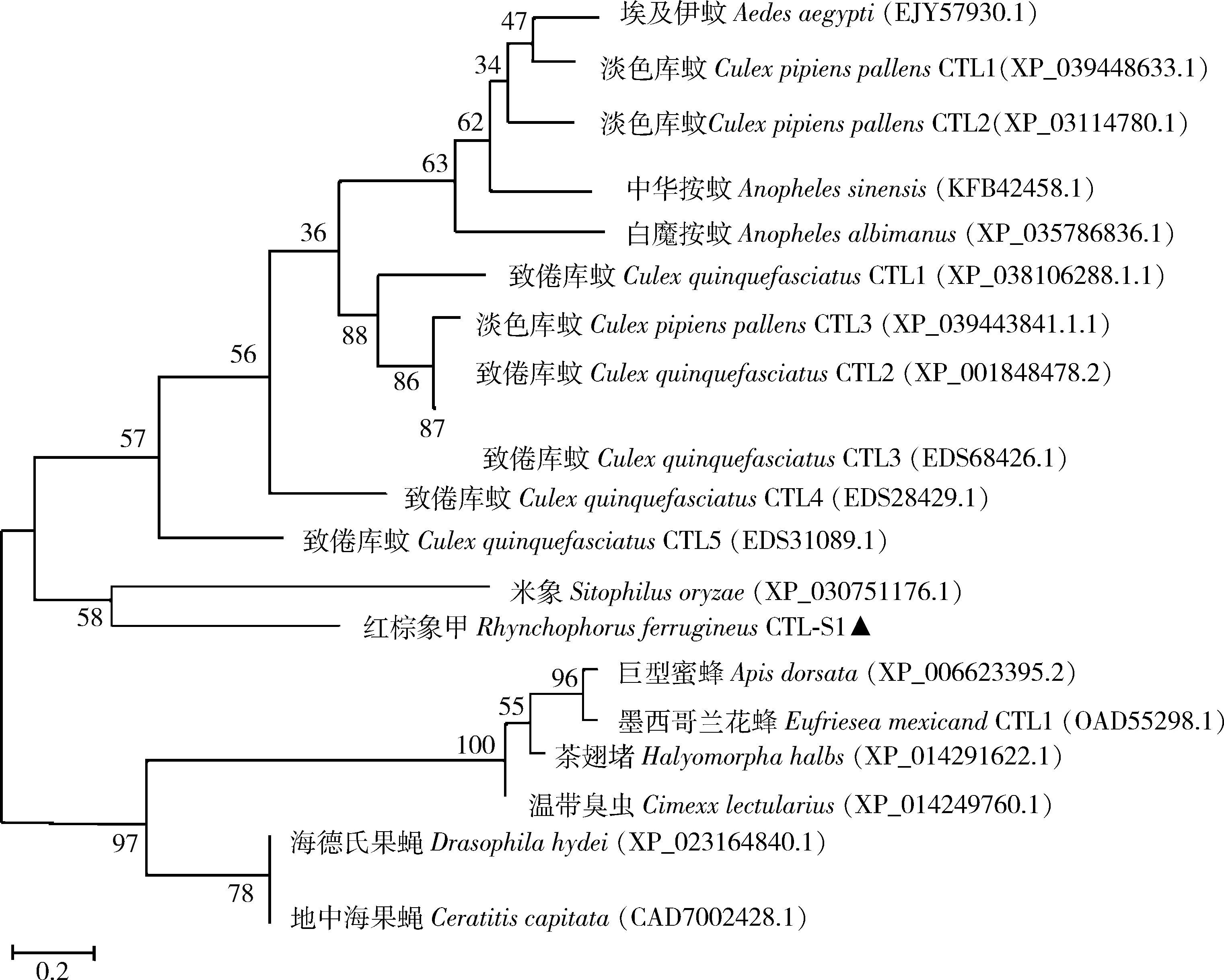
图2 基于氨基酸序列用最大似然法构建的红棕象甲RfCTL-S1与其他昆虫CTLs的系统发育树(1 000次重复)Fig. 2 Phylogenetic tree of RfCTL-S1 of Rhynchophorus ferrugineus and CTLs from other insect species based on amino acid sequences by maximum likelihood method (1 000 replicates)

图3 RfCTL-S1在红棕象甲4龄幼虫不同组织中的相对表达量Fig. 3 Relative expression levels of RfCTL-S1 indifferent tissues of the 4th instar larvae ofRhynchophorus ferrugineus图中数据为平均值±标准差;柱上不同字母表示不同组织间基因表达量差异显著(P<0.05, LSD)。Data in the figure are mean±SD. Different letters above each bar represent significant difference in the gene expression level among different tissues (P<0.05, LSD).
2.2 红棕象甲幼虫体内RfCTL-S1的组织表达谱
RT-qPCR检测发现,RfCTL-S1基因在红棕象甲4龄幼虫的头、体壁、前肠、中-后肠、脂肪体和血淋巴中均有表达,在血淋巴中的表达量显著高于在其他组织(P<0.05)(图3),说明RfCTL-S1这种C-型凝集素主要在血淋巴中表达产生,并可能参与介导红棕象甲体内相关的免疫反应。
2.3 细菌注射感染对红棕象甲幼虫脂肪体和肠道中RfCTL-S1的表达量的影响
注射感染大肠杆菌6, 12和24 h后,红棕象甲4龄幼虫脂肪体中RfCTL-S1的表达量与注射PBS的对照组相比有下调趋势,其中24 h时显著下调(F2,6=14.133,P<0.05)(图4: A);注射感染金黄色葡萄球菌6 h后,RfCTL-S1的表达量显著高于24 h(F2,6=8.461,P<0.05)(图4: A)。注射感染金黄色葡萄球菌12 h,红棕象甲4龄幼虫肠道中该基因的表达量显著高于注射后6和24 h(F2,6=6.561,P<0.05)(图4: B)。
2.4 RNAi干扰RfCTL-S1对红棕象甲幼虫脂肪体和肠道中抗菌肽基因表达的影响
注射dsRfCTL-S1 48 h后,红棕象甲4龄幼虫脂肪体和肠道中的RfCTL-S1表达量均显著低于注射dsEGFP的对照组(脂肪体:t6=4.804,P<0.05; 肠道:t6=2.671,P<0.05)(图5)。dsRfCTL-S1对脂肪体和肠道中该基因的干扰效率分别达到64.8%和74.4%,表明注射dsRfCTL-S1能够显著地降低该基因在试虫体内的表达水平。
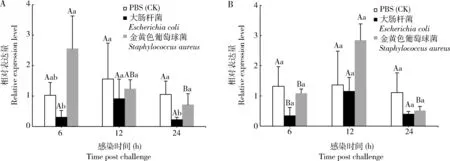
图4 注射感染细菌的红棕象甲4龄幼虫脂肪体(A)和肠道(B)中RfCTL-S1基因表达量的变化Fig. 4 Changes in the expression levels of RfCTL-S1 in the fat body (A) and gut (B) of the 4th instar larvaeof Rhynchophorus ferrugineus upon challenge with different bacterial species by injection图中数据为平均值±标准差;柱上不同大写字母和小写字母分别表示同一处理不同时间点间和同一时间点不同处理间基因表达量的差异显著(P<0.05, LSD)。Data in the figure are presented as mean±SD. Different capital and lowercase letters above bars represent significant difference in the gene expression level between different time points in the same treatment and across the different treatments at the same time point, respectively (P<0.05, LSD).
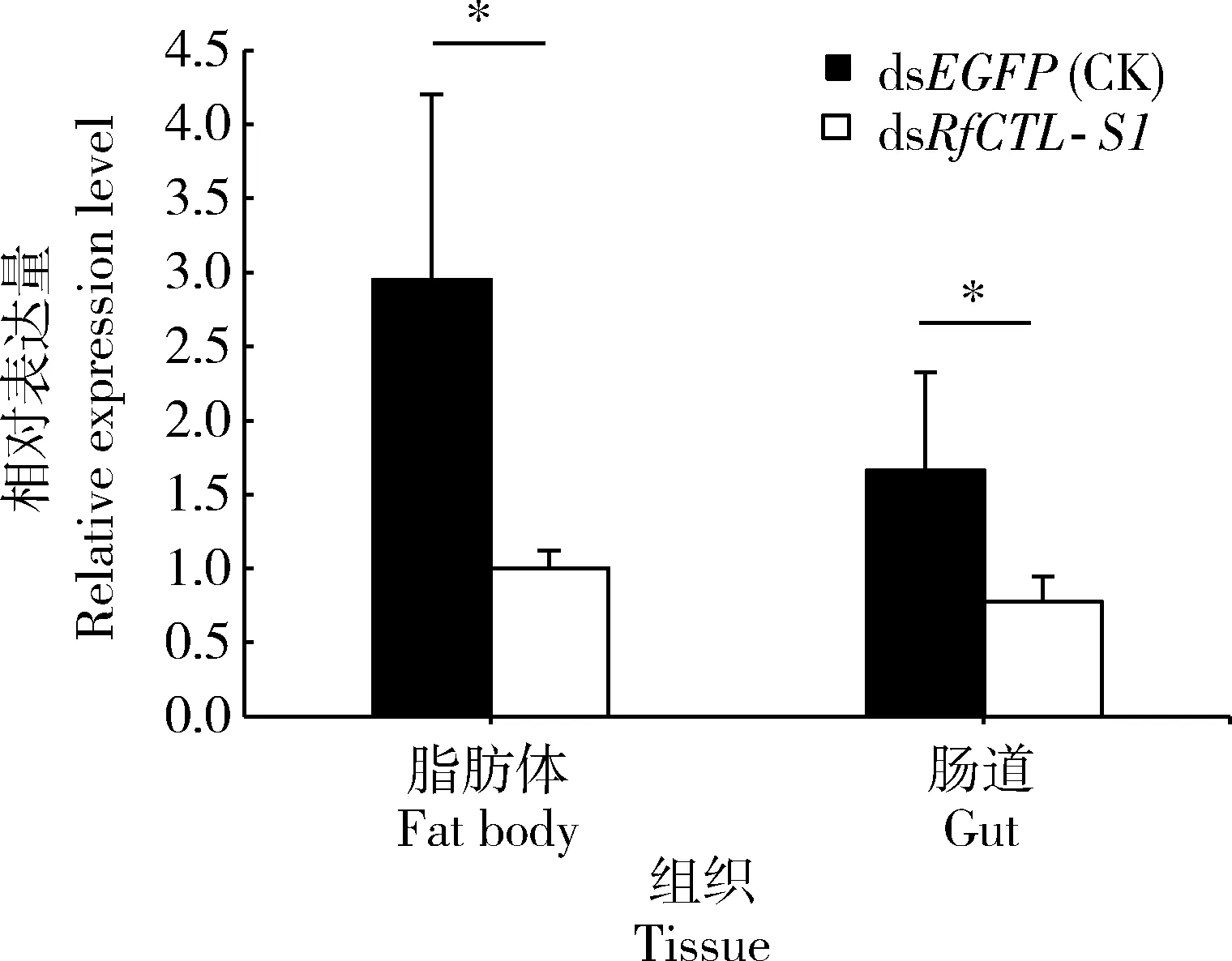
图5 dsRfCTL-S1对红棕象甲4龄幼虫脂肪体和肠道中RfCTL-S1的RNAi效率Fig. 5 RNAi efficiency of dsRfCTL-S1 to RfCTL-S1in the fat body and gut of the 4th instar larvaeof Rhynchophorus ferrugineus图中数据为平均值±标准差;柱上星号表示两组之间有显著性差异(P<0.05, t检验). Data in the figure are presented as mean±SD. Asterisk above bars indicates significant difference between the two groups (P<0.05, t-test).
干扰RfCTL-S1基因48 h后,红棕象甲4龄幼虫脂肪体中的抗菌肽基因RfColeoptericin,RfDefensin和RfCecropin的相对表达量均显著低于对照组(RfColeoptericin:t6=6.943,P<0.05;RfDefensin:t6=2.465,P<0.05;RfCecropin:t6=4.007,P<0.05),而抗菌肽基因RfAttacin的表达量则没有显著变化(t6=-1.113,P>0.05)(图6: A)。上述数据表明干扰RfCTL-S1能够显著降低红棕象甲幼虫脂肪体中的RfColeoptericin,RfDefensin和RfCecropin3种抗菌肽基因的表达,进而致使其血淋巴中的免疫反应活性降低。在幼虫肠道中,与对照组相比,4种抗菌肽基因RfAttacin,RfColeoptericin,RfDefensin和RfCecropin的表达量都没有显著变化(RfAttacin:t6=1.779,P>0.05;RfColeoptericin:t6=1.537,P>0.05;RfDefensin:t6=0.033,P>0.05;RfCecropin:t6=0.930,P>0.05)(图6: B),这说明RfCTL-S1在红棕象甲的肠道免疫调控中没有明显作用。
2.5 RNAi干扰RfCTL-S1对红棕象甲幼虫血淋巴清除感染大肠杆菌能力的影响
RNAi干扰RfCTL-S1后,红棕象甲4龄幼虫血淋巴中EGFP标记的大肠杆菌菌落数(CFU)为32 792.50±3 536.31,而对照组幼虫血淋巴中被标记的大肠杆菌CFU为19 057.50±8760.82,前者的数量显著高于后者(t6=-2.908,P<0.05)(图7: A),表明RfCTL-S1的沉默显著降低了血淋巴对细菌的清除能力。
2.6 RNAi干扰RfCTL-S1对红棕象甲幼虫肠道中可培养细菌菌落数量的影响
干扰RfCTL-S1基因48 h后,棕象甲幼虫肠道中的可培养细菌菌落数(CFU)为383 889.00±33 217.00个,对照组试虫肠道中分离获得的可培养细菌菌落数(CFU)为356 667.00±34 805.00个,两组不存在显著性差异(t6=-0.980,P=0.383)(图7: B),这暗示该基因编码的凝集素RfCTL-S1可能在该害虫肠道免疫的调控中没有扮演重要角色。
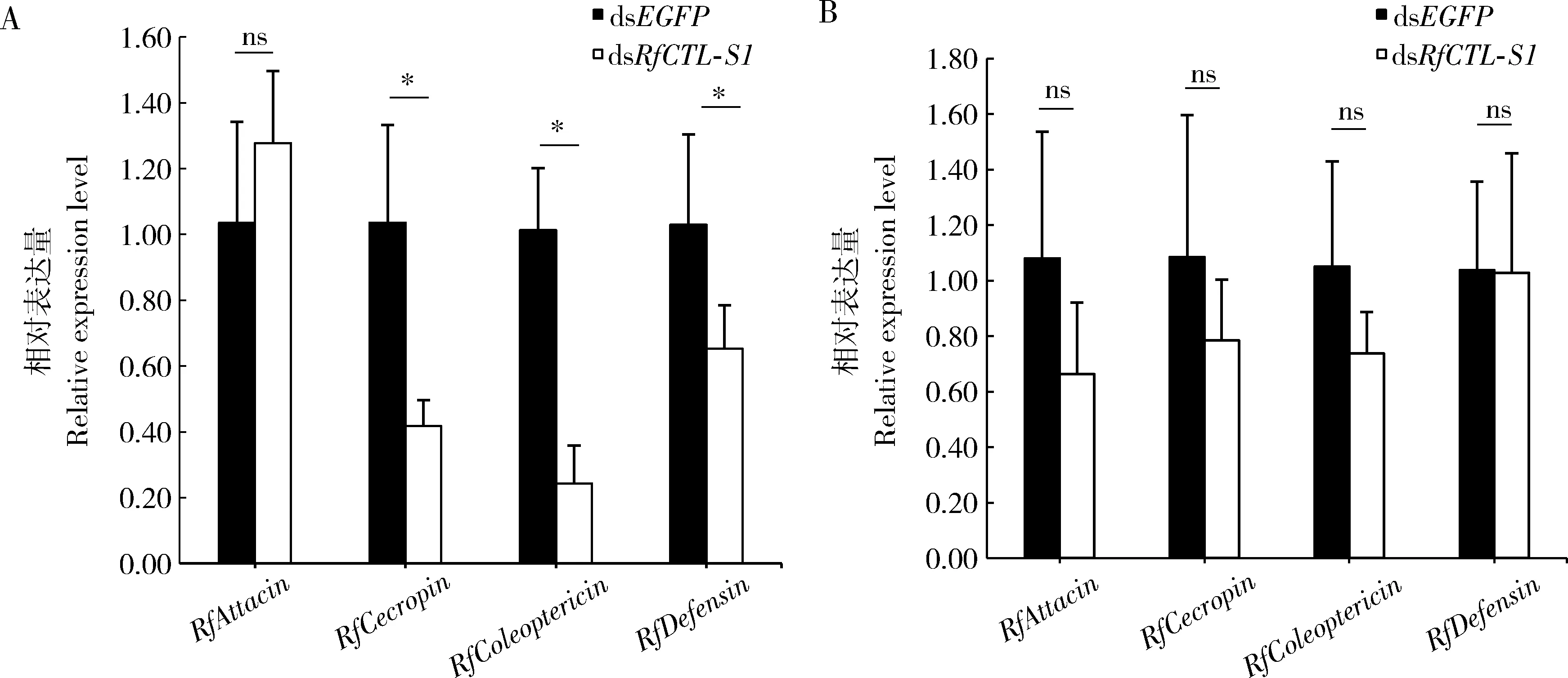
图6 RNAi干扰48 h RfCTL-S1对红棕象甲4龄幼虫脂肪体(A)和肠道(B)中4种抗菌肽基因表达量的影响Fig. 6 Effect of RNAi of RfCTL-S1 for 48 h on the expression levels of four antimicrobial peptide genesin the fat body (A) and gut (B) of the 4th instar larvae of Rhynchophorus ferrugineus图中数据为平均值±标准差;柱上星号和ns分别表示处理组与对照组(dsEGFP注射组)之间有显著性差异(P<0.05)和无显著性差异(P>0.05)(t检验)。图7同。Data in the figure are presented as mean±SD. Asterisk and ns above bars indicate significant difference (P<0.05) and no significant difference (P>0.05), respectively, between the treatment group and the control group (dsEGFP injection group) (t-test). The same for Fig. 7.
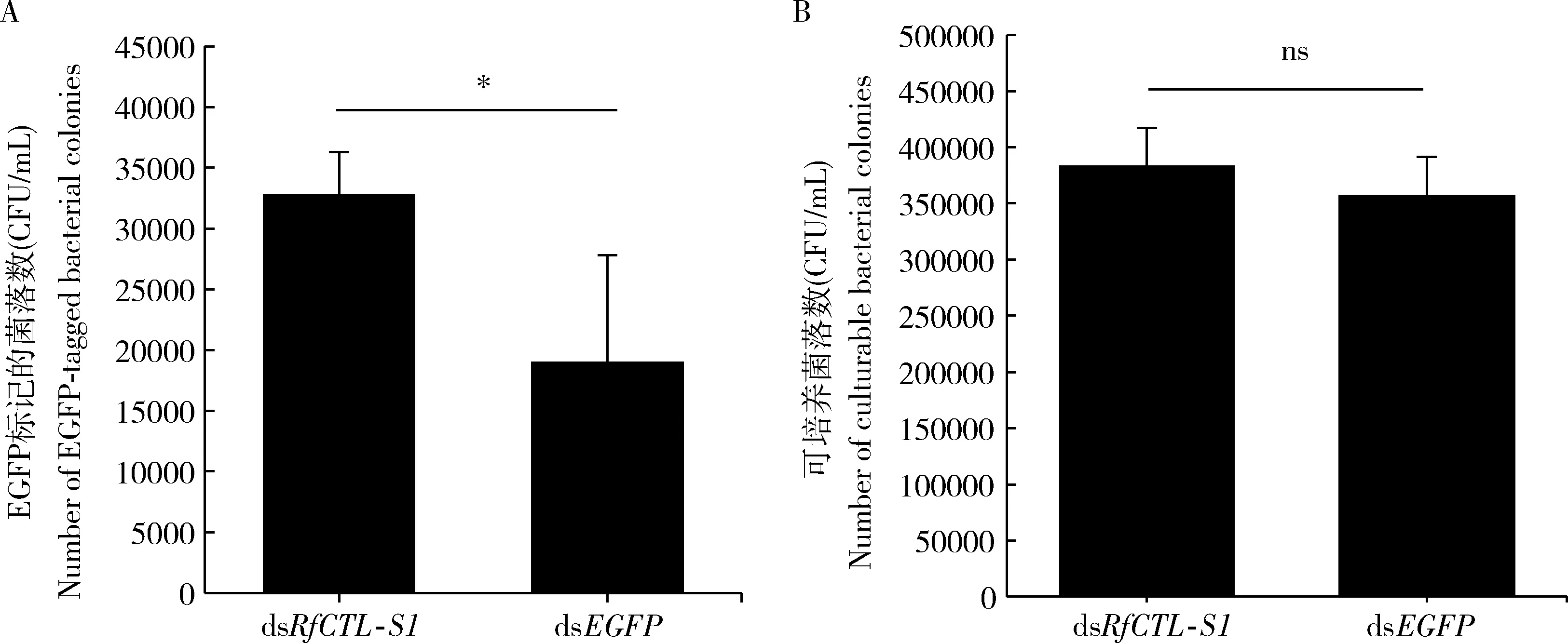
图7 RNAi干扰48 h RfCTL-S1对红棕象甲4龄幼虫血淋巴中EGFP标记的大肠杆菌菌落数(A)和肠道中可培养细菌菌落数(B)的影响Fig. 7 Effect of RNAi of RfCTL-S1 for 48 h on the number of EGFP-tagged Escherichia coli colonies in the hemolymph (A) andthe number of cultivable bacterial colonies in the gut (B) of the 4th instar larvae of Rhynchophorus ferrugineus
3 讨论
在本研究中,我们发现红棕象甲RfCTL-S1编码的多肽具有一个信号肽和CRD功能结构域(图1),但是没有跨膜结构域,表明RfCTL-S1编码的多肽是一种分泌型C-型凝集素。已有研究发现,昆虫C-型凝集素的CRD中存在两种基序——EPN和QPD(Huangetal., 2015),这些基序可以通过氢键与病原微生物表面的糖配体结合(Zhangetal., 2009; Brownetal., 2018)。例如,EPN基序中的Glu和Asn通过与甘露糖上的3-OH和4-OH形成氢键决定CRD与该糖的结合特异性(Drickamer, 1992; Weietal., 2012)。在本研究中,我们发现RfCTL-S1编码的多肽中含有EPN基序,这暗示RfCTL-S1可能特异性地结合细菌表面的甘露糖,从而介导调控该害虫对相关病原微生物的免疫反应。
在昆虫体内,血淋巴中含有丰富的血细胞,是系统性免疫反应发生的重要场所,在昆虫抵抗病原体入侵的过程中发挥至关重要的作用(Holmskovetal., 2003)。组织表达谱分析发现,RfCTL-S1基因在红棕象甲血淋巴中的表达丰度最高(图3),这暗示这种凝集素主要由红棕象甲的血细胞合成分泌。而且已有研究证实,家蚕的BmLBP和BmCTL-S3以及赤拟谷盗Triboliumcastaneum的CTL3和CTL6等多种CTLs都是作为分泌型PRR存在于血淋巴中参与调控它们的免疫过程(Zhanetal., 2016; Lietal., 2021)。因此,该结果暗示RfCTL-S1可能是作为一种分泌型PRR参与介导调控红棕象甲的系统性免疫反应。
对入侵病原体的免疫识别是昆虫先天免疫中最关键的第一步。大量证据表明,C-型凝集素能够快速识别并结合病原体表面的糖类物质(Brownetal., 2018)。在本研究中,我们发现RfCTL-S1含有EPN基序,而该基序已被证实能特异性结合甘露糖(Drickamer, 1992),而且具有EPN基序的C-型凝集素也具有具有结合脂多糖(lipopolysaccharide, LPS)和肽聚糖(peptidoglycan, PGN)等多种不同糖类的能力(Brownetal., 2018)。本研究利用革兰氏阳性细菌金黄色葡萄球菌和革兰氏阴性细菌大肠杆菌分别注射感染红棕象甲幼虫探究RfCTL-S1的响应模式。结果表明,在脂肪体中RfCTL-S1对金黄色葡萄球菌和大肠杆菌注射感染分别表现为上调和下调,并且该基因对革兰氏阳性细菌金黄色葡萄球菌的响应比肠道中更为迅速(图4: A)。以上结果表明红棕象甲RfCTL-S1可能参与介导该害虫对这两种细菌感染的免疫反应。注射大肠杆菌后,红棕象甲幼虫中的RfCTL-S1表达量下调(图4),这与注射副溶血性弧菌Vibrioparahaemolyticus感染罗氏沼虾Macrobrachiumrosenbergii导致其体内的EsCTL1和EsCTL2表达量降低的情况(Huangetal., 2015)类似,说明RfCTL-S1可能是一种调理素(opsonin),感染细菌诱导红棕象甲幼虫体内的RfCTL-S1下调表达来延缓寄主免疫系统对其的攻击(Eddie Ipetal., 2009)。然而,注射金黄色葡萄球菌后,该基因上调表达,这与赤拟谷盗TcCTL5结果一致,说明RfCTL-S1可能与TcCTL5具有相似的功能,可以作为一种PRR识别感染细菌激活该虫的免疫进而诱导抗菌肽的表达(Lietal., 2021)。因此,这些数据说明RfCTL-S1可以响应金黄色葡萄球菌和大肠杆菌的感染,而且可能以不同的角色响应不同种类细菌的感染。两种不同细菌感染引起的RfCTL-S1不同表达模式是否与革兰氏阴性和革兰氏阳性细菌细胞壁种甘露糖的含量差异有关?该问题值得待进一步探究。
RfCTL-S1被沉默后,红棕象甲幼虫的血淋巴清除EGFP标记大肠杆菌的能力被显著地抑制(图7: A)。CTL作为一种PRR,它可以通过调控AMPs的表达来介导昆虫的先天免疫反应(毕京秀, 2020)。而且已有证据表明,昆虫AMPs对细菌、真菌和病毒都具明显的抑制活性(张明明等, 2012)。本文研究发现,当RfCTL-S1被沉默后,脂肪体中的RfCecropin,RfColeoptericin和RfDefensin3种抗菌肽基因的表达量都显著低于对照组(图6: A),说明RfCTL-S1参与激活脂肪体中上述3个AMP基因的表达。而RfCTL-S1的沉默对肠道中可培养细菌的菌落数(图7: B)和肠道中AMPs表达丰度(图6: B)均无显著影响,说明红棕象甲RfCTL-S1可能主要在其系统性免疫反应中发挥重要作用。
综上所述,红棕象甲RfCTL-S1是一种具有信号肽和一个含EPN基序CRD的C-型凝集素,而且该多肽的编码基因主要在血细胞中表达。革兰氏阳性细菌金黄色葡萄球菌的感染能显著诱导RfCTL-S1在脂肪体中的表达。RfCTL-S1的沉默导致脂肪体中抗菌肽RfColeoptericin,RfDefensin和RfCecropin的表达丰度显著下降,进而造成该害虫血淋巴清除感染细菌能力的下降。但是RfCTL-S1的沉默对肠道中的可培养细菌菌落数和抗菌肽基因的表达均无影响。因此,这些结果表明RfCTL-S1是一种分泌型免疫识别受体,可以通过介导抗菌肽基因的表达参与调控红棕象甲的系统免疫反应。然而,RfCTL-S1调控抗菌肽产生的分子机制还不清楚,还有待进一步解析。
