氢化铈的制备及其与高氯酸铵的反应特性
2021-12-23赵修臣关紫阳熊杰白猛王晓强李明亚
赵修臣,关紫阳,熊杰,白猛,王晓强,李明亚
(1.北京理工大学 材料学院,北京100081;2.东北大学秦皇岛分校,河北秦皇岛066004;3.河北省电介质与电解质功能材料重点实验室,河北 秦皇岛 066004)
氢化铈属于具有较高反应活性和高化学潜能的稀土金属氢化物,其与空气接触会迅速发生氧化还原反应,并释放大量的热能,产生良好的燃烧效果[1]。氢化铈的能量约为217.6 J·g-1,是HMX(5.53 J·g-1)能量的40倍[2]。将氢化铈应用到活性材料中,能够提高活性材料的燃烧热能,可以作为较好的含能材料爆炸过程中高能添加剂[2]。
高氯酸铵(AP)[3, 4]是含能材料中常见的高能氧化剂,由于其具备较高的有效含氧量、高的气体生成量、合适的密度、低的机械敏感度、良好的相容性以及价格低廉等特点而备受研究者的青睐。张卫山[2]对氢化铈与高氯酸铵复合材料的配比进行了研究,实现能量释放最大化,并且能够显著降低AP的热分解温度。
目前,针对稀土金属氢化物在活性材料中的应用的相关研究还较少,大部分的工作都处于探索阶段,包括活性材料的配方体系、反应特性等。该研究用金属铈直接氢化法制备氢化铈,并对其结构与形貌进行表征;研究了氢化铈与AP复合活性材料的反应特性,初步探讨了其反应机理。
1实验
采用金属铈直接氢化法制备氢化铈。将金属铈块(99.9%,包头镧系新材料科技有限公司)置于氢化反应系统中,氢化气体采用Ar/H2(50vol%/50vol%)混合气,总气压为0.22 MPa,在氢化温度为390 ℃下,保温2 h,然后升温至565 ℃,保温1 h,最后降温至100 ℃,保温2 h,升温速率为5 ℃/min。
纯的氢化铈粉末在空气中能迅速自燃,并释放大量的热能,其与水接触时反应剧烈,甚至会产生爆炸[5]。因此,需要对氢化铈进行安定性处理。本实验采用硬脂酸(SA)对氢化铈表面进行包覆,通过SUPRA 55型扫描电子显微镜(scanning electron microscope,SEM)对包覆后的氢化铈粉末表面形貌进行观察。
根据氧平衡理论,将包覆后的氢化铈与AP进行配比,制备出复合活性材料。利用Q2000型差式扫描量热仪(differential scanning calorimeter,DSC)分析AP的热分解行为以及复合活性材料的反应温度和反应放热性能(测试条件为25~500 ℃、升温速率2 ℃/min,高纯氩测试气氛,气体流速50 ml/min)。采用7300型热重分析仪(thermogravimetric analyzer,TG)与LC-D200M PRO型质谱仪(mass spectrometer,MS)联用的方法对复合活性材料的反应气体产物进行检测(测试温度范围为50~600 ℃,升温速率为10 ℃/min,保护气为氩气;TG与MS之间使用微米级的毛细管相连接,TG中产生的气体产物在120 ℃下保温,通过毛细管进入MS进行检测)。
2结果与讨论
2.1 氢化产物的表征
通过X射线衍射(X-ray diffraction,XRD)对氢化铈粉末进行分析。图1为所制备氢化铈粉末的XRD谱。从图1中可以看出,所制备样品的衍射峰位分别处于27.922°、32.351°、46.404°、55.029°、57.700°、67.720°、74.768°、77.060°,与CeH2.73(卡片号JPDF#32-0191)标准衍射峰位完全吻合,这些峰位分别对应(111)、(200)、(220)、(311)、(222)、(400)、(331)、(420)晶面,这说明所制备的样品为面心立方结构的CeH2.73。
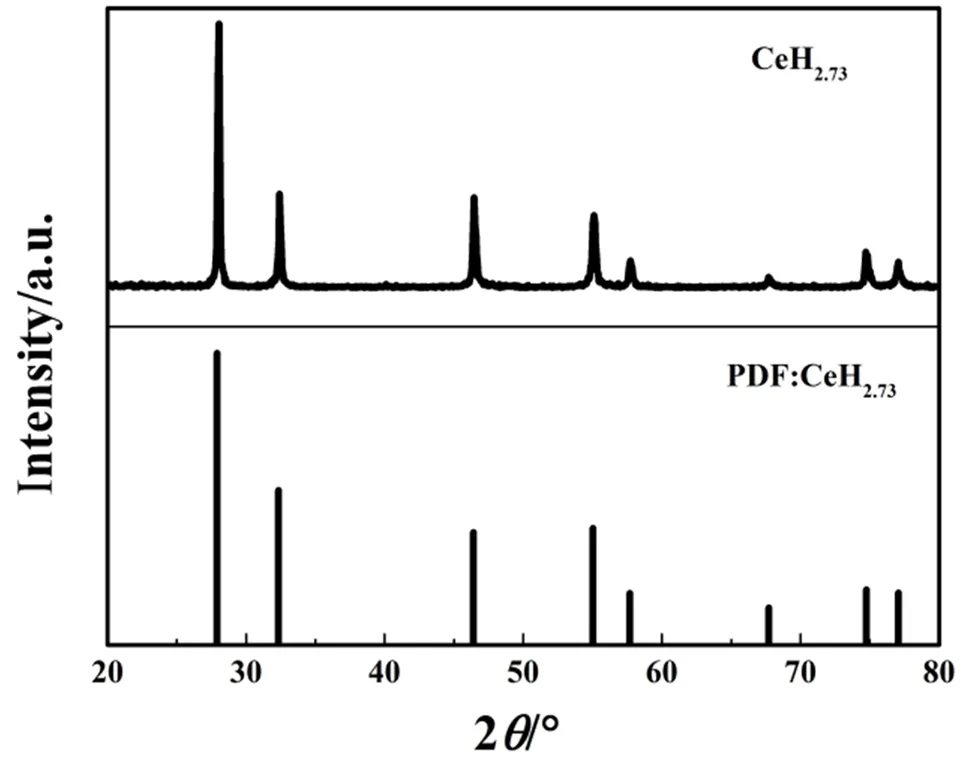
图1 氢化铈粉末的XRD谱
图2为CeH2.73粉末表面包覆处理前后的SEM图像。从图2中可以看出,未进行SA包覆处理的氢化铈粉末呈现出层片状结构,而经过SA包覆处理的氢化铈粉末表面明显呈现出一层完整的、油腻质感的包覆膜,具有较高的致密度,且未出现明显的孔洞和裂纹。因此,这种完整包覆膜的存在有利于提高氢化铈在空气中的稳定性,是氢化铈得到实际应用的前提。

图2 CeH2.73粉末表面包覆处理前后的SEM图像
2.2 复合活性材料反应特性
2.2.1复合活性材料的氧平衡计算
复合活性材料的氧平衡是指活性材料体系中各成分中的可燃元素完全氧化后所多于或不足的含氧量。根据氧平衡的正负值可以分为负氧平衡、零氧平衡和正氧平衡3种。
对于某一种活性材料而言,其氧平衡[6]的计算通式为:
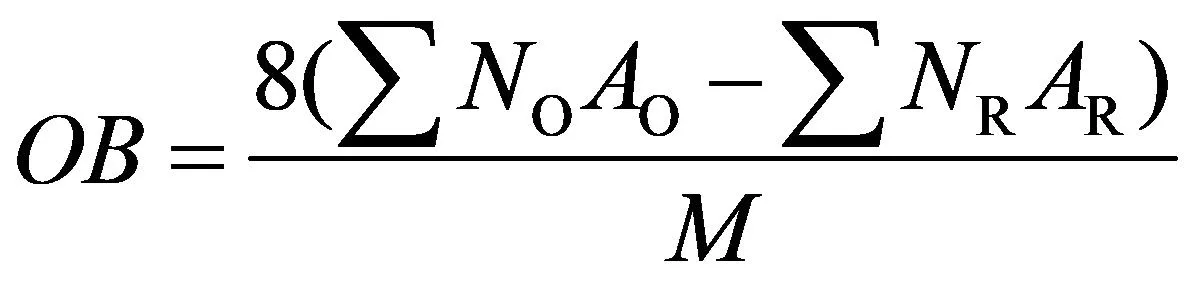
(1)
式中:OB—活性材料的氧平衡数值;
noAo—活性材料反应过程中被还原的元素的原子数与其化合价之积;
nRAR—活性材料反应过程中被氧化的元素的原子数与其化合价之积;
M—活性材料的相对分子质量。
而对于一个混合体系来说,其氧平衡数值的计算通式为:

(2)
式中:OB—混合体系的氧平衡数值;
OBi—混合体系中第i组分的氧平衡数值;
xi—混合体系中第i组分的质量百分数。
根据上述氧平衡计算公式(1)、(2)计算配比,分别配制OB= 5%、0%、-5%、-10% 的复合活性材料(对应的氢化铈与AP的质量比分别为43.15:56.85,50.52:49.48,57.95:42.05和65.38:34.62),采用机械搅拌的方法制备氢化铈与AP的复合活性材料,将所配制的粉末充分混合均匀,获得不同氧平衡的复合活性材料。
2.2.2不同氧平衡的复合活性材料的反应温度及反应热值
图3为纯AP的DSC测试曲线。从图4中可以看出,在AP的整个热分解过程中,随温度的升高,AP热分解过程将经历一个吸热阶段和2个放热阶段,结合相关文献[7-9]分析,在温度为 240~260 ℃的范围内,AP 会发生晶型转变,由常温下的斜方晶型转变为高温下出现的立方晶型,这一转变过程是一个伴随着吸热的可逆的相变过程;在温度为 280~350 ℃的范围内,AP 开始进行以固相反应为主,气相反应为辅的低温分解,此阶段中部分AP 粒子已经发生分解并释放一定量的气体,该过程是一个固体升华并伴随着分解的放热过程[10];当温度在400~450 ℃的范围内,AP 开始进行以气相反应为主,固相反应为辅的高温分解,此阶段中剩余的AP 粒子继续分解并释放气体,且气体之间会进一步发生氧化还原反应,释放大量的热量,直到完全分解。

图3 纯AP的DSC测试曲线

图4 不同氧平衡的复合材料的DSC测试曲线
图4为不同氧平衡的复合材料的DSC测试曲线。从图4中可以看出,结合纯AP的热分解过程,复合材料反应过程中AP的晶型转变温度几乎没有变化,而AP的低温和高温分解行为却发生明显改变:放热峰峰强明显增强,所处温度明显降低,其中高温分解峰温降低尤其明显。表1为不同氧平衡的复合活性材料反应的DSC结果,结合图4和表1,可以发现,随着复合材料的氧平衡数值的降低,其DSC测量的表观反应热值先增加后减小,当氧平衡为零(OB=0%)时,复合材料的表观反应热值最大,AP的低温分解峰温降低了22 ℃,而高温分解峰温降低了90 ℃,同时复合活性材料恰好完全反应,具有最佳的反应放热性能,其反应热值为3 630 J·g-1。

表1 不同氧平衡的复合材料反应的 DSC 结果
2.3 氢化铈与AP的反应机理分析
为了进一步研究氢化铈与AP的反应机理,本实验对放热性能最佳的OB=0%的复合材料的反应产物进行检测,测试结果如图5和图6所示,其中图5(a)为零氧平衡的复合材料的TG-DTA曲线,图5(b)为零氧平衡的复合材料反应过程中同步检测的挥发性成分的MS检测信号,图6为零氧平衡的复合材料反应完成后固体产物的XRD谱。
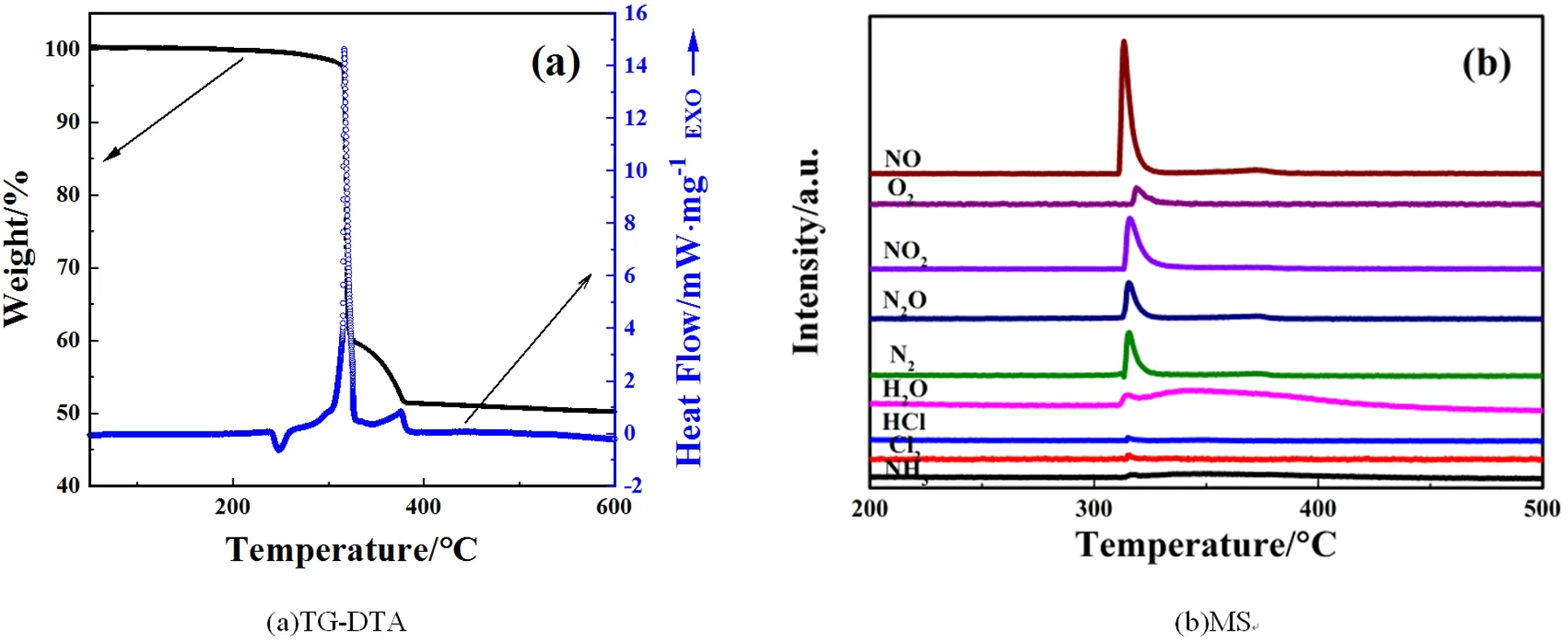
图5 OB=0%的复合活性材料的TG-MS检测结果

图6 OB=0%的复合活性材料的固体产物的XRD谱
“质子转移理论”[11, 12]认为,纯AP的热分解反应分为2个阶段,即低温分解阶段和高温分解阶段。在AP的低温分解阶段,其晶体表面存在质子从NH4+转移到ClO4-从而形成NH3和HClO4的解离过程,是一个固气相混合反应过程,所形成的NH3分子会吸附于剩余的AP固体表面,而HClO4的降解产物难以完全氧化吸附的NH3,所以未被氧化的NH3会在AP表面越积越多,最终完全掩盖AP表面的活化中心从而致使分解反应终止。
在高温分解阶段,吸附的NH3在高温条件下会发生解吸,NH3和HClO4会渐渐气化,并且HClO4会进一步在气相中发生降解,生成的具有氧化性的中间产物能够完全氧化气态NH3,而没有NH3的阻碍,AP能持续不断地进行分解。随着反应持续剧烈地进行,放热量越来越大,反应的复杂程度也在不断加剧,最终纯AP的热分解获得的气体产物有H2O、NH3、NO、Cl2、O2、N2O、NO2和HCl。
结合纯AP的热分解过程来分析该测试结果,从图5(a)中可以发现,复合材料中AP颗粒经过晶型转变的吸热过程后,在310 ℃左右的较低温度阶段进行了大量分解,且在375 ℃左右的较高温度阶段又出现了少量的分解放热。从图5(b)中可以看出,当反应温度达到310 ℃左右时,复合材料发生反应,并产生NH3、Cl2、HCl、H2O、N2、N2O、NO2、O2、NO气体,气体检测信号峰尖且窄,说明复合材料反应极其迅速,其中如H2O、NO、N2O等部分气体检测信号曲线在较高温度处出现较弱的峰,这一点与图5(a)中TG-DTA曲线十分吻合。另外,从图6中可以发现,复合材料反应后固体产物主要为CeO2和少量的CeCl3。
由于氢化铈具有很强的还原性,并且在加热条件下,氢化铈会持续而缓慢地释放氢气,在氢化铈和氢气的参与下,AP的热分解反应变得更为复杂且迅速。与纯AP的热分解产物相比,复合材料的反应产物中还检测出了N2、CeO2和CeCl3,所以推测氢化铈(为了便于计算反应方程式,公式中的氢化铈均以CeH3表示)和氢气可能参与的反应有:

(3)
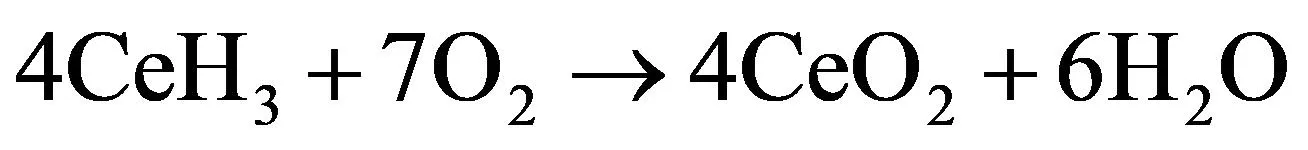
(4)

(5)
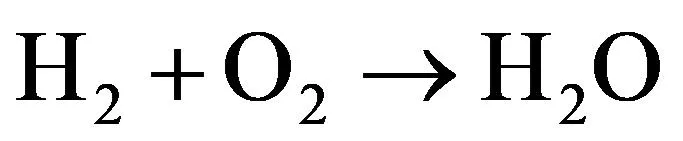
(6)
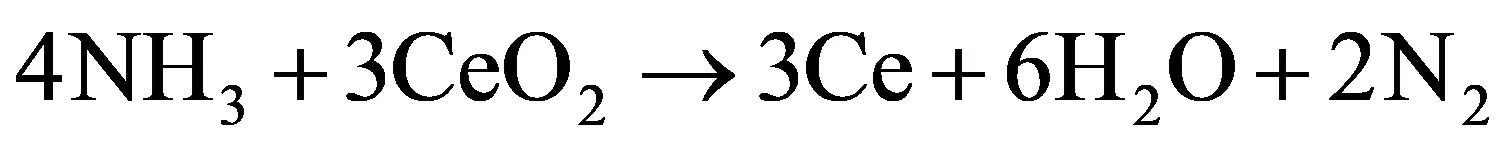
(7)

(8)
这表明,一方面,氢化铈及其分解产物使得AP分解产物浓度降低,促进了AP的高温分解反应的正向进行。另一方面,氢化铈及其分解产物与AP分解的氧化性产物之间发生氧化还原反应,并释放大量的热量,因此大大加快了AP的热分解速率,同时降低了其热分解温度。
3结论
(1)所制备氢化铈为面心立方结构的CeH2.73。安定性处理后,氢化铈表面形成一层完整的、油腻质感的包覆膜,显著提高了其在空气中的稳定性。
(2)不同氧平衡的复合活性材料的反应放热性能有所差异。AP的低温分解温度和高温分解温度均有所降低,当氧平衡为0(OB=0%)时,复合材料的表观反应热值最大,其反应热值为3 630 J·g-1。
(3)复合活性材料的反应过程较为复杂,除了纯AP的热分解产物之外,复合材料的反应产物中还检测出了N2、CeO2和CeCl3。同时,氧化还原反应提供的热量显著降低了AP的热分解温度,并提高了AP的分解速率。
