四逆汤对慢性肾功能衰竭大鼠尿酸水平及p38 MAPK/ERK1/2信号通路的影响
2021-12-23田芳王鹏孙萍魏玉翠李浩仇方忻
田芳,王鹏,孙萍,魏玉翠,李浩,仇方忻
慢性肾功能衰竭(chronic renal failure,CRF)是多种慢性肾脏疾病的常见结局,已成为我国重要的公共卫生问题[1]。CRF的特征是肾小球滤过率降低和肾功能障碍,导致代谢紊乱和相关临床症状[2]。然而,目前还没有任何有效的治疗方法来延缓或治疗慢性肾功能衰竭。因此,研发成功的治疗策略具有重要的临床意义[3]。中医药在治疗慢性肾功能衰竭方面越来越受临床的重视[4-5]。四逆汤源自张仲景的《伤寒论》[6]。叶文冲等[7]研究发现,四逆汤可改善膜性肾病大鼠的肾小球和毛细血管结构,发挥明显治疗作用。p38丝裂原活化蛋白激酶(mitogen-activated protein kinase,p38 MAPK)/细胞外信号调节激酶1/2(extracellular signal-regulated kinase,ERK1/2)通路直接参与肾脏的形成,调节肾源性间充质的维持和分化[8]。目前,关于四逆汤治疗CRF的文献罕见报道,因此现构建CRF大鼠模型,探究四逆汤对CRF大鼠的干预作用,并分析其对p38 MAPK/ERK1/2通路的影响,报道如下。
1 材料与方法
1.1 材料 (1)动物:雄性SPF级SD大鼠,10周龄,体质量200~220 g,购自山东省实验动物中心,动物生产许可证号:SCXK(鲁)2019-0021,动物使用许可证号:SYXK(鲁)2019-0029,大鼠自由饮水进食,本实验经山东第一医科大学附属青岛医院伦理委员会批准(批号:伦审字2020103号),并遵守3R保护原则进行实验。(2)药物试剂:四逆汤(西安利君制药有限责任公司);氯沙坦钾片(杭州默沙东制药有限公司);尿素氮(BUN)、血肌酐(SCr)、尿酸(UA)测定试剂盒(南京建成生物工程研究所);白介素-6(IL-6)、IL-1β、肿瘤坏死因子-α(TNF-α)酶联免疫吸附(ELISA)试剂盒、苏木素—伊红(HE)染色试剂盒、TUNEL检测试剂盒(上海碧云天生物科技有限公司);p38 MAPK一抗、磷酸化p38 MAPK(p-p38 MAPK)一抗、ERK1/2一抗、磷酸化ERK1/2(p-ERK1/2)一抗、β-肌动蛋白(β-actin)一抗及兔抗鼠二抗(美国Cell Signaling Technology公司)。(3)仪器设备:RM2035型轮转切片机(德国Leica公司),SMZ745型光学显微镜(日本尼康公司),Elx800型酶标仪、1658033型蛋白垂直电泳转印系统(美国Bio-Rad公司),GelSMART型凝胶成像仪(北京大龙兴创实验仪器有限公司)。
1.2 实验方法 2020年10月—2021年1月于山东第一医科大学附属青岛医院动物实验室进行实验,按照文献[9]方法,对大鼠饲喂含0.75%腺嘌呤的饲料,连续饲养4周后,检测到血清BUN和SCr水平明显升高,表明CRF大鼠模型建立成功,成功造模60只大鼠。将CRF大鼠按随机数字表法分成模型组、氯沙坦组(给予氯沙坦钾片9 mg/kg,与蒸馏水配成浓度0.9 mg/ml的混悬液灌胃)[10]及四逆汤低、中、高剂量组(2.79、5.58、11.16 g/kg灌胃)[11],每组12只;另取健康大鼠12只设为对照组,所喂养饲料除未添加腺嘌呤外,所有成分均相同。对照组和模型组大鼠灌胃等体积蒸馏水;6组大鼠灌胃液体体积均为10 ml/kg,每日1次,连续4周。
1.3 观察指标与方法
1.3.1 样本采集及肾脏指数测定:大鼠末次给药24 h后予以麻醉,主动脉取血,离心分离血清,-80℃下保存待测;采血后称大鼠体质量,解剖肾脏并称质量,计算肾脏指数=肾脏质量/大鼠体质量。左肾固定于4%甲醛溶液中,进行组织病理学检测;右肾液氮速冻,-80℃下保存,用于检测蛋白表达情况。
1.3.2 血清BUN、SCr、UA检测:取上述血清,根据试剂盒说明书检测大鼠血清BUN、SCr、UA水平。
1.3.3 血清炎性因子检测:取上述血清,根据ELISA试剂盒说明书检测大鼠血清IL-6、IL-1β、TNF-α水平。
1.3.4 肾组织病理学观察:取出固定在甲醛中左肾组织,脱水透明,石蜡包埋,切片厚度3 μm,HE染色,于光学显微镜下观察病理学变化。
1.3.5 肾组织细胞凋亡检测:取石蜡切片,脱蜡,蛋白酶消化20 min后清洗,加入TUNEL反应混合液,于37℃下封闭30 min,加底物显色,苏木素复染、脱水、封片。每个实验组分别随机选取5张切片,每张切片选择5个具有代表性的高倍视野(×400),计算TUNEL染色的阳性细胞数,凋亡指数=凋亡细胞数/细胞总数×100%。
1.3.6 肾脏组织蛋白表达测定:取出-80℃中保存的肾组织,液氮研磨,加入裂解液匀浆化,提取总蛋白,BCA法检测蛋白含量,电泳分离蛋白,转膜封闭加一抗(p38 MAPK、p-p38 MAPK、ERK1/2、p-ERK1/2、β-actin,稀释倍数1∶1 000),4℃条件下孵育过夜,洗膜孵二抗,室温孵育2 h,洗膜显色曝光,使用凝胶成像系统观察,以β-actin为内参蛋白分析蛋白的相对表达量。
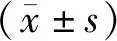
2 结 果
2.1 各组大鼠肾脏指数比较 与对照组比较,模型组大鼠肾脏指数显著升高(P<0.05);与模型组比较,氯沙坦组和四逆汤各剂量组大鼠肾脏指数显著降低(P<0.05);四逆汤低、中、高剂量组大鼠肾脏指数依次降低(P<0.05);与氯沙坦组比较,四逆汤低剂量组大鼠肾脏指数显著升高(P<0.05),四逆汤中剂量组大鼠肾脏指数差异无统计学意义(P>0.05),四逆汤高剂量组大鼠肾脏指数显著降低(P<0.05),见表1。
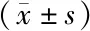
表1 各组大鼠肾脏指数比较
2.2 各组大鼠血清BUN、SCr、UA水平比较 与对照组比较,模型组大鼠血清BUN、SCr、UA水平显著升高(P<0.05);与模型组比较,氯沙坦组和四逆汤各剂量组上述指标显著降低(P<0.05);四逆汤低、中、高剂量组上述指标依次降低(P<0.05);与氯沙坦组比较,四逆汤低剂量组上述指标显著升高(P<0.05),四逆汤中剂量组差异无统计学意义(P>0.05),四逆汤高剂量组显著降低(P<0.05),见表2。
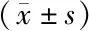
表2 各组大鼠血清BUN、SCr、UA水平比较
2.3 各组大鼠血清炎性因子比较 与对照组比较,模型组大鼠血清IL-6、IL-1β、TNF-α水平显著升高(P<0.05);与模型组比较,氯沙坦组和四逆汤各剂量组大鼠上述指标显著降低(P<0.05);四逆汤低、中、高剂量组上述指标水平依次降低(P<0.05);与氯沙坦组比较,四逆汤低、中剂量组上述指标显著升高(P<0.05),四逆汤高剂量组差异无统计学意义(P>0.05),见表3。
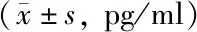
表3 各组大鼠血清炎性因子水平比较
2.4 各组大鼠肾组织病理变化比较 对照组大鼠肾组织无明显病变;与对照组比较,模型组肾小球结构紊乱,肾小球基底膜增厚,肾小球硬化纤维化,肾小管明显扩张纤维化,间质水肿,大量炎性细胞浸润;氯沙坦组和四逆汤各剂量组肾损害和炎性反应明显减轻。与氯沙坦组比较,四逆汤低、中剂量组差异较为明显,而四逆汤高剂量组无明显差别,见图1。
2.5 各组大鼠肾组织细胞凋亡比较 与对照组比较,模型组大鼠肾组织细胞凋亡指数显著升高(P<0.05);与模型组比较,氯沙坦组和四逆汤各剂量组细胞凋亡指数均显著降低(P<0.05);四逆汤低、中、高剂量组细胞凋亡指数依次降低(P<0.05);与氯沙坦组比较,四逆汤低剂量组细胞凋亡指数显著升高(P<0.05),四逆汤中剂量组差异无统计学意义(P>0.05),四逆汤高剂量组显著降低(P<0.05),见表4。

表4 各组大鼠肾组织细胞凋亡指数比较
2.6 各组大鼠肾组织p38 MAPK、p-p38 MAPK、ERK1/2、p-ERK1/2蛋白比较 与对照组比较,模型组大鼠肾组织p-p38 MAPK/p38 MAPK、(p-ERK1/2)/(ERK1/2)蛋白水平均显著升高(P<0.05);与模型组比较,氯沙坦组和四逆汤各剂量组上述指标均显著降低(P<0.05);四逆汤低、中、高剂量组上述指标依次降低(P<0.05);与氯沙坦组比较,四逆汤低剂量组上述指标显著升高(P<0.05),四逆汤中剂量组差异无统计学意义(P>0.05),四逆汤高剂量组显著降低(P<0.05),见图2、表5。
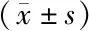
表5 各组大鼠肾组织p-p38 MAPK/p38 MAPK、(p-ERK1/2)/(ERK1/2)蛋白比较
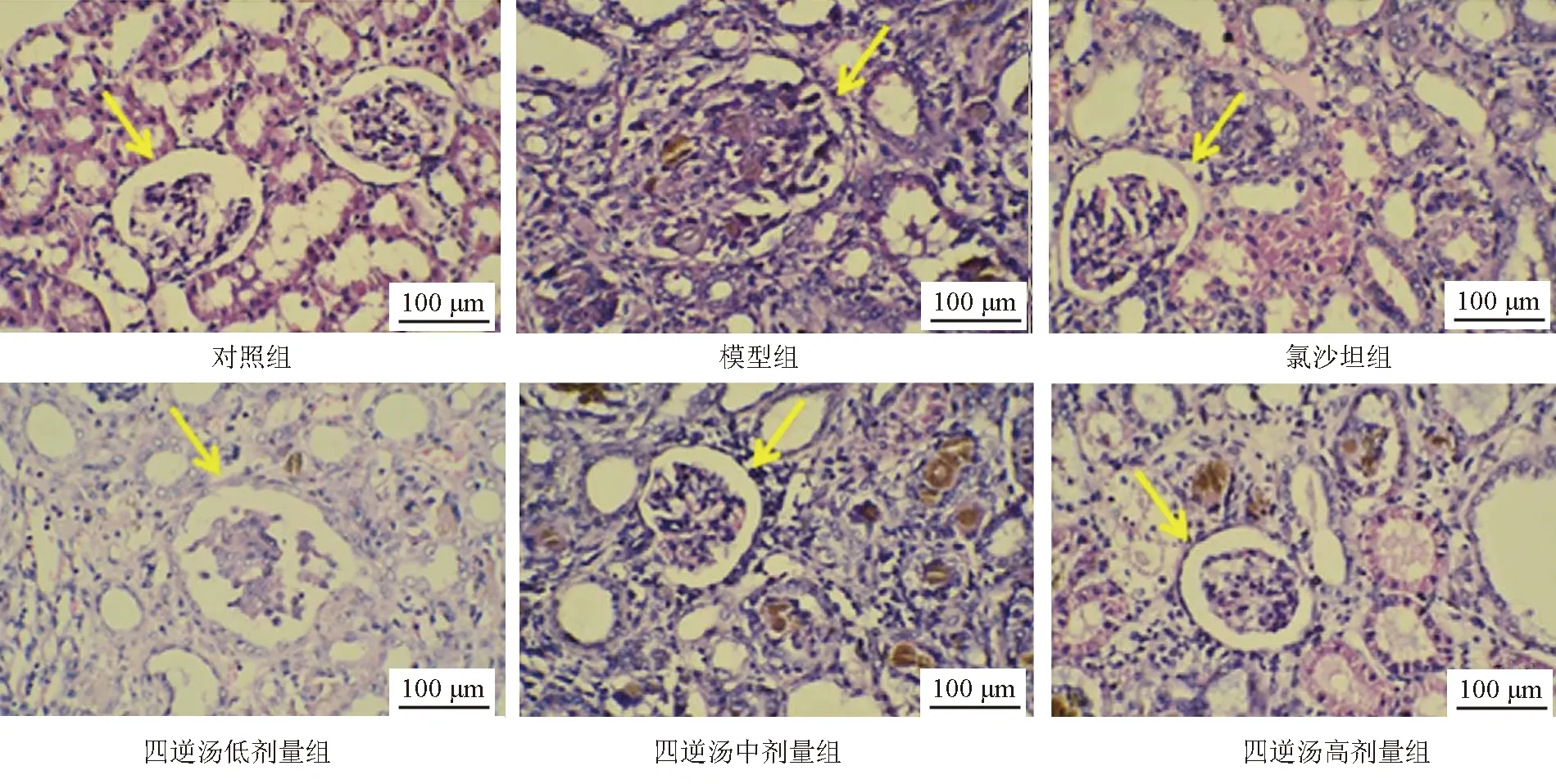
注:黄色箭头表示肾小球
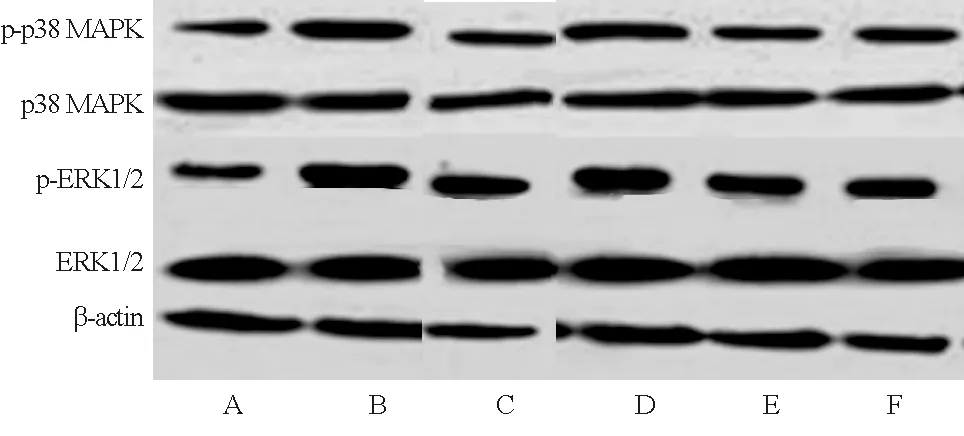
注:A.对照组;B.模型组;C.氯沙坦组;D.四逆汤低剂量组;E.四逆汤中剂量组;F.四逆汤高剂量组
3 讨 论
CRF病理进程伴随不可逆的肾单位逐渐丢失最终导致肾小球硬化、肾小管萎缩和肾脏单位数目进一步减少[12],可产生一系列复杂的不良反应,最终导致进行性肾损伤和功能严重下降。高水平BUN和SCr是慢性肾功能衰竭肾功能异常的标志[13]。Li等[14]报道腺嘌呤诱导的CRF大鼠模型,可产生类似人类慢性肾病的代谢异常,包括氮质血症、尿毒症毒素堆积、氨基酸和电解质的代谢失衡及激素失衡。UA为嘌呤代谢的产物,可通过电压敏感的尿酸盐通道和尿酸盐—阴离子交换机制在近端小管中重新吸收和排泄[15]。在肾脏疾病患者中,UA排泄减少,易造成体内UA增多。本研究采用腺嘌呤喂养大鼠,镜下可见大鼠肾小球结构紊乱、基底膜增厚、硬化纤维化,肾小管明显扩张纤维化,间质水肿,大量炎性细胞浸润,大鼠肾脏指数、肾组织细胞凋亡指数,且伴随血清中BUN、SCr、UA水平显著升高,表明CRF大鼠模型构建成功。CRF不仅是一系列复杂的生化反应,而且是一种全身性慢性炎性反应。已有研究表明,在肾炎动物模型和患者中,促炎细胞因子IL-1β和TNF-α有助于肾炎的进展[16]。本研究亦观察到,模型组大鼠血清中IL-6、IL-1β、TNF-α水平显著升高,表明CRF大鼠体内炎性反应明显,与上述研究结果一致,提示促炎细胞因子在肾脏炎性疾病和肾小球硬化的发展中起重要作用。
四逆汤是《伤寒论》的经典方,主要治疗血虚寒厥证,制附子为君,可回阳救逆、逐风寒湿邪;干姜为臣,可温中散寒、助附回阳;炙甘草为佐,补脾益气、调和诸药,三药组分配伍,具有补肾益气之功效[7]。研究发现,组分配伍四逆汤对被动型Heymann肾炎大鼠有明显的改善作用,可显著降低大鼠血清中BUN、SCr、UA水平,减轻肾组织病理变化[17]。本研究观察到,CRF大鼠在四逆汤干预作用下,肾组织病理变化明显减轻,肾脏指数、肾组织细胞凋亡指数、血清中BUN、SCr、UA、炎性因子水平均显著降低,表明四逆汤可改善CRF大鼠的病理状况,减轻炎性反应。
p38 MAPK/ERK1/2途径可被各种刺激激活,并有助于调节细胞增殖、分化、存活、凋亡等作用[18]。Tao等[19]研究发现,抑制ERK1/2表达可减轻高尿酸血症肾病大鼠肾小管细胞上皮间质转化和凋亡。甜菜碱可通过p38 MAPK/ERK1/2信号通路影响肾小球系膜细胞的增殖与凋亡[20]。本研究中,模型组大鼠肾组织p-p38 MAPK/p38 MAPK、(p-ERK1/2)/(ERK1/2)蛋白水平显著升高,说明CRF大鼠体内p38 MAPK、ERK1/2蛋白活化增强,刺激细胞凋亡。有研究发现,桂枝附子汤可抑制胶原诱导性关节炎大鼠p38 MAPK信号通路的活化,缓解炎性反应[21]。在支气管哮喘小鼠模型中,甘草酸可抑制p38 MAPK和ERK1/2蛋白磷酸化,减轻炎性反应[22]。本研究结果显示,四逆汤各剂量组大鼠肾组织p-p38 MAPK/p38 MAPK、(p-ERK1/2)/(ERK1/2)蛋白水平均显著降低,表明四逆汤可抑制p38 MAPK、ERK1/2蛋白活化,减轻肾组织炎性反应,进而改善CRF大鼠的肾组织损伤。
综上所述,四逆汤可抑制CRF大鼠肾组织中p38 MAPK/ERK1/2信号通路的活化,降低UA水平,改善肾组织损伤,提高肾功能。然而,CRF的发病机制比较复杂,四逆汤的药效作用仍有待于进一步研究。
利益冲突:所有作者声明无利益冲突
作者贡献声明
田芳:设计研究方案,课题设计,实施研究过程,论文撰写;仇方忻、王鹏:提出研究思路,分析试验数据,论文审核;魏玉翠:实施研究过程,资料搜集整理,论文修改;孙萍、李浩:进行统计学分析
