载有ε-聚赖氨酸的纳米纤维膜的制备及其抗菌性能评价
2021-12-23唐志敏
唐志敏, 李 彦, 王 璐
(东华大学 a.纺织学院,b.纺织面料技术教育部重点实验室, 上海 201620)
细菌侵入破损皮肤继而引发伤口感染的概率极高。由细菌引起的慢性感染伤口的微环境较为复杂,在持续炎性刺激下,巨噬细胞和中性粒细胞在伤口床分泌大量炎性细胞因子,促进金属蛋白酶生成,这将加剧感染并阻碍愈合进程,因此用适宜的局部抗菌敷料降低伤口处的感染是十分必要的[1]。
相比传统敷料,静电纺丝膜具有较大的比表面积、连通的孔结构以及可调的孔隙率,既有利于营养物质的传输和氧气的渗透,又可加载药物为抑制伤口感染提供可能,是一种极富前景的功能性敷料[2-4],尤其在抗菌方面备受关注[5]。Alavarse等[6]将盐酸四环素负载于聚乙烯醇(PVA)/壳聚糖纳米纤维中,可有效抵御金黄色葡萄球菌。Mutlu等[7]将具有抑炎和抗菌作用的姜黄素负载于聚羟基丁酸戊酯纳米纤维中,这对抵御伤口感染产生了积极效应。然而,纳米纤维基敷料仅能应对由常规细菌引发的感染问题,而对顽固耐药菌束手无策。尤其是近年来,抗生素等药物的无规滥用,致使耐药性细菌大量涌现。因此,开发可应对耐药菌感染的敷料已成为医用纺织领域的研究重点之一。
抗菌肽对细菌具有广谱高效杀菌活性,且不易产生耐药性,成为抗生素替代品的“希望之星”[8-10]。与抗生素不同,抗菌肽与细菌表面的脂多糖、磷脂等带负电荷的分子之间发生静电吸引[11],通过改变细菌细胞膜内外电势差从而破坏细菌膜结构[12]。此外,小分子抗菌肽可快速进入细菌细胞,干扰胞内生理生化反应,引起胞内的物质、能量和信息传递中断,致使细菌死亡[13]。鉴于裸露的抗菌肽活性易被伤口微环境破坏,研究者们通过共混纺丝、吸附、层层自组装等方式将抗菌肽结合到纳米纤维上得以实现抗菌肽的局部递送。比如:Song等[14]通过硫醇-马来酰亚胺偶联法将抗菌肽LL-37固定在丝素纤维膜上,结果表明,LL-37对金黄色葡萄球菌等细菌有良好的抗菌活性,且能抑制细菌生物膜的生成;Su等[15]采用同轴静电纺将抗菌肽17BIPHE2包封在核层,该膜在慢性伤口模型测试中降低了5个数量级的生物膜浓度,且无明显细胞毒性。考虑到生物膜中的细菌群体具有极强的耐药性[16],故推测以抗菌肽为抗菌剂应对伤口耐药菌感染具有一定的可行性。
选取具有高安全性的广谱抗菌肽——聚赖氨酸(ε-polylysine,ε-PL)作为抗菌剂,并以PVA和海藻酸钠(sodium alginate,SA)混纺纳米纤维膜为载体,这是因为研究发现PVA/SA纤维载体具有极佳的生物相容性。舒泉水等[17]将PVA、SA和甲基丙烯酸缩水甘油酯进行混纺,随后通过120 ℃热处理获得高吸液敷料,但高温处理会使多数药物失活。李沉纹等[18]预先在PVA/SA纤维膜中负载盐酸莫西沙星,随后通过氯化钙处理达到缓释药物的目的。但上述处理步骤较为复杂,且抗菌剂易在处理中溶出,因此如何更好地发挥载体的作用尚待进一步研究。考虑到SA是线性呈嵌段排列的天然阴离子多糖[19],可纺性较差,故对PVA/SA混纺纤维膜的结构调控规律进行探究,采用ε-PL溶液对PVA/SA混纺膜进行涂覆改性,并对抗菌肽处理后的混纺膜的抗菌性能进行评价。由于ε-PL可与混纺膜中的SA形成静电吸附等作用,可在实现有效负载的同时降低混纺膜的水溶性;另外,纤维主体中的ε-PL能够利用混纺膜中PVA的水溶性从纤维膜中溶出从而发挥抗菌作用;再者,存在于交联结构中的ε-PL可产生缓释效应,有望获得缓释型抗耐药菌的纳米纤维基敷料。
1 试验部分
1.1 试验材料与仪器
聚乙烯醇(PVA 1788,聚合度1 700,醇解度88%,上海阿拉丁生化科技股份有限公司);海藻酸钠(SA,纯度≥90%,生工生物工程(上海)股份有限公司);ε-聚赖氨酸(ε-PL,AR,上海阔泉生物科技有限公司)。耐药性金黄色葡萄球菌(ATCC 29213型,上海保藏生物技术中心);耐药性铜绿假单胞菌(ATCC 15692型,中国微生物菌种保藏中心)。
静电纺丝机(ET-2535 H型,北京永康乐科技发展有限公司);电子天平(FA2204C型,上海赛德利思精密仪器仪表有限公司);恒温磁力搅拌器(524 G型,上海梅颖仪器仪表制造有限公司);扫描电子显微镜(DXS-10ACKT型);电热鼓风干燥箱(DHG-9145A型,上海精宏实验设备有限公司);多功能强力仪(YG(B)026G-500型);台式乳胶测厚仪(CH-12.7-BTSX型,上海添时科学仪器有限公司);傅里叶变换红外光谱仪(Spectrum Two型,珀金埃尔默企业管理(上海)有限公司)。
1.2 试验方法
1.2.1 纺丝原液的配备
称取不同质量的PVA和SA溶解于去离子水(溶剂)中,并在90 ℃油浴锅中恒温持续加热搅拌6 h,待混合物完全溶解并混合均匀后,置于磁力搅拌器上搅拌备用。PVA/SA混合溶液中各成分含量如表1所示。
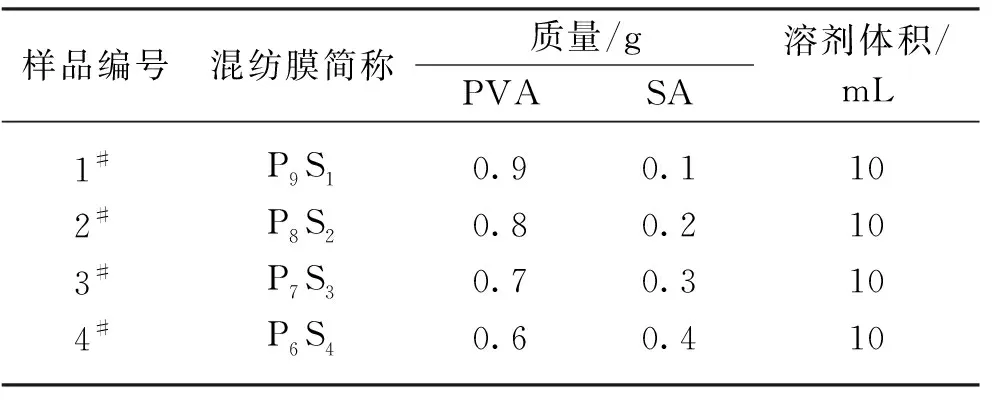
表1 PVA/SA混合溶液中各成分的含量Table 1 Content of each component in the PVA/SA mixed solution
1.2.2 混纺膜的制备
将配制好的纺丝原液注入10 mL的注射器中进行静电纺丝,用铝箔纸接收纳米纤维。纺丝参数:纺丝速率0.48 mL/h、纺丝电压30 kV、接收距离15 cm、温度35 ℃、相对湿度50%~65%、针头型号21 G。纺丝结束后,取下接收板上的铝箔纸,在电热鼓风干燥箱中于60 ℃烘干,保存备用。
1.3 结构与性能测试
1.3.1 表面形貌
将混纺膜裁剪成适当大小,并用导电胶将其粘贴到电镜台上,低温多次喷金后用扫描电子显微镜观察纤维形貌。使用图像分析软件ImageJ采集100根不同纤维并测量纤维直径,用Origin软件进行数据分析,以获得纤维平均直径及其分布。
1.3.2 力学性能
将混纺膜裁剪成20 mm×3 mm的条状,在室温下,用多功能强力仪测量各混纺膜的断裂强度和断裂伸长率。薄膜的初始长度为10 mm,拉伸速度为10 mm/min,预加张力为0.1 N,每个试样测量5次;采用台式乳胶测厚仪测量混纺膜的厚度,测量10次求取平均值,计算薄膜的应力与应变并绘制应力-应变曲线。
1.3.3 涂覆率与溶解性能
将混纺膜P9S1和P8S2裁剪成3 cm×3 cm的片状,在ε-PL质量分数为0.1%的无水乙醇溶液中浸泡3 h,使混纺膜与ε-PL产生交联,分别得到ε-PL@P9S1和ε-PL@P8S2纤维膜。称量涂覆处理前后混纺膜的干燥质量,计算混纺膜上ε-PL的涂覆率Rcl。
(1)
式中:m0、m1分别为ε-PL处理前、后PVA/SA混纺膜的干燥质量,g。
将混纺膜P9S1、P8S2、ε-PL@P9S1、ε-PL@P8S2浸泡于磷酸盐缓冲液(pH=7.4)中,使其完全溶解,考察涂覆改性后混纺纤维膜的溶解性。
1.3.4 化学结构
采用红外光谱仪对混纺纤维膜P9S1及ε-PL@P9S1表面的化学键类别与分布进行测试分析,扫描范围为4 000~400 cm-1,以检验混纺膜P9S1是否成功涂覆了ε-PL。
1.3.5 抗菌活性
参照GB/T 20944.1—2007《纺织品抗菌性能的评价标准(琼脂平皿扩散法)》定性测试表征纤维膜表面的抗菌活性。配制牛肉膏蛋白胨固体培养基,并在上面涂布耐药性金黄色葡萄球菌(staphylococcusaureus,S.A.)和耐药性铜绿假单胞菌(pseudomonasaeruginosa,P.A.),然后将纤维膜裁剪成直径为14 mm的小圆片,置于涂布菌液的培养基中,在恒温培养箱内培养1 d,测量抑菌带宽度H。H=(D-d)/2,D为抑菌带外径的平均值,d为试样直径,mm。当H>0且试样上细菌无繁殖时,表示抗菌效果好;当H=0时,试样上细菌轻微繁殖表示抗菌效果较好,试样上细菌中等繁殖表示抗菌效果有限,试样上细菌大量繁殖表示无抗菌效果。
参照GB/T 20944.3—2008《纺织品抗菌性能的评价标准(振荡法)》定量测试表征纳米纤维膜表面的抗菌活性。将过夜培养的菌液稀释到3×105~4×105CFU/mL,然后取5 mL菌液与5 mm×5 mm的试样在(24±1) ℃、150 r/min的条件下振荡培养18 h。培养完成后,将共培养液体稀释一定倍数并取(1.0±0.1) mL涂布于装有营养琼脂培养基的培养皿内,将此培养皿置于恒温培养箱中培养24 h后计数。上述过程记为完成第1次振荡培养和计数。将第1次振荡培养后的试样用去离子水充分冲洗并晾干后,重复上述操作步骤进行第2次振荡培养和计数,同理进行第3次振荡培养和计数。若最小稀释倍数平板中的菌落数<30 CFU/mL,则按实际数量记录;若无菌落生长,则菌落数记为“<1”。计算活菌浓度K(CFU/mL),K=Z×R,Z为平板菌落平均值(CFU/mL)、R为稀释倍数。根据试样和菌液振荡接触18 h后的活菌浓度Qt与阳性对照样的活菌浓度Wt计算抑菌率Y,Y=(Wt-Qt)/Wt×100%。由抗菌性评价标准可知,抑菌率≥70%且验证有效(F≥1.5)时材料具有抗菌效果。
2 结果与讨论
2.1 PVA/SA混纺膜及其载药膜的表观形貌
PVA/SA混纺膜及其载药膜的SEM图和纤维直径分布如图1所示。由图1可以看出,当PVA与SA的质量比为9∶1和8∶2时,纤维粗细均匀、连续完整,呈无规律交叉分布,纤维平均直径由180 nm增加到388 nm;当PVA与SA的质量比为7∶3和6∶4时,纤维平均直径分别为120、68 nm,出现了串珠结构,且随着SA质量分数的增加,串珠结构明显增多。该现象主要归因于SA分子间和分子内的氢键作用,该作用使得纺丝液的成纤性能降低。用ε-PL涂覆处理混纺膜P9S1后,纳米纤维膜中的三维堆积结构仍然存在,只是纤维直径有所增加,测得平均直径为315 nm,同时还可观察到纤维与纤维的交叠处发生了粘连。而采用ε-PL涂覆处理混纺膜P8S2后,因ε-PL与SA发生反应,随着SA质量占比的增大,纤维直径进一步增大,纤维膜中的三维堆积结构遭到破坏,纤维间的粘连程度大幅提高,已难以测算纤维平均直径及分布。

图1 PVA与SA混纺膜及其载药膜的SEM图和纤维直径分布Fig.1 SEM images and fiber diameter distribution of the PVA/SA and its drug-loaded blended membranes
2.2 PVA/SA混纺膜及其载药膜的力学性能
作为敷料使用时,纤维膜还需具备一定的力学性能,对不同配比条件下纤维膜的力学性能进行研究。混纺膜P9S1、P8S2、P7S3、P6S4、ε-PL@P9S1、ε-PL@P8S2的应力-应变曲线如图2所示。由图2可知,随着SA质量占比的增加,混纺纤维膜的力学性能呈下降趋势。这是因为,PVA是一种半结晶亲水性聚合物,分子链段中富含—OH,SA是一种刚性天然聚合物[20],因SA大分子链中有大量环状结构,当两者共混纺丝时,SA环上的—OH、—COOH和PVA链段中的—OH会形成分子内和分子间氢键,增加了聚合物链段的牵伸阻力。与此同时,SA作为一种具有高导电率的聚电解质,其自身阴离子链之间的相互排斥力使得混纺溶液的可纺性降低,在电场牵伸力不变的条件下,成纤率和纺丝均匀性都会降低,多以疵点“串珠”结构存在,因而纤维的伸长率急剧下降。综合比对不同混纺膜的力学性能后,摒弃断裂伸长率较小的P7S3和P6S4两种混纺纤维。将力学性能最好的混纺膜P9S1和P8S2用阳离子多肽药物ε-PL处理,结果发现两者均展现出较未负载ε-PL时的纤维原膜更好的力学性能。这是因为ε-PL与阴离子多糖发生交联,增大了分子间作用力,从而增加了原膜强力。混纺膜及其载药膜的断裂强度和断裂伸长率如表2所示。

图2 混纺膜和载药膜的应力-应变曲线Fig.2 Stress-strain curves of blended membranes and drug-loaded membranes

表2 混纺膜及载药膜的断裂强度和断裂伸长率Table 2 Strength and elongation of blended membranes and drug-loaded membranes
2.3 ε-PL的涂覆率及ε-PL@PVA/SA载药膜的水溶性
因PVA和SA均不溶于无水乙醇,故混纺膜可在ε-PL与无水乙醇的混合溶液中稳定存在。ε-PL进入混纺膜内部与SA组分发生物理交联而充分吸附。交联完成后测量ε-PL处理后的混纺膜的干燥质量,结果如表3所示。混纺膜P9S1、P8S2经ε-PL与无水乙醇的混合溶液浸泡后,计算得到纤维膜的涂覆率分别为83.35%、75.28%。

表3 PVA/SA混纺膜和载药膜的干燥质量与涂覆率Table 3 Dry weight and coating rate of PVA/SA blended membranes and drug-loaded membranes
因PVA与SA均为易溶于水的高分子聚合物,故其混纺膜的耐水性较差。经ε-PL涂覆处理后,因PVA/SA混纺膜中的组分SA与ε-PL发生交联从而提高混纺膜的耐水溶性。为验证ε-PL与SA发生了交联反应,对处理前后混纺纤维膜耐水溶性的变化规律进行探究,对应样品在磷酸盐缓冲液(pH为7.4)中的溶解时间如图3所示。由图3可知,P9S1、P8S2的溶解时间分别为0.3和0.4 h,经ε-PL涂覆处理后载药膜ε-PL@P9S1、ε-PL@P8S2的溶解时间分别为120和144 h。由此可见,ε-PL被成功负载于PVA/SA混纺膜,且ε-PL与SA的相互作用大幅提高了纤维膜的耐水溶性,为ε-PL的长效释放提供了可能。考虑到P9S1的ε-PL涂覆率较高且力学性能更优,后续试验中采用ε-PL@P9S1样品进行抗菌性能评估。

图3 PVA/SA混纺膜及ε-PL处理后膜的水溶解时间Fig.3 Dissolution time of PVA/SA blended membranes and ε-PL treated membranes
2.4 P9S1及ε-PL@P9S1的化学结构
通过对P9S1和ε-PL@P9S1进行红外光谱分析进一步验证ε-PL是否被成功涂覆于纤维膜,测试结果如图4所示。

图4 混纺膜P9S1和载药膜ε-PL@P9S1的FTIR光谱Fig.4 FTIR spectra of blended membranes P9S1 and its drug-loaded membranes ε-PL@P9S1

2.5 ε-PL@P9S1载药膜的抗菌活性
为定性评价ε-PL@P9S1的抗耐药菌性能,分别对比了P9S1混纺膜在涂覆ε-PL前后对耐药菌S.A.和P.A.的抑制作用,结果如图5所示。由图5可知,P9S1混纺膜上无法观察到抑菌圈,而ε-PL@P9S1载药膜对细菌S.A.和P.A.形成的抑菌带宽度分别为1.5和2.0 mm。由此可见,ε-PL@P9S1载药膜对革兰氏阴性菌P.A.的抑菌效果比革兰氏阳性菌S.A.好,初步推断这可能与两种细菌的外膜结构差异及ε-PL的抑菌机理有关。纤维膜中释放的ε-PL主要通过静电吸附作用影响细菌的生理功能,进而发挥抑菌作用;此外,P.A.外膜的电负性比S.A.更强[21],因此前者可与ε-PL产生更强的相互作用。

注:分图中左、右侧分别为混纺膜P9S1与载药膜ε-PL@P9S1对细菌的抑菌圈。图5 混纺膜P9S1与载药膜ε-PL@P9S1分别对细菌S.A.和P.A.的抗菌效果Fig.5 Antibacterial effect of blended membrane P9S1 and drug-loaded membrane ε-PL@P9S1 on S.A. and P.A.
载药膜ε-PL@P9S1的定量抗菌评价结果如图6所示。

注:(a)~(d)或(e)~(h)依次为载药膜与S.A.或P.A.共培养的空白样及振荡培养1、2、3次试样的菌落。图6 载药膜ε-PL@P9S1对细菌S.A.和P.A.的抗菌效果Fig.6 Antibacterial effect of drug-loaded membrane ε-PL@P9S1 on bacteria S.A. and P.A.
由图6可以看出,相比空白对照样,与两种细菌S.A.和P.A.振荡培养18 h的载药膜均具有明显的抑菌效果。第1、2、3次与S.A.振荡培养18 h的载药膜的抑菌率分别为82.20%、99.48%、96.86%;第1、2、3次与P.A.振荡培养18 h的载药膜的抑菌率分别为88.97%、97.93%、94.48%。随着抑菌率先增加后稍降低,药物释放速率先增加后减缓,但抑菌率均大于70%,表明抗菌效果显著。这可能是由于在固定温度和振荡速率的条件下,经过一段时间的振荡接触,纤维膜中的药物ε-PL缓慢释放,从而有效发挥其抗菌作用。与琼脂平皿扩散法所得结果一致,进一步验证了ε-PL抑菌作用的发挥是通过与细菌膜表面发生静电吸附产生的,故该电纺膜抗菌效果较为优异。
3 结 论
(1)PVA与SA共混后通过静电纺丝成功制得纤维形貌优良的复合纳米纤维,随着SA质量分数的增加,纤维出现串珠结构且力学性能下降。
(2)通过对PVA/SA进行ε-PL涂覆处理,提高了混纺纤维膜的耐水溶性,水溶时间延长至144 h。
(3)PVA/SA混纺膜的红外光谱显示,PVA、SA、ε-PL的特征吸收峰在红外光谱图中均有体现,说明纤维膜中同时存在PVA及SA两种组分,表明涂覆过程可实现ε-PL的成功加载。
(4)由ε-PL@P9S1载药膜的抗菌试验可知,制备的纳米纤维基敷料对耐药性金黄色葡萄球菌和铜绿假单胞菌均可产生较好的抗菌效果。
