大体积宫颈癌单程与二程VMAT计划的物理、生物等效剂量变化研究
2021-12-22吴伟伟赖小云罗红樱李政欢
吴伟伟,尹 慧,赖小云,罗红樱,李政欢
(1.赣州市肿瘤医院放疗中心,江西赣州 341000;2.中山大学第三附属医院放射治疗科,广州 510630)
0 引言
宫颈癌是我国常见的妇科恶性肿瘤[1],局部晚期宫颈癌患者的标准治疗模式是外照射同步加上以顺铂为基础的化疗,继之近距离后装治疗[2]。容积旋转调强放疗(volumetric modulated arc therapy,VMAT)技术已经广泛应用于宫颈癌治疗[3],大体积宫颈癌放疗采用VMAT技术能提高靶区剂量适形度,降低直肠、膀胱和小肠等危及器官受照剂量[4-5]。然而大体积宫颈癌的放疗周期较长,靶区相对复杂,膀胱、肠管等充盈性难以保持一致,放疗中大体积肿瘤明显缩小[6],以上因素可能使靶区和危及器官发生偏移,从而造成肿瘤区域“漏照”,而临近危及器官区域“过照”,甚至造成局部肿瘤未控和晚期毒性反应增加。在放疗计划中,相较于物理剂量,生物等效剂量更能反映靶区和危及器官受照后的放射生物效应,然而关于宫颈癌的二程放疗生物剂量学特征鲜有报道。本研究旨在分析大体积宫颈癌根治性VMAT过程中靶区、危及器官体积变化,探讨上述因素对靶区和危及器官受照剂量的影响,分析单程与二程VMAT计划的物理、生物等效剂量变化。
1 资料与方法
1.1 临床资料
选取赣州市肿瘤医院25例未手术的宫颈癌患者,年龄34~75岁,中位年龄55岁。纳入标准:(1)病理为宫颈鳞癌或腺癌;(2)国际妇产科联盟(Federation International of Gynecology and Obstetrics,FIGO)分期为Ⅲ~ⅣA期初收治患者;(3)宫颈原发肿物体积大于80 cm3;(4)确诊盆腔淋巴结转移;(5)既往无放、化疗史,也无放、化疗禁忌证。排除标准:(1)不能完整完成放疗或者无法严格按照本研究的要求(如憋尿和排空直肠等)来实施放疗的患者;(2)合并其他第二原发恶性肿瘤并且没有治愈;(3)合并其他心、肝、肺等严重基础疾病。
1.2 CT模拟定位
定位前1 h排空膀胱后饮500 mL的温开水,憋尿1 h后使用Philips 16排大孔径螺旋CT机行初次定位CT扫描,采取真空垫头先进仰卧位体位固定,阴道放标记物。CT扫描范围从横隔至坐骨结节下5.0 cm,扫描层厚为0.5 cm,图像以DICOM格式传输至Eclipse 13.6计划系统。
1.3 靶区勾画
资深放疗医生依照放射肿瘤学联盟(Radiation Therapy Oncology Group,RTOG)要求勾画靶区与危及器官[7],肿瘤靶区(gross tumor volume,GTV)为影像学上所见的原发肿瘤区域,GTV外扩6 mm形成PGTV。GTVnd为CT上可疑阳性淋巴结,GTVnd外扩6 mm并避开肠管形成PGTVnd。临床靶区(clinical target volume,CTV)包括宫颈病变、宫颈、宫体、阴道、卵巢、宫旁组织、髂总、髂内、髂外、闭孔、骶前淋巴引流区。盆腔放疗上界为髂血管分叉处,下界根据宫颈病变侵犯阴道的程度而定,要求包括最少达病变下3 cm,前界为骶骨前缘1.5 cm,后界为骶骨边缘。对影像考虑髂总淋巴结转移及腹膜后淋巴结转移的患者进行延伸靶区勾画,上界至少在静脉平面或肿大淋巴结上界上2~3 cm,单独勾画左右宫旁组织来对宫旁加量放疗,CTV四周外放6 mm,上下外放10 mm形成PCTV。PCTV及其上下2 cm范围内勾画肠道(小肠和结肠)、膀胱、直肠和股骨头。
1.4 计划设计
在Eclipse 13.6计划系统中采用共面双弧VMAT计划,角度为逆时针从179.9°至180.1°,再顺时针到179.9°。采用6 MV X射线,PCTV、PGTV处方剂量分别为45和50 Gy(25次),PGTVnd处方剂量为60 Gy(28次),要求处方剂量包含95%的靶区体积,GTV内无明显冷点,计划靶区(planning target volume,PTV)外无热点。危及器官剂量的限定要求:膀胱V45<50%、D2cc(2 cm3危及器官受到的照射剂量,以此类推)<52 Gy;直肠V45<50%、D2cc<52 Gy;肠道V45<200 cm3、D2cc<52 Gy。物理师将计划设计完成后经主管医师审核通过,经剂量验证和体位复核无误后将计划传输至Varian Clinac IX SN5777(60对多叶准直器)加速器实施放疗。
1.5 放疗实施与锥形束CT(cone beam CT,CBCT)体位验证
首次放疗前采用CBCT进行体位验证,选用125 kV、80 mA、25 MHz/帧、半扇形扫描方式。采用骨匹配方式,体位验证在误差范围内可实施放疗,放疗中每周(第1、6、11、16、21、26次放疗时)进行一次CBCT扫描,并在CBCT上与计划CT配准融合时勾画靶区和危及器官,监测靶区和危及器官体积变化情况。
1.6 VMAT计划移植与二程计划设计
初始VMAT计划定义为Plan1,执行15次放疗后,再次进行定位CT扫描,扫描参数与首次一致。将二程CT图像传输至Eclipse 13.6计划系统,在计划系统中将初始CT图像与二程CT图像进行骨性配准,2次CT图像融合中勾画靶区与危及器官,并将Plan1移植到二程CT图像中,然后进行剂量计算,将移植计划定义为Plan2。在二程CT图像上勾画新的结果并进行新的计划设计,优化目标函数和靶区剂量归一均与初始计划相同,形成VMAT修正计划(Plan3),Plan3计划经过医师审核通过后,用来完成后续的放疗。为了便于剂量学比较,将以上3组处方剂量均设置为PCTV 45 Gy(25次)、PGTV 50 Gy(25次)、PGTVnd 53.57 Gy(25次)。靶区物理剂量比较参数:近似最大剂量(D2),平均剂量(Dmean),95%体积所受剂量(D95)和适形性指数(conformity index,CI);靶区生物等效剂量比较参数:近似最大生物等效剂量(e D2),平均剂量(e Dmean),95%体积所受剂量(e D95)和适形性指数(eCI);危及器官物理剂量比较参数:D2和Dmean;危及器官生物等效剂量比较参数:e D2和e Dmean。
1.7 生物等效剂量转换
在计划系统中分别导出3个计划的靶区和危及器官的剂量体积直方图(dose volume histograms,DVH)文件,根据靶区与危及器官的α/β值(杀灭线性和平方项细胞相等时的剂量)和线性二次模型,采用MATLAB编写程序将计划中所有体素点的物理剂量转换成生物等效剂量,其中靶区、膀胱、肠道和直肠的α/β值分别为10、1、5和5[8]。线性二次模型公式为BED=Nd(1+),式中,BED为生物等效剂量;N为放疗次数;d为每次放疗剂量(Gy);α/β根据体素点器官属性选择相应的值。将物理剂量D根据公式:EQD2×(式中,EQD2为生物等效剂量)转换得到各体素点的生物等效剂量,并统计分析靶区和危及器官的生物等效剂量体积信息。
1.8 统计学分析
采用SPSS 19.0软件进行数据处理分析,宫颈癌患者的物理特征和剂量特征用±s表示。物理特征组间比较采用单因素方差分析,剂量采用配对样本t检验分析,P<0.05表示差异有统计学意义。
2 结果
2.1 利用CBCT测量靶区与危及器官每周的体积变化
GTV、GTVnd、直肠和膀胱的放疗前体积分别为(144.50±78.18)、(11.03±8.89)、(58.16±8.90)、(363.00±129.00)cm3。放疗中的GTV和GTVnd均退缩明显,GTV 5周共退缩65.41%,平均每周退缩13.08%,差异具有统计学意义(P=0.000);GTVnd 5周共退缩42.78%,平均每周退缩8.56%,差异具有统计学意义(P=0.000)。直肠和膀胱体积在放疗期间变化不大,差异无统计学意义(P>0.05)。详见表1。图1、2分别为1例宫颈癌患者3组计划横断面靶区与危及器官的分布情况以及对应3组计划的DVH比较图。
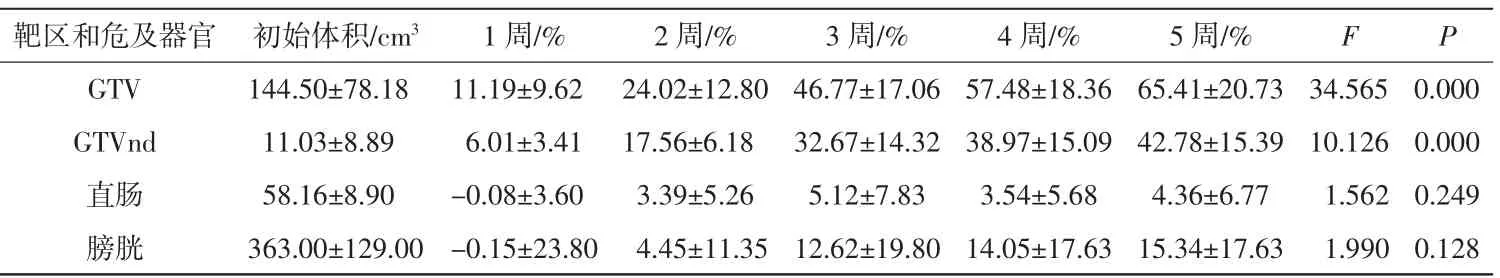
表1 25例宫颈癌患者VMAT过程中靶区和危及器官的体积退缩率

图1 1例宫颈癌患者3组VMAT计划的横断面靶区与危及器官分布图

图2 1例宫颈癌患者3组VMAT计划的DVH比较图
2.2 靶区在VMAT计划中的物理剂量和生物等效剂量的变化
Plan2相比初始计划Plan1,PGTV的Dmean和e Dmean的均值均略有增大,Plan3相比Plan2,PGTV的Dmean和e Dmean的均值均有所降低,差异具有统计学意义(P<0.05)。对比Plan1,Plan2 PGTVnd的D95和e D95的均值分别降低了2.26%、2.66%,差异具有统计学意义(t=2.216、2.176,P<0.05);对比Plan2,Plan3 PGTVnd的D95和e D95的均值分别提高了2.63%、3.08%,差异具有统计学意义(t=-3.065、-3.060,P<0.05)。在靶区PCTV的组间配对比较中,Dmean和e Dmean的比较结果与PGTV相似,Plan1、Plan2、Plan3中PCTV的CI和eCI的均值分别为1.095、1.172、1.103和1.049、1.125、1.117,差异具有统计学意义(P均<0.05),说明修正计划可以提高靶区PCTV的适形度。详见表2。

表2 25例宫颈癌患者不同治疗计划靶区物理剂量和生物等效剂量变化
2.3 危及器官在VMAT计划中的物理剂量与生物等效剂量变化
在危及器官剂量比较方面,相比Plan1,Plan2中肠道的D2和e D2的均值分别增加了7.21%、9.39%,差异具有统计学意义(t=-6.430、-6.394,P<0.001);相比Plan2,Plan3中肠道的D2和e D2的均值分别降低了5.23%、6.85%,差异具有统计学意义(t=7.126、7.051,P<0.001)。相比Plan1,Plan2中膀胱的Dmean和e Dmean的均值分别增加了6.11%、9.26%,差异具有统计学意义(t=-3.664、-3.124,P<0.05);相比Plan2,Plan3中膀胱的Dmean和e Dmean的均值分别降低了4.79%、8.23%,差异具有统计学意义(t=4.502、4.324,P=0.001)。相比Plan1,Plan2中直肠的D2、Dmean、e D2和e Dmean的均值分别增加了5.21%、4.02%、6.80%和5.14%,差异具有统计学意义(t=-2.898、-2.279、-2.941和-2.944,P<0.05);而相比Plan2,Plan3中直肠的D2、Dmean、e D2和e Dmean的均值分别降低了5.29%、2.94%、6.80%、3.74%,差异具有统计学意义(t=3.522、4.093、3.585、4.077,P<0.05)。Plan1、Plan2和Plan3的股骨头的剂量差异不明显,并无统计学差异(P>0.05)。详见表3。
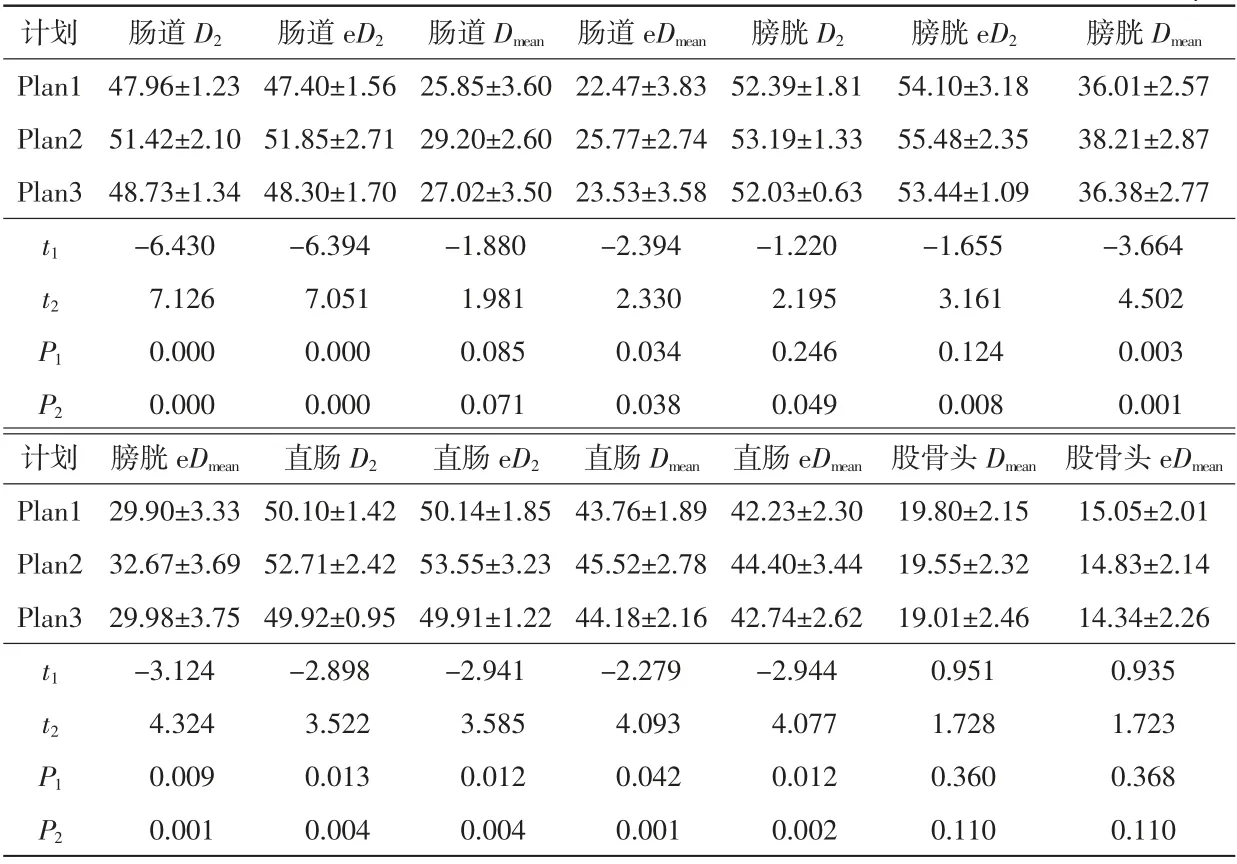
表3 25例宫颈癌患者不同治疗计划危及器官物理剂量与生物等效剂量变化单位:Gy
3 讨论
近年来,VMAT广泛应用于宫颈癌的治疗中,不仅能精准提高靶区的受照剂量,而且可以显著降低临近危及器官的受照剂量,减轻宫颈癌患者的晚期毒性反应。相较于常规调强放疗(intensity modulated radiation therapy,IMRT)技术,VMAT具有适形度更高、治疗速度更快的特点[9]。宫颈癌对射线较为敏感,宫颈肿物往往出现较大幅度的退缩,膀胱和直肠的充盈难以保持一致,这些因素都直接影响到VMAT精度。如何准确评估宫颈癌二程VMAT中肿瘤控制和危及器官放疗损伤情况一直是临床放疗所面临的难题。
本研究针对大体积宫颈癌患者行每周CBCT扫描,实现对放疗过程中解剖结构的动态监测。CBCT图像相比于常规CT图像有空间分辨力差等缺点,但其作为加速器机载影像系统能方便、精确地获取患者的三维影像,从而实现患者放疗过程中放疗位置和肿瘤等结构的监测,如丁嘉佩等[10]采用CBCT实现对根治性宫颈癌放疗患者靶区运动度的评估。Beadle等[11]发现放疗前、放疗后宫颈肿物平均体积由97 cm3缩小至31.9 cm3。Chen等[12]采用CBCT观察宫颈原发肿物GTV-T体积由79.62 cm3缩小至外照射结束时的20.86 cm3。这些结果均与本研究结果相似。本研究放疗至第3周GTV退缩体积最大(46.77%),此时应及时修正放疗计划。Utena等[13]对宫颈癌患者采集CBCT图像分析放疗效果发现肿瘤退缩明显,应当重新设计放疗计划。Rigaud等[14]研究采用CBCT分析认为在放疗过程中膀胱体积将逐渐缩小,与本研究结果相同。可能由于膀胱局部出现放疗副反应,使得患者憋尿能力下降[15],在评估宫颈癌患者膀胱受照剂量时应给予重点关注。
本研究大体积宫颈癌患者放疗过程中,原发肿物出现较大幅度的退缩,放疗15次后退缩了46.77%,移植计划Plan2相较于Plan1,PGTV物理剂量D95和生物等效剂量e D95均值没有显著差异,而物理剂量中的Dmean和生物等效剂量中的e Dmean均略有增加,而修正计划Plan3中物理剂量中的Dmean和生物等效剂量中的e Dmean分别相较于Plan2显著降低,可能与肿物退缩造成计划优化复杂性降低有关。针对局部转移淋巴结PGTVnd,Plan2相较于Plan1中物理剂量D95和生物等效剂量e D95均出现显著下降,提示淋巴结高剂量区覆盖不足,存在漏照风险。Bondar等[16]研究也提示需要充分重视宫颈癌患者淋巴结的位移所致的剂量漏照。而修正计划Plan3从物理剂量和生物等效剂量方面均可以提高淋巴结高剂量区覆盖面积,提高靶区剂量。大体积宫颈癌患者随着放疗的进行,PTV的物理剂量适形度和生物等效剂量适形度降低,修正计划Plan3能够提高PTV的物理剂量适形度和生物等效剂量适形度,因此大体积宫颈癌患者放疗过程中采用二程VMAT在物理剂量学和生物等效剂量学方面均能显著提高靶区剂量。
大体积宫颈癌患者放疗过程中,GTV退缩明显,使得邻近肿物的直肠、膀胱和肠道等器官也将有较大位移。由于直肠在空间上紧临PGTV,GTV退缩使直肠可能会更多地被卷入到高剂量区域,从而造成本研究结果中Plan2直肠的物理剂量学参数D2和Dmean均较Plan1有所增大,在生物等效剂量中,e D2要大于对应物理剂量,e Dmean要小于对应物理剂量;而修正计划Plan3可以使得直肠的物理剂量D2、Dmean和生物等效剂量参数e D2、e Dmean均降低,可以更好地保护直肠。Kerkhof等[17]的研究也得出二程计划中直肠最大剂量Dmax和平均剂量Dmean较首次计划均要降低。本研究显示,Plan2中膀胱受照剂量较Plan1有明显增大,究其原因与其膀胱体积缩小有关。Tyagi等[18]对宫颈癌患者的膀胱剂量进行研究时也认为膀胱体积缩小将导致其受照剂量增大,因此放疗过程中宫颈癌患者保持膀胱充盈一致性是非常重要的。而Plan3中膀胱受照剂量较Plan2明显降低,是由于PGTV与膀胱重叠区域体积缩小所致。
针对宫颈癌VMAT局部推量放疗,用生物等效剂量分析疗效得到广泛认可[19],相较于物理剂量,生物等效剂量对肿瘤控制率和正常组织并发症概率的预测与临床实际结果更为接近[20-21]。本研究发现对于单次剂量在2 Gy的靶区PGTV,其生物等效剂量与物理剂量基本相近,而PGTVnd分次剂量大于2 Gy时,生物等效剂量也会高于物理剂量,要特别注意淋巴结周围的肠道等危及器官的高剂量区;而对于靶区PCTV和大部分危及器官的分次剂量往往会低于2 Gy,这些危及器官的生物等效剂量会低于对应物理剂量,比如本研究中膀胱和肠道的e Dmean均小于Dmean至少10%,Sukhikh等[22]针对局部晚期宫颈癌计划的比较也得出类似结论。需要指出的是,在大体积宫颈癌放疗中二程放疗较单程放疗具有一定的剂量学优势,良好的剂量分布能有效提高临床治疗效果。阴俊等[23]对宫颈癌的自适应放疗研究认为二程放疗与单程放疗相比3 a总生存率(overall survival,OS)和无进展生存率(progress free survival,PFS)无明显差异,但二程放疗可以降低直肠、膀胱的受照剂量,降低患者治疗期间急性腹泻的发生率,戚瑞虹等[24]的研究也得出相同结论,但更长时间的OS和PFS是否获益还需要进一步的临床研究。
本研究的不足之处在于样本量较少,存在一定的局限性,在未来研究中将收集更多病例数据进行进一步验证。另外,本研究中采用线性二次模型将物理剂量转换成生物等效剂量,其他转换模型或者不同危及器官的α/β取值可能导致生物等效剂量与本研究略有不同。
综上所述,大体积宫颈癌VMAT期间,宫颈原发肿瘤和转移淋巴结都会产生较大幅度的退缩,二程放疗较单程放疗更具物理剂量和生物等效剂量优势,能显著提高靶区受照剂量并且降低危及器官的受照剂量。
