电针对血管性痴呆大鼠学习记忆能力、炎性反应及自噬相关蛋白的影响
2021-12-22李巧彤程光宇孙士红
李巧彤,程光宇,张 晨,赵 宇,孙士红,马 莉
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;3.北京市丰台区马家堡社区卫生服务中心,北京 100071)
血管性痴呆是常见于中老年人的以认知功能显著受损达到痴呆程度的疾病。有研究表明,60岁以上老年脑病患者中约有20%患有痴呆,其中血管性痴呆为首要病因,并且随着年龄的增长患病风险也随之增加[1]。血管性痴呆的发病机制尚不完全明确,目前认为与炎症反应、氧化应激、神经细胞凋亡等密切相关[2-3]。本实验旨在通过观察电针法对血管性痴呆模型大鼠学习记忆能力、炎症反应因子及自噬相关蛋白的影响,探讨电针治疗血管性痴呆的作用机制,以期为临床治疗提供依据。
1 实验材料与方法
1.1实验动物 选取健康雄性SPF级Wistar大鼠40只,体重(260±30)g,购自黑龙江中医药大学实验动物中心,动物合格证号:SYXK(黑)2019002。饲养环境保持温度(26±2)℃,相对湿度(55±5)%,给予充足水分,自然光源。
1.2主要药物、试剂和仪器 吡拉西坦片(东北制药集团沈阳第一制药有限公司);肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-10(IL-10)酶联免疫试剂盒(北京博奥森生物技术有限公司),自噬微管相关蛋白轻链3(LC3)抗体、Beclin-1抗体(北京博奥森生物技术有限公司);0.25 mm×25 mm针灸针(贵州安迪药业有限公司),英迪牌KWD-800I脉冲针灸治疗仪(广州康哲医疗器械有限公司), Morris水迷宫(上海欣软信息科技有限公司)。
1.3实验方法 将大鼠适应性饲养1周后随机分为假手术组、模型组、电针组、西药组,每组10只。除假手术组外,其余组大鼠均采用改良2-VO法进行血管性痴呆造模:造模前大鼠禁食12 h、禁水3 h。采用腹腔注射10%水合氯醛(0.35 mL/100 g)麻醉大鼠,待生命体征平稳后将其仰卧位固定在手术台上,取颈部正中切口,分离皮下组织及颈部肌肉,充分暴露颈总动脉,用动脉止血夹夹闭颈总动脉20 min后,将止血夹松开恢复供血10 min,再次夹闭颈总动脉20 min,反复上述操作3次,最后一次血流恢复10 min结束后,用4号手术线将颈总动脉永久结扎,缝合伤口并进行伤口消毒。模型评定方法参考文献[4]:手术后第5天进行水迷宫适应性训练,手术后第6天进行Morris水迷宫实验,以假手术造模大鼠航行定位实验中的逃避潜伏期均值为标准值,用血管性痴呆造模大鼠在航行定位实验中逃避潜伏期的均值与标准值先做差,再与标准值相除,结果大于20%即表示血管性痴呆模型造模成功。造模成功后,模型组及假手术组大鼠仰卧固定于鼠板上10 min,不针刺,固定结束后给予生理盐水10 mL/kg灌胃;电针组大鼠根据于氏头部分区法的分区标准选择神庭至囟会及向其左、右各1寸的平行线进行针刺治疗,针刺方向为向后下方平刺,深度为2 mm左右,针刺后连接电针仪,设置为疏密波,频率1~2 Hz,电针10 min后头部继续留针10 min, 针刺治疗结束后给予生理盐水10 mL/kg灌胃;西药组大鼠仰卧固定于鼠板上10 min,固定结束后给予吡拉西坦液(将吡拉西坦片研磨后与蒸馏水按照40 mg/mL的浓度进行配比)10 mL/kg灌胃。各组干预均1次/d,连续28 d。
1.4观察指标及方法
1.4.1Morris水迷宫实验 干预结束后,各组大鼠进行Morris水迷宫实验,其中第1~4天进行定位航行试验,第5天进行空间探索试验。每日将大鼠从标记点放入水中(尾部先入水,头朝池壁),大鼠全身进入水中后开始计时,找到平台登台10 s后停止计时,即为逃避潜伏期,每日每只大鼠进行4次实验,取平均值。第5天撤去平台后将大鼠从第一象限放入水中,记录大鼠2 min中内穿越原平台次数。
1.4.2海马CA1区神经细胞形态结构 水迷宫实验结束后,对各组大鼠进行麻醉、灌注、断头,取部分海马组织,放入4%多聚甲醛溶液固定、脱水、透明、梯度浸泡后进行HE染色,观察各组大鼠海马CA1区细胞形态结构。
1.4.3海马组织中TNF-α、IL-1β、IL-10含量取各组大鼠海马组织,制备成海马组织匀浆,4 ℃下3 000 r/min(离心半径6.0 cm)离心10 min,取上清液分装,参照酶联免疫试剂盒测定TNF-α、IL-1β、IL-10含量。
1.4.4海马组织中Beclin-1、LC3-Ⅰ、LC3-Ⅱ表达量 采用Western blot法检测:取海马组织,加入适量细胞裂解液,用超声波细胞粉碎机将细胞打碎成匀浆,抽取组织匀浆,加入2倍体积的蛋白抽提液颠倒混匀后,放入4 ℃或室温静置10 min,4 ℃下12 000 r/min(离心半径6.0 cm)离心10 min后,弃去上下两相液体,中间为蛋白膜,管中加入缓冲液,置入95 ℃水浴箱10 min左右,4 ℃下12 000 r/min(离心半径6.0 cm) 离心5 min,4 ℃过夜。根据BCA试剂盒使用数明书测定蛋白浓度并定量;凝胶电泳,转膜后加入一抗兔抗LC3、Beclin-1以及内参GAPDH孵育过夜,二抗孵育,显影曝光,导出图像,并用Image J软件对条带进行灰度分析,目的蛋白与内参GAPGH的灰度比值代表相对表达量。
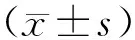
2 结 果
2.1各组大鼠Morris水迷宫学习记忆能力比较 假手术组、电针组、西药组大鼠逃避潜伏期均明显短于模型组(P均<0.05),穿越平台次数均明显多于模型组(P均<0.05),电针组大鼠逃避潜伏期、穿越平台次数与西药组比较差异均无统计学意义(P均>0.05)。见表1。
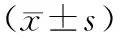
表1 假手术组和血管性痴呆各组大鼠Morris水迷宫实验逃避潜伏期和穿越平台次数比较
2.2各组大鼠海马CA1区神经细胞形态结构比较假手术组大鼠海马CA1区神经细胞形态规则,分布均匀,排列整齐,细胞核饱满清晰,细胞质丰富,无明显神经元死亡;模型组大鼠海马CA1区神经细胞形态不规则,分布混乱,排列疏松,细胞核固缩,胞浆浑浊,神经元明显缺失;与模型组比较,电针组和西药组大鼠海马CA1区神经细胞形态较规则,分布较均匀,排列较紧密,核膜核仁较清楚,可见少量细胞核固缩,坏死神经元较少,电针组和西药组差别不明显。见图1~4。
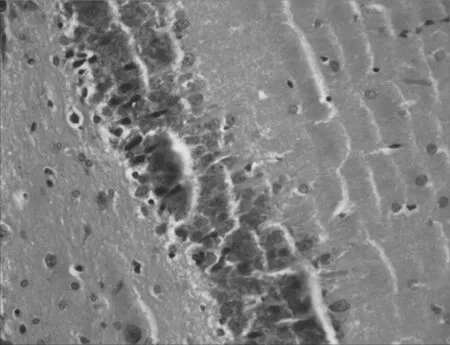
图1 假手术组大鼠海马CA1区神经细胞形态结构(×400)
2.3各组大鼠海马组织中TNF-α、IL-1β、IL-10含量比较 假手术组、电针组、西药组大鼠海马组织中TNF-α、IL-1β含量均明显低于模型组(P均<0.05),电针组与西药组比较差异均无统计学意义(P均>0.05);模型组大鼠海马组织中IL-10含量明显高于假手术组(P<0.05),电针组和西药组均明显高于模型组(P均<0.05),电针组与西药组比较差异无统计学意义(P>0.05)。见表2。
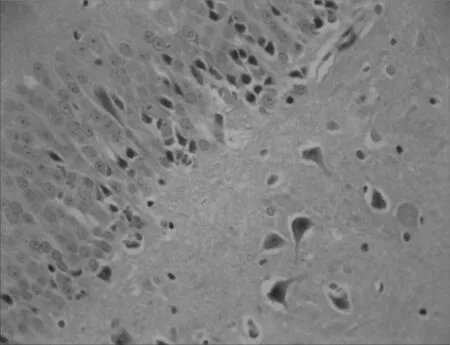
图2 模型组血管痴呆性大鼠海马CA1区神经细胞形态结构(×400)
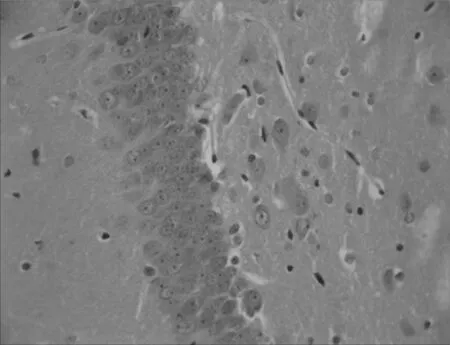
图3 电针组血管痴呆性大鼠海马CA1区神经细胞形态结构(×400)
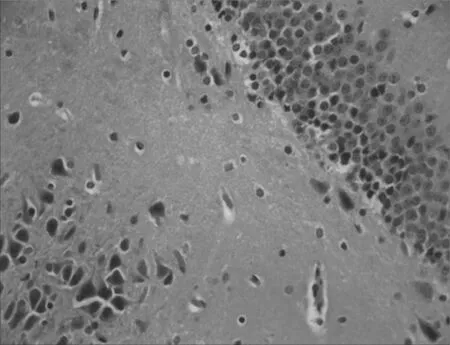
图4 西药组血管痴呆性大鼠海马CA1区神经细胞形态结构(×400)

表2 假手术组和血管性痴呆各组大鼠海马组织中TNF-α、IL-1β、IL-10含量比较
2.4各组大鼠海马组织中Beclin-1相对表达量及LC3-Ⅱ/LC3-Ⅰ比较 假手术组、电针组、西药组大鼠海马组织中Beclin-1相对表达量及LC3-Ⅱ/LC3-Ⅰ均明显低于模型组(P均<0.05),电针组与西药组比较差异均无统计学意义(P均>0.05)。见图5及图6。
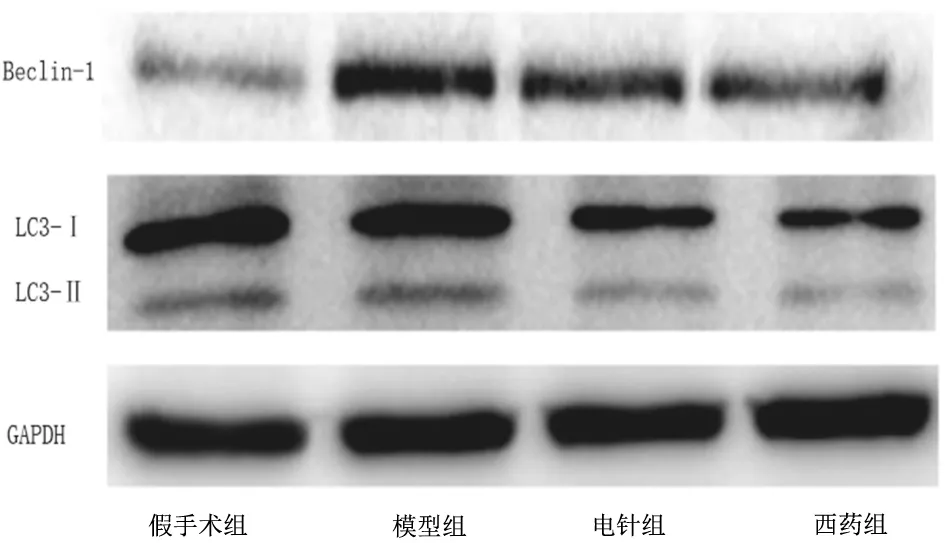
图5 假手术组和血管性痴呆各组大鼠海马组织中Beclin-1、LC3-Ⅰ、LC3-Ⅱ表达情况
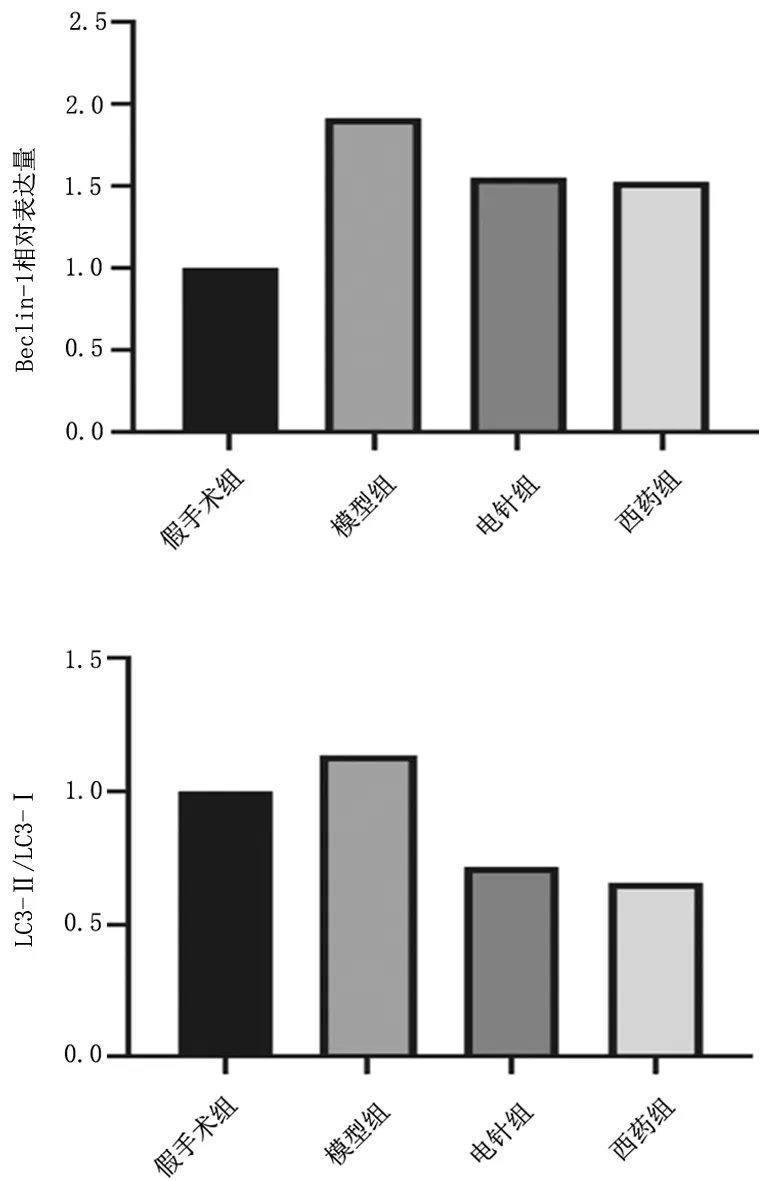
图6 假手术组和血管性痴呆各组大鼠海马组织中Beclin-1相对表达量及LC3-Ⅱ/LC3-Ⅰ比较
3 讨 论
血管性痴呆在中医中属于“呆病”“痴呆”“善忘”等范畴,其病位在脑。《医林改错》中提出了“灵机记性,不在心在脑”。《类证治裁·健忘》亦提出“老人健忘者,脑渐空也”。于氏头针是于致顺教授通过多年临床经验与动物实验总结而出的针刺方法,该针法将头部分为七区,并通过丛刺、长留针和间断行针从而产生“场”,使针刺的刺激效果更大,针刺范围更广。近年来动物实验研究表明,头穴丛刺法可以通过下调血管性痴呆大鼠p-PERK、p-elF2a、p-p38MAPK蛋白表达,增加海马乙酰胆碱(Ach)、多巴胺(DA)、5-羟色胺(5-HT)的含量,抑制炎症反应,减轻海马神经元突触损伤,从而改善大鼠痴呆病情[5-7]。临床研究表明,头穴丛刺法可以降低血管性痴呆患者血清低氧诱导因子-1α(HIF-1α)水平,调节血脂,改善患者认知功能,提高生活质量[8-10]。本实验选用神庭至囟会及向其左、右各1寸的平行线的方法进行针刺治疗,此法对前额叶进行了强刺激,其中神庭穴主治神识病症、癫疾风痫,囟会穴具有疏风醒脑、清热安神之功效,故此法有醒脑开窍、填髓益智之功。本实验结果显示,电针组大鼠的逃避潜伏期明显短于模型组,穿越平台次数均明显多于模型组,提示电针治疗可以改善血管性痴呆大鼠学习记忆能力。
血管性痴呆是仅次于阿尔茨海默病的第二大常见痴呆类型,其发病特点为大脑缺血后引起脑组织炎症反应、氧化应激等一系列反应,进一步造成脑损伤而导致认知功能异常[11]。参与炎性反应的炎性免疫因子主要分为两大类,一种为促炎细胞因子,如TNF-α、IL-1β、IL-6等;另一种为抗炎细胞因子,如IL-4、IL-10等[12-13]。TNF-α是促炎反应的起始因子之一,可以促进T细胞产生各种炎症因子[14],脑组织缺血发生时TNF-α含量明显提高,可加重脑组织损伤[15]。IL-1β具有多效活性,可以通过TNF-α刺激内皮细胞合成而来,两者共同作用时可导致脑损伤加剧[16]。杨波等[17]研究发现,血管性痴呆患者血清IL-6、IL-8水平较正常人明显增高,说明炎症反应与血管性痴呆相关。梁云云等[18]研究报道,银杏内酯联合高压氧治疗可通过降低血清炎症因子水平而改善血管性痴呆患者认知能力。周雨慧等[19]研究表明不同剂量地黄饮子加减方可降低血管性痴呆大鼠脑组织中IL-6、IL-1β、TNF-α含量,改善大鼠的学习及认知能力。IL-10为小胶质细胞分泌而成的一种抗炎因子,可以通过抑制单核巨噬细胞释放炎性介质,从而抑制炎症反应[20];其在神经元稳态和细胞存活中起重要作用,并通过与脑中神经胶质细胞群体上存在的特定细胞表面受体相互作用来介导其对细胞的作用[21]。本实验结果显示,电针组大鼠海马组织中TNF-α、IL-1β含量均明显低于模型组,而IL-10含量明显高于模型组,说明电针具有抑制炎症反应的作用。
自噬是细胞自我消化的过程,是维持细胞稳态的重要途径[22]。然而在应激状态下,自噬是一把双刃剑,一方面自噬可以促进细胞生存,清除受损细胞和异常蛋白;另一方面,当自噬过度发生时可能会导致细胞内重要成分被消除,从而导致细胞死亡。Beclin-1是自噬过程中的关键蛋白之一,是首个被确认介导哺乳细胞自噬过程的基因,参与自噬的起始阶段。LC3被认为是自噬体形成起始阶段的重要蛋白,与Beclin-1蛋白共同参与自噬体的形成。自噬未发生时,LC3的C末端被Atg4修饰后产生LC3-Ⅰ;而当自噬发生时,LC3-Ⅰ进一步活化转变为有活性的 LC3-Ⅱ。因此, LC3-Ⅱ/LC3-Ⅰ比值可以反映自噬的发生。刘斌等[23]研究表明,血管性痴呆大鼠术后CA1区Beclin-1蛋白表达水平及LC3Ⅱ/LC3Ⅰ比值明显高于假手术组,自噬抑制组两种蛋白表达均较血管性痴呆组下降,表明自噬在血管性痴呆发病中起重要作用,自噬抑制剂的干预能明显改善血管性痴呆大鼠的学习及记忆能力。本实验结果显示,模型组大鼠海马组织中Beclin-1表达量及LC3-Ⅱ/LC3-Ⅰ均明显高于假手术组,说明血管性痴呆大鼠发生自噬;电针组大鼠海马组织中Beclin-1表达量及LC3-Ⅱ/LC3-Ⅰ均明显低于模型组,说明电针治疗可以抑制血管性痴呆自噬反应,减轻脑损伤。
综上所述,电针治疗可以降低血管性痴呆大鼠海马组织中TNF-α、IL-1β的含量及Beclin-1的表达量和LC3-Ⅱ/LC3-Ⅰ,提高IL-10的含量,提示电针治疗可以抑制炎症反应和自噬的发生,从而达到改善血管性痴呆大鼠认知能力及保护脑组织的作用。
利益冲突:所有作者均声明不存在利益冲突。
