人肠道病毒71 型病毒样颗粒的制备及免疫原性评价
2021-12-21王文伟胡海涛蔡蓓蓓仝光杰何成楼觉人
王文伟,胡海涛,蔡蓓蓓,仝光杰,何成,楼觉人,
1.上海至成生物科技有限公司,上海200051;2.上海生物制品研究所有限责任公司,上海200051
人肠道病毒 71 型(enterovirus 71,EV71)属于小RNA 病毒科(Picornaradae)肠道病毒属(Enterovirus),病毒颗粒呈球形,无包膜,二十面体立体对称,大小在24 ~30 nm。EV71 是一种单股正链RNA 病毒,基因组全长约7 400 bp,仅有1 个开放阅读框(open reading frame,ORF),编码 1 种多聚蛋白,该多聚蛋白可裂解为 3 种前体蛋白(P1、P2 和 P3),P1 蛋白进一步裂解为 4 种结构蛋白(VP1、VP2、VP3 和 VP4),P2 和 P3 蛋白可裂解为 7 种非结构蛋白(2A、2B、2C、3A、3B、3C 和 3D)[1]。4 种结构蛋白构成 EV71的衣壳,VP1、VP2、VP3 和 VP4 首先形成原聚体(protomer),5 个原聚体再形成 1 个 5 聚体(pentamer),12 个5 聚体最终组装成病毒的衣壳[2]。7 种非结构蛋白参与病毒RNA 的复制、病毒粒子的组装和释放等多种生物学过程,是抗EV71 药物研发的重要靶点[3-5]。
EV71 主要感染婴幼儿,可引起疱疹性咽峡炎和手足口病(hand,foot and mouth disease,HFMD)等疾病,是 HFMD 的主要病原体之一[6]。HFMD 以发热及手、足和口腔等部位斑丘疹或疱疹为主要临床特征,多为自限性疾病,预后良好,少数患儿会引发无菌性脑膜炎、脑炎、脑脊髓炎、急性弛缓性麻痹和神经源性肺水肿等并发症,严重的会导致死亡[7-8]。
疫苗接种是预防EV71 感染的重要措施,截至目前,我国已有3 家EV71 疫苗上市,均为全病毒灭活疫苗[9-11]。本研究旨在利用巴斯德毕赤酵母制备EV71 病毒样颗粒(virus-like particles,VLPs),开发重组EV71 VLPs 疫苗。
1 材料与方法
1.1 质粒、菌株及病毒 pPIC3.5K 改造质粒(系在pPIC3.5K 质粒的 5′AOX1 上游和 3′AOX1 下游插入同尾酶BglⅡ和BamHⅠ获得)、大肠埃希菌(Top10菌株)、巴斯德毕赤酵母(KM71 菌株)和灭活EV71均由上海生物制品研究所有限责任公司第二研究室保存。
1.2 主要试剂及仪器 限制性内切酶(BglⅡ、MluⅠ、EcoRⅠ、NotⅠ、BamHⅠ、Kpn 2Ⅰ)、T4 DNA Ligase、1 kb DNA marker、蛋白质预染marker 和阳离子交换层析填料均购自美国Thermo 公司;琼脂糖凝胶DNA回收试剂盒购自天根生化科技(北京)有限公司;LB培养基、氨苄青霉素、生物素、YPD 培养基和TMB 显色试剂盒均购自生工生物工程(上海)股份有限公司;酵母提取物、基础酵母氮源(YNB)和胰蛋白胨均购自英国Oxoid 公司;小鼠抗EV71 VP1 多克隆抗体购自英国Abcam 公司;HRP 标记的兔抗小鼠IgG 购自美国Millipore 公司;凝胶过滤层析介质购自博格隆(上海)生物技术有限公司;A(lOH)3佐剂购自丹麦Brenntag Group 公司;凝胶成像分析系统购自美国Bio-Rad 公司;高压均质匀浆机机购自苏州ATS 工业系统有限公司;5 L 细菌发酵罐购自上海保兴生物设备工程有限公司;ECL 显色试剂盒和蛋白质纯化系统购自美国GE 公司;Nano S90 纳米粒度分析仪购自英国Malvern 公司;M2e 多功能酶标仪购自美国Molecular Devices 公司;透射电子显微镜(JEM-2100)购自日本电子株式会社。
1.3 实验动物 SPF 级 BALB / c 小鼠 32 只,雌性,5 ~6 周龄,体重16 ~20 g,购自上海西普尔必凯实验动物有限公司,动物合格证号:SCXK(沪)2013-0016。本实验对小鼠的所有处理均以科研为目的进行养殖和使用,且按照《关于善待实验动物的指导性意见》动物伦理相关规定进行(国科发财字[2006]398 号)。
1.4 重组表达质粒的构建 EV71(GenBank:JX02-5561.1)P1 和3CD 原始序列经密码子优化后,由南京金斯瑞生物科技有限公司全基因合成。将P1 和3CD 序列通过EcoRⅠ和NotⅠ酶切位点分别插入pPIC3.5K 改造质粒中,得到P1-pPIC3.5K 和3CD-pPIC3.5K 质粒。将3CD-pPIC3.5K 质粒用BglⅡ和MluⅠ双酶切,回收3CD 表达盒,通过BamHⅠ和MluⅠ酶切位点插入P1-pPIC3.5K 质粒中,得到P1-3CD-pPIC3.5K 质粒(P1 单拷贝)。将 P1-pPIC3.5K质粒用BglⅡ和MluⅠ双酶切,回收P1 表达盒,通过BamHⅠ和MluⅠ酶切位点插入P1-3CD-pPIC3.5K质粒中,得到 P1-3CD-P1-pPIC3.5K 质粒(P1 两拷贝)。各质粒均经BglⅡ和MluⅠ双酶切鉴定,0.8%琼脂糖凝胶电泳分析。
1.5 质粒的转化 取 5 μg P1-3CD-P1-pPIC3.5K 质粒,加入2 μL Kpn2Ⅰ限制性内切酶,55 ℃酶切4 h,对质粒进行线性化。质粒酶切线性化产物采用酚/氯仿抽提,-20 ℃预冷的无水乙醇沉淀,重新溶解于20 μL ddH2O 中。取 80 μL 巴斯德毕赤酵母 KM71感受态细胞加入冰上预冷的电击杯中,再加入10 μL线性化质粒,充分混均,1 500 V,5 ms 电击转化。将转化后的巴斯德毕赤酵母KM71 感受态细胞均匀涂布于MD 平板上(1.5%琼脂,2%葡萄糖,1.34%YNB,4 × 10-5%生物素),放置于 28 ℃恒温箱中静置培养72 h。
1.6 目的蛋白的诱导表达 在24 孔酵母筛选板中每孔加入1.0 mL YPD 培养基(2%葡萄糖,1%酵母提取物,2%胰蛋白胨),于MD 平板上挑取单克隆菌落接种至YPD 培养基中,放置于28 ℃摇床中,250 r / min 振摇 16 h。从 24 孔板中吸取 0.1mL 菌液,接种至3.0 mL BMGY 培养基中[2%蛋白胨,1.34% YNB,1%酵母提取物,100 mmol / L 磷酸钾(pH 6.0),4 × 10-5%生物素,1%甘油],放置于 28 ℃摇床中,250 r / min 振摇过夜至菌体饱和。将24 孔板放置于2 ~8 ℃冰箱中静置,至孔内菌体完全沉淀,吸弃上层培养基,添加1.0 mL BMMY 培养基[2%蛋白胨,1.34% YNB,1%酵母提取物,100 mmol / L磷酸钾(pH 6.0),4 × 10-5%生物素,1%甲醇],放置于 28 ℃摇床中,250 r / min 振摇 72 h,诱导目的蛋白表达。每孔吸取1.0 mL 诱导后菌液,13 000 × g离心1 min,弃上清,加入等量磁珠,用0.6 mL PBS缓冲液重悬菌体,置磁珠破碎仪中破碎3 次。破碎后的菌体13 000 × g 离心2 min,收集破菌上清。
1.7 高表达克隆的筛选 采用Western blot 法。酵母菌体破碎上清经12% SDS-PAGE 后,电转印至PVDF膜上,以5%脱脂奶粉4 ℃封闭过夜;PBST 洗膜3次,加入小鼠抗EV71 VP1 多克隆抗体(1︰2 000 稀释),置 37 ℃孵箱中孵育 1 h;PBST 洗膜 3 次,加入HRP 标记的兔抗小鼠 IgG(1︰20 000 稀释),37 ℃孵育 1 h;PBST 洗膜 3 次,用 ECL 试剂盒显色。
1.8 5 L 发酵罐发酵 将筛选到的高表达克隆接种于YPD 平板上,28 ℃培养48 h。用接种环挑取1 环菌落接种于50 mL YPD 液体培养基中,置28 ℃摇床中,250 r / min 振摇培养至菌液 A600= 5 ~ 10,取25 mL 种子,接种至装有2.5 L 无机盐培养基的5 L 发酵罐中,发酵参数设置为:溶氧30%,pH 5.0,温度28 ℃;采用两阶段发酵工艺:在生长阶段,菌体以甘油为碳源,待菌体湿重至 300 ~ 400 g / L,停止补加甘油,待培养基中甘油耗尽后,开始补加甲醇,诱导目的蛋白表达;在诱导阶段,甲醇浓度维持在0.1% ~0.5%之间,诱导 40 h 后,6 000 × g 离心 30 min,收集发酵菌体。
1.9 EV71VLPs 的分离纯化 称取发酵菌体200 g,重悬于1 L 破菌缓冲液中,用高压均质匀浆机于1 200 bar破碎 3 次。收集破碎菌体,于 4 ℃,22 000 × g 离心30 min,收集破菌上清,采用POROS 50HS 阳离子交换层析粗纯EV71 VLPs,收集阳离子交换层析蛋白洗脱峰,采用Bestarose 6FF 凝胶体积排阻层析精纯EV71 VLPs。纯化的 EV71 VLPs 经 4% ~ 20%还原型SDS-PAGE 分析。
1.10 纯化EV71 VLPs 的透射电镜观察 将纯化的EV71 VLPs 滴加于铜网上,再滴加2%磷钨酸溶液进行负染,置透射电子显微镜下观察EV71 VLPs 的颗粒形态。
1.11 纯化EV71 VLPs 的动态光散射分析 将纯化的EV71 VLPs 用0.22 μm 滤膜过滤后,采用Nano S90纳米粒度分析仪测定EV71 VLPs 的流体力学粒径。
1.12 动物分组及免疫 将 32 只 BALB / c 小鼠随机分为 4 组:0.05、0.5、5 μg 3 个剂量 EV71 VLPs +佐剂组和空白佐剂对照组,每组8 只。将纯化的不同剂量EV71 VLPs 与100 μg / mL A(lOH)3佐剂等体积混匀,置4 ℃搅拌吸附过夜。经腹腔免疫小鼠,免疫后4 周经尾静脉采血,分离血清,检测抗体水平。
1.13 免疫小鼠血清抗体水平的检测 采用ELISA法。用灭活 EV71 包被 96 孔板,100 ng /孔,4 ℃包被过夜;PBST 洗涤3 次,加入含5%脱脂奶粉的PBST,300 μL / 孔,37 ℃封闭 2 h;PBST 洗涤 3 次后拍干待用。待检血清用含1% BSA 的PBST 稀释100 倍,再倍比稀释,取稀释后的血清加入96 孔板中,100 μL/孔,每个稀释度设2 个复孔,37 ℃孵育1 h;PBST 洗涤 3次,加入HRP 标记的兔抗小鼠 IgG(1︰10 000 稀释),100 μL /孔,37 ℃孵育 1 h;PBST 洗涤 3 次,加入TMB 底物,100 μL / 孔,避光显色 5 min;加入 50 μL 2 mol / L 硫酸终止显色,置酶标仪中于波长450 nm处读取A 值。若待检血清A450值≥阴性对照血清A450值的2.1 倍,即判为抗体阳性,抗体滴度定义为ELISA 抗体阳性血清对应的最大血清稀释倍数。计算抗体的几何平均滴度(geometric mean titer,GMT)。
1.14 统计学分析 采用SPSS 21 软件进行统计学分析,对小鼠ELISA 抗体滴度进行对数变换后,采用单因素方差分析(0ne-Way ANOVA)对不同剂量组的抗体水平进行比较,以P <0.05 为差异有统计学意义。
2 结 果
2.1 重组表达质粒的酶切鉴定 质粒的BglⅡ和MluⅠ双酶切产物经0.8%琼脂糖凝胶电泳分析,P1-pPIC3.5K 质粒可见 2 400、4 000 和 5 600 bp 大小的条带,3CD-pPIC3.5K 质粒可见 2 400、3 300 和 5 600 bp 大小的条带,P1-3CD-pPIC3.5K 质粒可见 2 400、5 600 和7 200 bp 大小的条带,P1-3CD-P1-pPIC3.5K 质粒可见2 400、5 600 和11 100 bp 大小的条带,各质粒酶切产物条带均与预期一致,表明质粒构建正确,见图1。

图1 各质粒的双酶切(BglⅡ / MluⅠ)鉴定Fig.1 Restriction map of recombinant plasmids (BglⅡ /MluⅠ)
2.2 高表达克隆的筛选 不同克隆的破菌上清经Western blot 分析,6、9 和 10 号克隆未检测到 EV71 VP1 蛋白表达,11 号克隆的表达量最高,见图2。选择11 号克隆用于后续发酵罐发酵。

图2 Western blot 筛选EV71 VP1 高表达菌株Fig.2 Screening of KM71 transformants for high expression of EV71 VP1 protein by Western blot
2.3 纯化EV71 VLPs 的鉴定
2.3.1 SDS-PAGE 分析 纯化的EV71 VLPs 经4%~20%还原型SDS-PAGE 分析,可见3 条目的蛋白条带,分别为 VP0、VP1 和 VP3,与预期一致,纯化后EV71 VLPs 的纯度大于90%,见图3。

图3 纯化 EV71 VLPs 的SDS-PAGE 分析Fig.3 SDS-PAGE profile of purified EV71 VLPs
2.3.2 透射电镜观察 纯化的EV71 VLPs 在透射电镜下呈典型的VLPs 形态,颗粒直径约30 nm,与天然的EV71 大小一致,表明EV71 P1 蛋白在巴斯德毕赤酵母中可被自身的重组3CD 蛋白酶切割为VP0、VP1 和 VP3,切割后的 VP0、VP1 和 VP3 可自发组装成VLPs,见图4。

图4 纯化EV71 VLPs 的透射电镜观察Fig.4 Transmission electron microscopy of purified EV71 VLPs
2.3.3 动态光散射分析 分析结果显示,纯化的EV71 VLPs 的平均流体力学直径为35.82 nm,颗粒分布均一,见图5。
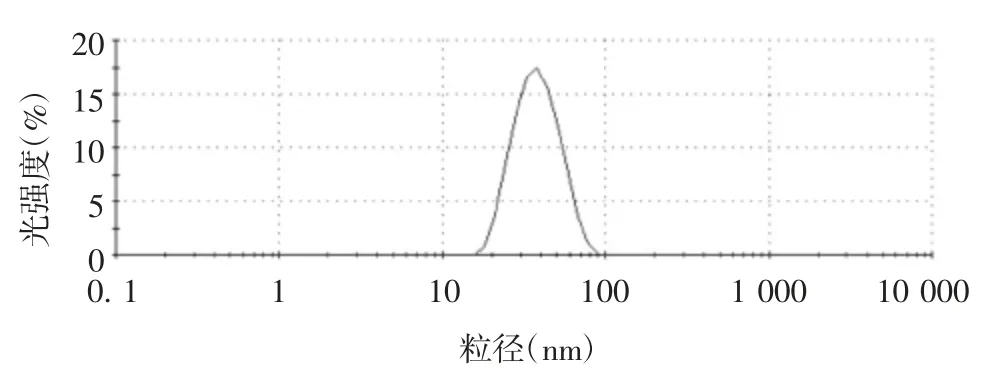
图5 纯化EV71 VLPs 的动态光散射分析Fig.5 Dynamic light scattering analysis of EV71 VLPs
2.4 免疫小鼠血清的抗体水平 经0.05、0.5 和5 μg EV71 VLPs 单次免疫后,小鼠血清中ELISA 抗体的GMT 分别为119、800 和3 200,不同剂量组之间抗体水平差异有统计学意义(F = 10.005,P = 0.001)。
3 讨 论
EV71 自1969 年在美国加利福尼亚州中枢神经系统感染的婴儿粪便标本中被首次分离以来[12],已在全球范围内多次暴发流行[13-15]。2007 — 2008 年,EV71 相继在我国山东临沂[16]和安徽阜阳[17]等地引起较大规模的HFMD 暴发流行,严重威胁儿童健康。EV71 在我国的持续广泛流行,已成为重大的公共卫生问题。2008 年5 月,HFMD 被纳入国家丙类法定报告传染病,每年报告的病例数均高居法定报告传染病之首。2008 — 2018 年,全国累计报告HFMD病例20 537 199 例,其中重症病例157 065 例,死亡病例 3 668 例[18]。EV71 是导致 HFMD 重症和死亡病例的优势病原体,2008 — 2018 年,在实验室确诊的2 523 例死亡病例中,有2 323 例是由EV71 感染所致[19]。
目前尚无针对EV71 感染的特效药,接种疫苗是控制病毒传播的重要措施[20]。我国已有3 种EV71灭活疫苗上市,尚无重组EV71 疫苗上市的报道。在重组EV71 疫苗的研发方面,VLPs 疫苗是研究的热点,VLPs 是由重组表达的病毒衣壳蛋白组装而成的病毒样结构,不含病毒的遗传物质,因此无感染性,同时,VLPs 又保持了与天然病毒相类似的抗原结构,可有效激发机体产生免疫应答[21-22],是制备重组疫苗的优良抗原。目前已有乙型肝炎、戊型肝炎和人乳头瘤病毒的重组VLPs 疫苗产品上市,均显示出良好的安全性和有效性。
本研究利用毕赤酵母表达系统制备EV71 VLPs,按照毕赤酵母密码子的偏好性对EV71 的P1 和3CD进行了核苷酸序列的优化,并将其插入毕赤酵母基因组中,甲醇诱导目的蛋白表达。结果表明,P1 蛋白在毕赤酵母细胞内成功表达,且可被重组3CD 蛋白酶切割为 VP0、VP1 和 VP3,切割后的 VP0、VP1 和VP3 能够在酵母细胞中自发组装成VLPs。本研究建立了一种纯化EV71 VLPs 的新工艺,通过两步柱层析即可从毕赤酵母破菌上清中获得较高纯度的EV71 VLPs,该工艺简便高效,易于放大生产,为EV71 VLPs 的大规模制备奠定了基础。采用ELISA 法评价重组EV71 VLPs 的免疫原性,结果显示,EV71 VLPs经铝佐剂吸附后,单次免疫小鼠即可产生较高滴度的抗体,且抗体滴度呈明显的剂量依赖效应,显示出良好的免疫原性。但由于该ELISA 法的局限性,无法完全反映血清中保护性抗体的水平,后续还需建立EV71 中和抗体检测方法,并在动物模型上评价EV71 VLPs 疫苗的保护效果。
综上所述,本研究利用巴斯德毕赤酵母表达系统成功制备了EV71 VLPs,为重组EV71 VLPs 疫苗的开发提供了参考。
