H1N1 型流感病毒血凝素蛋白胞外段的真核表达及免疫原性分析
2021-12-21刘京年悬悬龚铮吕传硕邓涛马宁周蓉张国梅乐洋张哲罡刘博张家友李妍玲王鹏飞杨晓明
刘京 ,年悬悬 ,龚铮 ,吕传硕 ,邓涛 ,马宁 ,周蓉 ,张国梅 ,乐洋 ,张哲罡 ,刘博 ,张家友 ,李妍玲 ,王鹏飞 ,杨晓明
1.武汉生物制品研究所病毒性疫苗研究二室,湖北武汉430207;2.国家联合疫苗工程技术研究中心,湖北武汉430207;3.山东省青岛市即墨区中医医院,山东青岛266220;4.山东省青岛市即墨区七级卫生院,山东青岛266220;5.中国生物技术股份有限公司,北京100029
流感病毒感染是一个全球性的公共卫生问题,据估计,全球流感每年发病近10 亿例,其中300 万例 ~ 500 万例为重症病例,30 万例 ~ 50 万例为死亡病例[1]。接种流感病毒疫苗是对抗感染的有效策略。目前,市售流感疫苗有3 种:基于鸡胚或细胞的灭活流感疫苗、减毒流感活疫苗和由杆状病毒表达的重组流感疫苗[2]。基于鸡胚或细胞的灭活流感疫苗生产周期长,在鸡胚培养中产生适应性突变可能会积累并潜在地改变病毒株的抗原性[3]。基因重组疫苗因其具备速度快和灵活性的优势,已成为下一代疫苗研究的热点[4]。
血凝素(hemagglutinin,HA)是一种重要的流感病毒表面糖蛋白,负责与靶细胞上的唾液酸受体结合,促进病毒与宿主细胞的融合[5],同时也是流感病毒刺激机体产生免疫反应的主要靶点。因此,HA 是当前开发中的季节性流感疫苗和通用流感疫苗的理想候选抗原。HA 由球状头部和茎部区域组成,球状头部包含大多数可变和免疫显性表位,针对该区域产生的抗体可通过阻断病毒与宿主细胞的融合,以及通过抗体依赖的细胞毒性消除感染的宿主细胞以提供中和保护[6]。球状头部区域内外的保守和中和表位在进化过程中被选择为次显性表位,因为这些表位的内在结构特征,使其在免疫学上沉默,难以靶向[7-9]。
本研究以H1N1 型流感病毒HA 胞外段蛋白编码基因的优化序列为目的片段,连接至载体KS001,构建重组质粒KS001 / HA,采用真核表达系统分泌性表达HA 胞外段蛋白,并辅以佐剂免疫小鼠,通过病毒微量中和试验(microneutralization test,MNT)检测免疫后小鼠血清抗体效价,以评估重组HA 胞外段蛋白的免疫原性,以期为后续制备重组流感亚单位疫苗奠定基础。
1 材料与方法
1.1 毒株、载体及细胞 流感毒株 A / Singapore /GP1908 / 2015 IVR-180(16 / 270)和 MDCK 细胞由武汉生物制品研究所有限责任公司病毒性疫苗研究二室保存;载体KS001 和Expi293F 细胞由武汉生物制品研究所有限责任公司抗体研究室保存。
1.2 实验动物 SPF 级 BALB / c 小鼠,雌性,6 ~ 8周龄,体重18 ~ 22 g,由武汉生物制品研究所有限责任公司实验动物中心提供,动物生产许可证号:SCXK(鄂)2017-0013,动物使用许可证号:SYXK(鄂)2014-0012。本实验均以科研为目的进行小鼠的养殖和使用。
1.3 主要试剂及仪器 H1N1 型流感病毒裂解疫苗原液由武汉生物制品研究所有限责任公司病毒性疫苗研究二室保存;OPM-293CD05 Medium、OPM-293 ProFeed 购自上海奥浦迈生物科技股份有限公司;PNGaseF 酶购自美国 NEB 公司;DNA marker、HindⅢ、EcoRⅠ和SalⅠ酶购自日本TaKaRa 公司;Transporter 5TMTransfection Reagent 购自美国Polyscience 公司;绵羊多克隆标准抗血清购自NIBSC;HRP 标记的驴抗绵羊IgG 购自生工生物工程(上海)股份有限公司;BCA 定量分析试剂盒、预染蛋白marker 购自美国Thermo 公司;质粒提取试剂购自德国QIAGEN 公司;MA135 佐剂购自成都迈科康生物科技有限公司;Capto Q 离子交换层析柱购自美国GE 公司。
1.4 目的基因片段选取及重组表达质粒的构建 根据GISAID 收录的人流感毒株A/Singapore/GP1908 /2015 IVR-180(16 / 270)HA 全长氨基酸序列(EPI_ISL_236138),应用 TMHMM 2.0 软件分析 HA 蛋白全长氨基酸序列,确定1 ~ 530 aa 为胞外段。将相对应的胞外段基因序列根据哺乳动物细胞密码子偏好性进行密码子优化,并在上游加入HindⅢ酶切位点及Kozak 序列(gccacc),下游加入EcoRⅠ酶切位点,将重新编排后的基因序列送金斯瑞生物科技股份有限公司进行合成。将合成的目的基因片段与KS001 载体连接,构建重组质粒 KS001 / HA,将其进行转化放大及菌液PCR 鉴定。根据重组质粒胞外段基因序列的位置设计引物(Primer1:5′-GCAGCTCCTTGCTCCTAACAG-3′,Primer2:5′-TATGCATTGGCCATGTGCCAG-3,扩增片段大小为2 400 bp)。PCR反应体系为:ddH2O 20 μL,MIX 25 μL,DNA 模板1 μL,上下游引物各 2 μL。反应条件为:95 ℃预变性 3 min;95 ℃ 15 s,55 ℃ 20 s,72 ℃ 4 min,共 30 个循环;72 ℃延伸5 min。PCR 产物经1%琼脂糖凝胶电泳鉴定。参照质粒抽提试剂盒说明书提取质粒,进行双酶切(HindⅢ和EcoRⅠ)鉴定,并送生工生物工程(上海)股份有限公司测序,测序正确的质粒命名为 KS001 / HA。
1.5 细胞转染及蛋白表达 复苏Expi293F 细胞,采用 OPM-293CD05 Medium,于 37 ℃,8% CO2条件下,120 r / min 摇床培养,连续传代 3 次。转染前 1 h,将细胞按 1 × 106个 / mL 接种至新鲜培养基中,按Transporter 5TMTransfection Reagent 转染说明书进行转染,16 ~ 22 h 后添加 5% OPM-293 ProFeed,培养72 ~ 96 h,当细胞活率低于80%时收获上清,经超速离心去除细胞碎片。
1.6 表达产物的鉴定
1.6.1 SDS-PAGE 及Western blot 将收获的样品分别与还原 4 × loading buffer 和非还原 4 × loading buffer 混合处理,同时以H1N1 型流感病毒裂解疫苗原液为阳性对照,Expi293F 细胞培养上清液为阴性对照,进行12% SDS-PAGE 鉴定,恒压 120 V 电泳1 h;考马斯亮蓝染色,脱色液脱色至背景透明,将蛋白条带转移至NC 膜上,用5%BSA 37 ℃孵育1 h;PBST 洗涤5 次,加入绵羊多克隆标准抗血清(1 ∶5 000 稀释),4 ℃孵育过夜;PBST 洗涤 5 次,加入HPP 标记的驴抗绵羊 IgG(1 ∶5 000 稀释),37 ℃孵育 1 h;PBST 洗涤 5 次,加入 ECL 化学发光液,用蛋白发光印记仪曝光并拍照。
1.6.2 蛋白N-糖基化分析 利用PNGaseF 酶处理样品,37 ℃孵育 2 h;与还原 4 × loading buffer 混合处理变性后进行12% SDS-PAGE 分析,恒压120 V 电泳1 h,考马斯亮蓝染色,脱色液脱色至背景透明,同时利用Western blot 进行验证,方法同1.6.1 项。
1.7 表达产物的纯化及鉴定 利用AKTA purifier 系统,使用Capto Q 离子交换层析柱纯化收获的蛋白样品。按说明书制备离子交换柱,用5 倍柱体积的10 mmol / L PB 缓冲液(pH 8)平衡层析柱,收获的样品经30 kD 膜包进行超滤后与层析柱结合,然后用3 倍柱体积的PB 缓冲液平衡层析柱,用含0.2 mol/L NaCl 的PB 缓冲液洗脱蛋白,收集样品,进行12%SDS-PAGE 分析,BCA 试剂盒测定蛋白浓度。
1.8 免疫原性分析
1.8.1 动物免疫 将BALB / c 小鼠随机分为11组:阴性对照组、抗原组(3.75、7.5、15、30 和 60 μg HA 蛋白)和佐剂配伍组(3.7、7.5、15、30 和 60 μg HA 蛋白 + MA135 佐剂),每组 10 只。分别于第0、28 天经腿部肌肉依次注射0.2 mL PBS、0.2 mL HA蛋白、0.2 mL HA 蛋白 + MA135 佐剂,佐剂使用剂量为0.1 mL。2 次免疫后第28 天眼球摘除采血,经MNT 检测抗体效价。
1.8.2 MNT 参照世界卫生组织监测网络:实验室诊断和病毒手册的描述进行[10]。每个血清样本56 ℃水浴灭活30 min。将灭活后的血清样本在VPSFM细胞培养基中倍比稀释(1 ∶5 ~ 1 ∶640),稀释后体积为 50 μL,再与 50 μL 经 TPCK 胰蛋白酶处理的 200 TCID50/ 100 μL 的流感病毒混合,使血清稀释倍数变为 1 ∶10 ~ 1 ∶1 280,37 ℃孵育 1 h;将100 μL 血清与病毒混合物转移至铺满单层MDCK细胞的96 孔板中,37 ℃孵育3 d;观察细胞病变情况。取上清25 μL,检测抗体效价,完全抑制血凝作用的最高血清稀释倍数的倒数被定义为抗体效价。
1.9 统计学分析 应用Graphpad 8 软件进行统计学分析,组间差异的比较采用Kruskal-Wallis test 检验,以P < 0.05 为差异有统计学意义。
2 结 果
2.1 重组表达质粒的鉴定 重组表达质粒KS001/HA经菌液PCR 鉴定,可见约2 400 bp 的目的基因条带和800 bp 的载体条带,大小与预期相符,见图1。重组表达质KS001 / HA 的双酶切产物经1%琼脂糖凝胶电泳分析,分别可见约1 600 bp 的目的条带及10 000 bp 的载体条带,大小与预期相符,见图2。测序结果显示,插入的HA 胞外段基因片段正确,表明重组真核表达质粒构建正确。
图1 HA 蛋白胞外段序列PCR 产物电泳图Fig.1 Electrophoretic profile of PCR product of extracellular segment of HA protein

图2 重组表达质粒 KS001 / HA 的酶切鉴定Fig.2 Restriction map of recombinant plasmid KS001 / HA
2.2 表达产物的鉴定 12% SDS-PAGE 及对应的Western blot 分析显示,Expi293F 细胞表达的 HA 胞外段蛋白可与标准血清发生特异性结合,在相对分子质量约70 000 处可见特异性结合条带,在相对分子质量约60 000 处可见阳性对照HA 蛋白特异性结合条带,而阴性对照未见特异性条带。见图3。
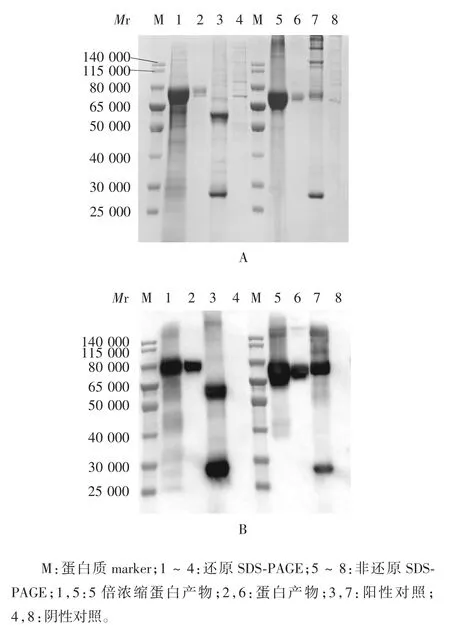
图3 表达产物的SDS-PAGE(A)及Western blot(B)鉴定Fig.3 SDS-PAGE(A)and Western blot(B)profiles of expressed products
经PNGaseF 酶处理后的蛋白相对分子质量约60 000,与阳性对照蛋白的相对分子质量大小相符,见图4。
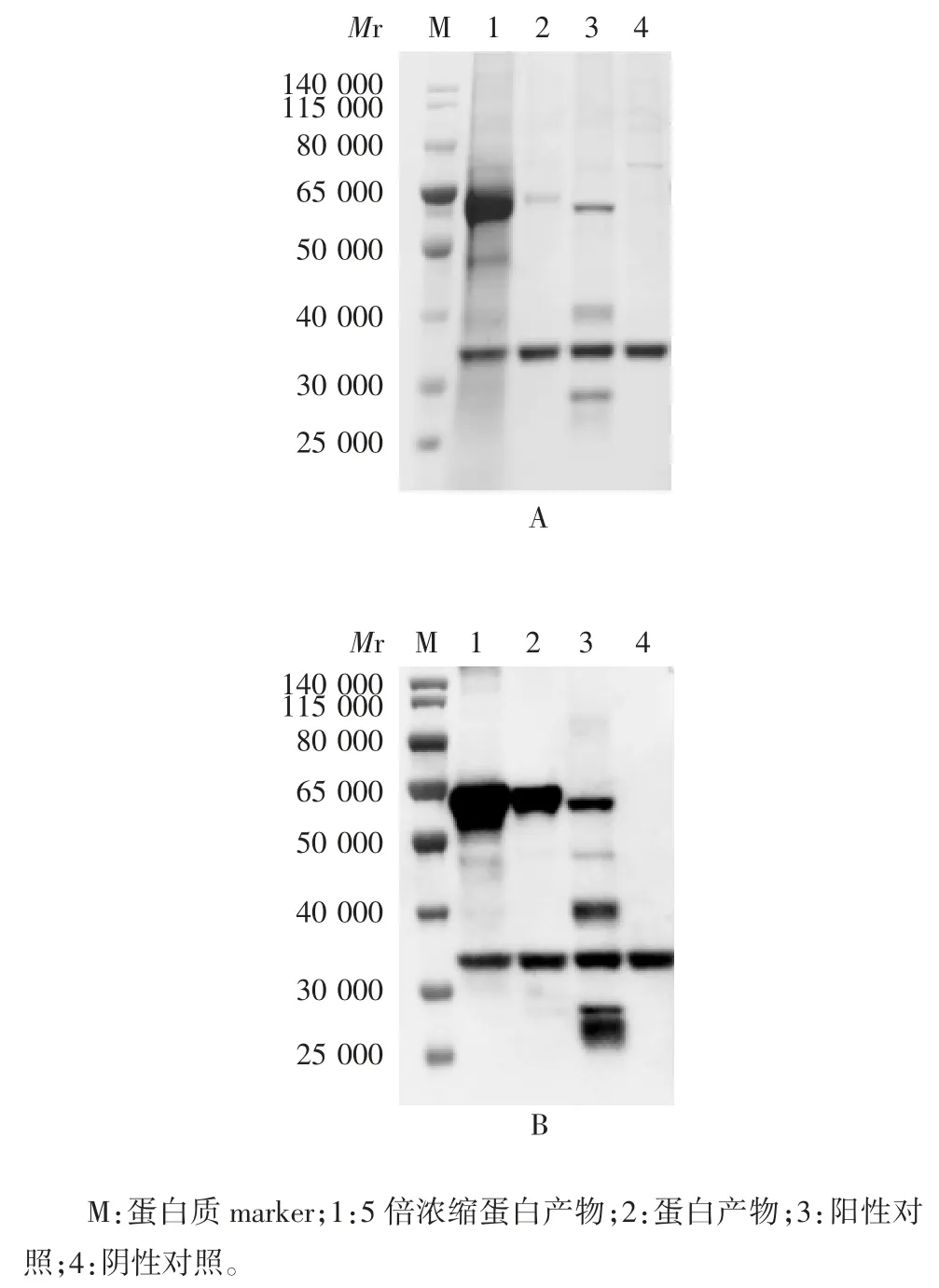
图4 表达产物去 N-糖基化修饰的 SDS-PAGE(A)及Western blot(B)鉴定Fig.4 Identification of de-glycosylation of expressed product by SDS-PAGE(A)and Western blot(B)
2.3 纯化产物的鉴定 12% SDS-PAGE 分析显示,纯化后的蛋白相对分子质量约70 000,纯度> 97%,见图5。BCA 蛋白定量分析拟合的标准曲线见图6,线性拟合方程为y = 0.001 070 38 x + 0.107 361,R2= 0.996 8,计算得到蛋白浓度为 186 μg / mL。

图5 纯化产物的SDS-PAGE 分析Fig.5 SDS-PAGE profile of purified protein
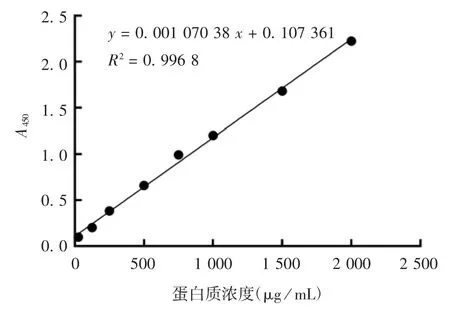
图6 BCA 蛋白定量分析拟合的标准曲线Fig.6 Standard curve for fitting BCA protein quantitative analysis
2.4 免疫后小鼠血清抗体效价 2 次免疫小鼠后,抗原组除3.75 μg HA 剂量组外,其他剂量组小鼠血清均未检测出针对H1N1 毒株的抗体,3.75 μg HA 剂量组抗体效价阳转率为10%,其余各剂量组均为0,各剂量组间抗体效价差异均无统计学意义(Kruskal-Wallis statistic = 5.214,P = 0.390 3)。佐剂配伍组各剂量组小鼠血清均检测到特异性抗体,与抗原组和阴性对照组相比,差异均有统计学意义(Kruskal-Wallis statistic = 25.11 ~ 27.62,P <0.001)。佐剂配伍组各剂量组GMT 增长倍数在28.80~52.00 之间,抗体效价阳转率在90%~100%之间,各剂量组间抗体效价差异均无统计学意义(Kruskal-Wallis statistic = 2.317,P = 0.6778)。见图 7 和表 1。
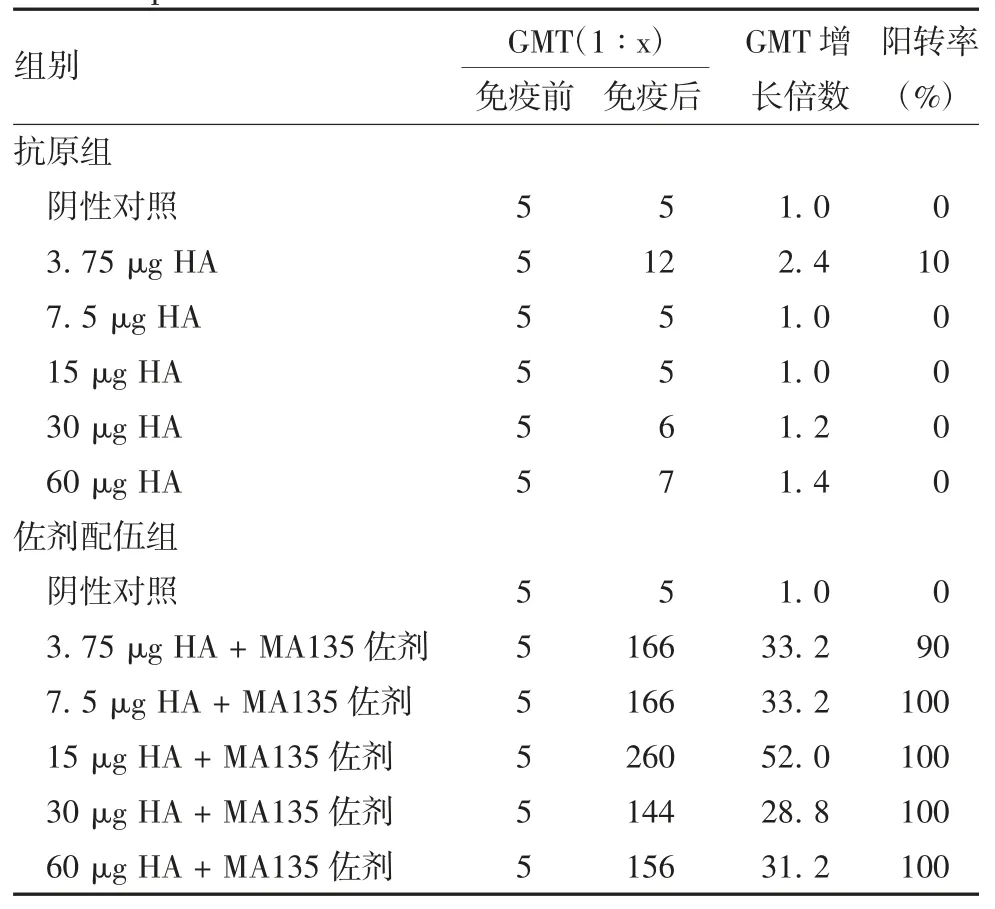
表1 各组小鼠H1N1 型毒株抗体效价Tab.1 Antibody titers against H1N1 virus in mice immunized with HA protein
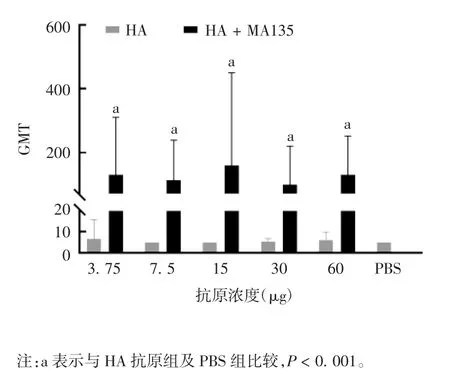
图7 HA 抗原组和HA + MA135 佐剂配伍组小鼠2 次免疫后血清抗体GMTFig.7 GMTs of serum antibody of mice after secondary immunization in HA antigen group and HA + MA135 adjuvant group
3 讨 论
本研究成功构建了KS001 / HA 胞外段真核表达质粒,并于Expi293F 细胞中表达,表达的蛋白为单体,相对分子质量约70 000,N-糖基化丰富,经去N-糖基化修饰处理后蛋白相对分子质量变为60 000,接近H1N1 型流感病毒的HA 蛋白。
本研究在抗原及抗原联合佐剂2 次免疫小鼠后,用MNT 法检测小鼠血清中和流感病毒的抗体水平,判断其免疫原性。结果显示,重组HA 蛋白在60 μg 及以下剂量未产生针对H1N1 型流感病毒的特异性抗体。但佐剂配伍各剂量组均显示出较高的抗体效价和阳转率,但各剂量组间抗体效价差异无统计学意义(P >0.05),未显示出效应-剂量关系。表明HA 胞外段蛋白在佐剂的辅助下免疫小鼠具有较好的免疫原性。本研究所用的佐剂MA135 是MF59 佐剂类似物,为水包油型乳化佐剂,所有成分均是可生物降解的天然衍生物,安全,耐受性好。其类似物MF59 已被批准纳入30 多个国家的人类流感疫苗,应用范围也包括儿童和老年人[11-12]。有研究显示,MF59 对流感疫苗接种的辅助作用包括减少抗原的用量[13-14]、增强疫苗的免疫原性,如增强针对同源和异源流感毒株的HA 抑制抗体和记忆性T 细胞和B 细胞,从而增强了大流行和季节性流感疫苗的保护效果[15-16],这也解释了重组抗原在与MA135佐剂配伍后能显著增强小鼠免疫原性的现象。
综上所述,本研究成功构建了KS001 / HA 胞外段真核表达质粒,并表达了HA 胞外段蛋白,蛋白联合佐剂免疫小鼠具有较好的免疫原性,为后期新型流感重组亚单位疫苗的研制提供了参考。
