纳米纤维素基血液接触性材料研究进展
2021-12-21张春亮吴治宇王凯荣周风山王小慧
张春亮 吴治宇 张 瑜 杨 培 王凯荣 周风山 王小慧
(1.中国地质大学(北京)材料科学与工程学院,北京,100083;2.国家纳米科学中心,北京,100190;3.兰州大学第一临床医学院,甘肃兰州,730000;4.首都医科大学附属北京安贞医院,北京,100029;5.宁夏医科大学总医院,宁夏银川,750004;6.兰州大学基础医学院生物化学与分子生物学研究所,甘肃兰州,730000;7.军事科学院军事医学研究院卫生勤务与血液研究所,北京,100850)
纳米纤维素是一种可再生的、环境友好的天然材料,主要包括纤维素纳米纤丝(Cellulose nanofibril,CNF)、纤维素纳米晶体(Cellulose nanocrystal,CNC)和细菌纤维素(Bacterial cellulose,BC)[1-3]。纳米纤维素在表面电荷、长径比、形状和性能等方面显示出了优异的可调性,在纸基功能材料、生物医用材料和电子材料等领域得到了广泛的应用[4-6]。
血液接触性材料是一类重要的生物医用材料,其在组织工程和药物递送领域具有重要的地位。血液接触性材料主要包括抗凝血材料和促凝血材料。血液相容性是评估血液接触性材料对血管内血液形成血栓能力的重要指标[7],其调控由使用场景决定。血液透析回路管、血液透析膜、人工血管和人工心脏瓣膜等抗凝血材料必须具有优异的血液相容性,能够有效阻止血浆蛋白和血小板的吸附,不会激活凝血级联发生[8]。止血材料和伤口敷料等促凝血材料必须具有差的血液相容性,能够加速凝血的发生[9]。
纳米纤维素材料具有高活性羟基、大长径比和高强度,可以通过物理改性或化学改性,调控其抗凝血性/促凝血性。纳米纤维素在血液接触性材料领域得到了广泛的研究[10-11],但目前对纳米纤维素在抗凝血和促凝血的应用进行系统性总结的文献相对较少。本文介绍了纳米纤维素基血液接触性材料制备及其应用,并展望了未来的发展前景和面临挑战。
1 纳米纤维素基抗凝血材料
纳米纤维素基抗凝血材料主要通过化学改性和物理改性制备,可以有效降低血浆蛋白和血小板的吸附,阻止凝血级联的激活,抑制血栓的形成。纳米纤维素基抗凝血材料在血液透析、人工血管和心脏瓣膜领域得到了广泛的应用。
1.1 纳米纤维素基抗凝血材料的制备
1.1.1 化学改性
纳米纤维素基抗凝血材料的化学改性主要包括肝素化和磺酸化。肝素化改性是指通过共价键固定肝素到纳米纤维素的表面(图1(a))[12]。肝素可以与抗凝血酶III结合,活化抗凝血酶III,使凝血酶、Xa因子等蛋白酶失活,延长凝血时间。1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐/N-羟基琥珀酰亚胺(EDC/NHS)是肝素化改性中最常用的酯化剂。肝素化改性的BC,其表面固定的肝素浓度可达48µg/cm,可以显著地延长血浆复钙时间(大于1400 s),降低血小板吸附[13]。
磺酸化改性是指使用磺化剂将纳米纤维素的活性羟基取代为硫酸酯基(—OSO3-)的过程。硫酸酯基可以赋予纳米纤维素具有类似肝素的抗凝血性,有效地阻止凝血发生。常用的磺化剂包括亚硫酸盐、硫酸和三氧化硫吡啶。通过亚硫酸盐磺酸化制备的CNF的表面具有高的—OSO3-含量(500µmol/g)和低的ζ电位(-25 mV)(图1(b))。磺酸化可以显著地降低纳米纤维素的形成凝血酶-抗凝血酶复合物(Throm⁃bin antithrombin complex,TAT)的浓度,延长激活部分凝血酶原时间(Activated partial thromboplastin time,APTT)和凝血酶时间(Thrombin time,TT)。相比于未磺酸化的CNF(TAT>10000µg/L),磺酸化的CNF在全血中的浓度为0.5~5.0 mg/mL时可以显著地降低全血中凝血酶-抗凝血酶复合物的形成(TAT=2500µg/L),抑制血液补体激活[14]。通过硫酸磺酸化制备的CNC可达到与肝素相似的ζ电位(-37 mV)。磺酸化的CNC可以通过层层自组装方式涂覆在纤维素基底上,阻止血浆蛋白的吸附,延长凝血时间[15]。通过三氧化硫吡啶磺酸化制备的CNC表面的—电荷密度可达330 mmol/kg(图1(c))。相比于正常血浆,当血浆中磺酸化CNC浓度为50µg/mL时,血浆的激活凝血酶时间和凝血酶原时间从28 s和17 s分别延长到200 s和75 s以上[16]。通过三氧化硫吡啶磺酸化改性的BC延长了血浆的激活部分凝血酶原时间(APTT=42 s)和凝血酶时间(TT=25 s)。磺酸化的BC与羧甲基壳聚糖纳米粒子和聚乙醇共混制备的静电纺丝膜的APTT和TT分别为47~67 s和25~48 s,可以达到与肝素相接近的抗凝血能力(APTT=50 s和TT=33 s)[17]。
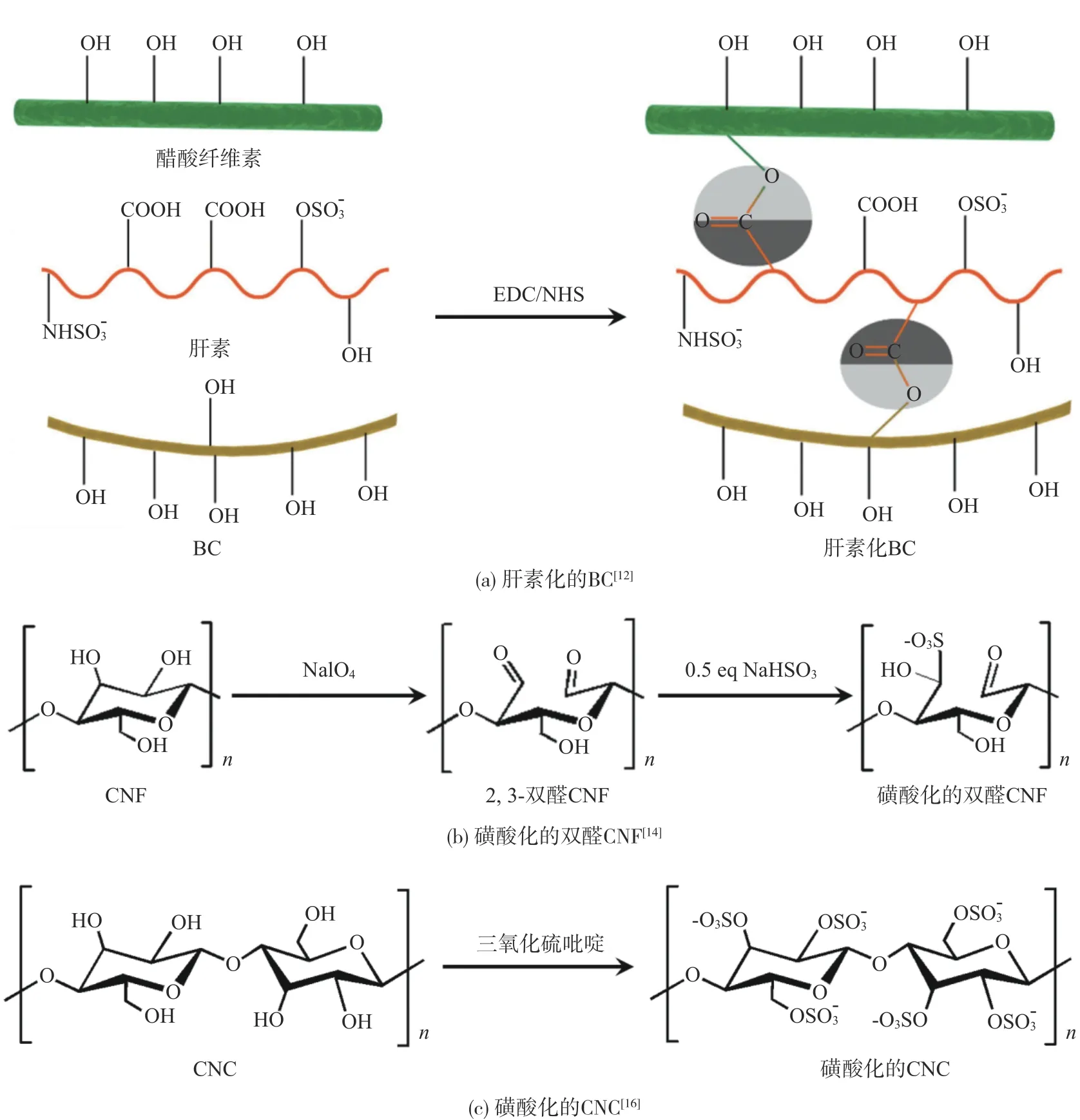
图1 纳米纤维素基抗凝血材料的制备Fig.1 Preparation of nanocellulose-based anticoagulant materials
不同的磺化剂对纳米纤维素磺酸化有不同的影响。硫酸磺化法技术成熟,产品质量稳定[15],但是其反应速度慢、耗酸量大和环境污染严重;三氧化硫吡啶磺酸化法速度快、环境污染小、成本低[16],但是其反应条件苛刻(浓度和用量需严格控制);相比于硫酸和三氧化硫吡啶直接磺化,亚硫酸盐磺化法属于间接磺化,其制备工艺复杂,生产成本高[14]。
1.1.2 物理改性
纳米纤维素基抗凝血材料的物理改性包括纳米纤维素的结构调控和添加其他亲水性组分,可以调控其表面的粗糙度和亲水性。表面粗糙度低可降低与血小板接触面积,阻止血小板的吸附,提高抗凝血性能[13];表面亲水性高可以减少血浆蛋白展开/构象变化,降低血小板和XII因子激活[18]。
纳米纤维素通过接触空气成型或丝光化处理,可以提高堆积密度,降低其表面粗糙度。通过接触空气制备的BC管具有致密的结构和低的内表面粗糙度。相比于商业化的聚对苯二甲酸乙二醇酯管,接触空气制备的BC管能够更好地抵抗血小板和白细胞的吸附,抑制血小板的激活,从而降低凝血酶-抗凝血酶复合物的形成[19]。丝光化可以提高BC晶须的直径,使得BC管具有致密的结构和较低的表面粗糙度。丝光化后的BC管具有较低的蛋白质和血小板的吸附,可以作为小口径人工血管使用[20]。
BC管与聚乙烯醇复合可以提高其亲水性。与BC管相比,BC/聚乙烯醇复合管可更有效地阻止血小板的吸附和因子XII的激活,进一步降低了血液补体系统的激活[18]。
1.2 纳米纤维素基抗凝血材料的应用
1.2.1 血液透析设备
血液透析是目前治疗尿毒症最有效的方法,可以有效地移除血液中毒素,降低毒素对尿毒症病人脏器的不利影响。为保证病人的安全,理想的血液透析设备必须同时具有高效的过滤性能和优异的抗凝血性能。血液透析设备最核心的组成部分是血液透析回路管和透析器中的血液透析膜。
纳米纤维素基抗凝血材料可用于制备血液透析回路管和血液透析膜。磺酸化的纳米纤维素可通过静电作用涂覆在血液透析回路管内表面(图2(a))或者掺杂到血液透析回路管基体中,其可以提高血液透析回路管的抗凝血性,有利于其保持长期通畅性[11,16]。纳米纤维素/聚吡咯膜是一种典型的血液透析膜,其具有高的比表面积(80 m2/g)和优异的交换容量(600~706µmol/g),可有效地移除低分子质量毒素(草酸盐提取能力523~610µmol/g)。纳米纤维素/聚吡咯膜经肝素化后,展示了优异的抗凝血性能,其血小板吸附量从57%减少到20%,TAT从10670µg/L减少到220µg/L。肝素涂层对纳米纤维素/聚吡咯膜的离子交换容量和低分子质量毒素移除能力没有显著性影响[21]。肝素化改性使得纳米纤维素/聚吡咯膜在血液透析中展现了更大的应用潜力。
1.2.2 人工血管
人工血管常用于替换病变(如血栓和动脉粥样硬化)的动脉,治疗心血管疾病(脑梗、急性心肌梗死、肺栓塞和深静脉血栓症),实现血运重建。
动脉血管包括三层结构,分别是内膜、中膜和外膜。内膜的内皮细胞可分泌抗血栓分子和纤溶分子,起到调节血管张力、炎症、脂质和组织液内稳态以及抗血栓的作用[22];中膜的平滑肌细胞、胶原蛋白和弹性蛋白赋予动脉优异的力学性能(高爆破压、良好的顺应性、良好的延展性和非线性弹性)[23];外膜的结缔组织和成纤维细胞维持动脉稳态和增加动脉刚性[24]。通过仿生设计制备的具有类似天然血管的结构和机械性能的人工血管,可以有效地阻止血栓形成,实现长期通畅性[8]。
BC通过管状生物反应器、应力诱导膜卷曲和模压方法可以制备BC基人工血管[25-26]。BC基人工血管可以很好的模拟天然血管三层结构或者抗凝血的内膜。具有形状记忆和多层结构的BC基人工血管进行兔子颈动脉置换后,通畅性可以保持3周,并且能够很好的与宿主组织融合,支持宿主细胞活性增长(图2(b))[25]。丝光化的BC管具有更高的力学性能和更致密的内表面,其在进行鼠腹主动脉移植后,通畅性长达16周,支持新组织再生[20]。纳米纤维素可以作为增强剂提高人工血管基材(如聚氨酯)的力学性能。纳米纤维素复合材料基人工血管可以很好的模拟天然血管中膜的性质,赋予人工血管优异的力学性能。非织造纳米纤维素垫与聚氨酯膜通过堆积和模压成型方法构建的纳米纤维素/聚氨酯基人工血管具有好的弹性和大的断裂伸长率(800%~1200%),可以很好的与天然血管的顺应性匹配,有效降低血流扰动,实现高的通畅性[27]。
1.2.3 人工心脏瓣膜
人工心脏瓣膜可以用于替代受损的心脏瓣膜,治疗瓣膜性心脏病(如瓣膜狭窄或回流)[28]。理想的人工心脏瓣膜既不会因生物降解而失效,也不会因疲劳诱导而失效,同时其表面不易形成动脉粥样硬化或斑块。
非织造纳米纤维素垫与聚氨酯膜通过堆积和模压成型方法(压力10000 kPa,温度175℃和制备时间30~60 s)可以制备纳米纤维素增强的聚氨酯心脏瓣膜。当纳米纤维素的固含量为5%时,纳米纤维素增强的聚氨酯心脏瓣膜可以保持良好的生物耐久性、抗疲劳性和抗凝血性(图2(c))。在加速疲劳测试中,纳米纤维素增强的聚氨酯心脏瓣膜循环6.8×108次后仍具有很好的力学性能[27],在人工心脏瓣膜领域显示了巨大应用前景。
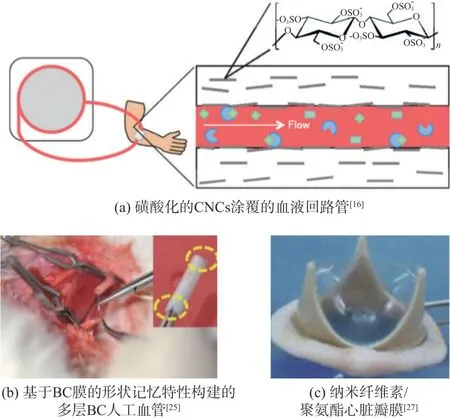
图2 纳米纤维素基抗凝血材料的应用Fig.2 Application of nanocellulose based anticoagulant materials
2 纳米纤维素基促凝血材料
纳米纤维素基促凝血材料主要通过物理改性制备,包括纳米纤维素的结构调控和添加其他促凝血组分。纳米纤维素基促凝血材料可以通过被动止血机制(促进纤维蛋白原、红细胞和血小板吸附和聚集引起凝血)和主动止血机制(凝血酶作用引起凝血)快速作用于出血部位,缩短止血时间和降低出血量。纳米纤维素基促凝血材料在止血材料和伤口敷料领域得到了广泛的应用。
2.1 纳米纤维素基促凝血材料的制备
2.1.1 结构调控
纳米纤维素基促凝血材料的结构调控主要包括:改变形貌,提高长径比,增大比表面积和增加表面负电荷。
CNC的形貌影响血浆凝固时间。通过硫酸水解和乙酸/磷钨酸溶解可以分别制备棒状CNC和圆盘状的CNC。相比于圆盘状的CNC,当棒状CNC在全血中浓度为0.83 mg/mL时,棒状CNC降低了血浆复钙时间(224 s),具有促凝血性质[29]。
CNF的长径比和比表面积显著影响其对血浆蛋白和血小板的吸附。通过控制球磨时间可以制备具有不同长径比和比表面积的CNF。当球磨90 min时,CNF的长径比和比表面积分别为166和17 m2/g,其可以将全血凝固时间、贫血小板血液凝固时间和肝素抗凝血液的凝固时间分别缩短68%、80%和54%。相比于氧化再生纤维素止血剂,CNF具有更好的止血性能[30],这是由于CNF形成的网状结构能够捕捉血小板,促进纤维素蛋白吸附,引起内源性凝血途径激活。
纳米纤维素表面的负电荷,特别是羧基,有利于迅速地吸附纤维蛋白原和受损的红细胞并激活血小板,同时羧基对受损红细胞中的铁原子具有较强的络合能力,导致血细胞或血小板的非特异性聚集,并促进血凝块的生成。TEMPO氧化可以在CNF表面引入羧基,制得羧基化的CNF(cCNF)。cCNF和海藻酸钠在Ca2+交联下制得的CNF/海藻酸复合泡沫,具有高的孔隙率(大于85%)和高的溶胀性(1399%),可以提高对红细胞和血小板的吸附,具有优异的止血性能[31]。
2.1.2 添加促凝血组分
纳米纤维素与其他促凝血组分构建的纳米纤维素基促凝血材料不仅保留了促凝血组分的生物活性,而且其多孔结构可快速吸收血液中水分,加速止血(表1)。添加的促凝血组分包括大鲵皮肤分泌物(SSAD)[32]、明胶(G)[33]、壳聚糖[34]、胶原蛋白[35]、多巴胺(PDA)[36]、血小板裂解液(PL)[37]、蚕丝蛋白(SF)和凝血酶(Th)[38]。

表1 纳米纤维素基促凝血材料的制备和性能Table 1 Preparation and properties of nanocellulose based procoagulant materials
羧基化的CNF可以通过离子键和氢键与SSAD@CNC交联形成SSAD@CNC/CNF海绵。SSAD@CNC赋予SSAD@CNC/CNF海绵大的孔径尺寸和粗糙的孔壁,可以迅速吸收血液,浓缩红细胞、血小板和凝血因子,加速止血。相比于纤维素海绵和明胶海绵,SSAD@CNC/CNF海绵在非压缩性出血动物模型中表现出更加优异的止血性能[32]。胺化的Ag颗粒、明胶(G)和羧基化的CNF可以通过静电作用制备CNF/明胶/Ag水凝胶。明胶和胺化的Ag颗粒增加了CNF/G/Ag水凝胶对带负电荷残基的红细胞和血小板的吸附,促进了凝血酶-抗凝血酶复合物的生成,具有很强的止血效果[33]。羧基化的CNF(cCNF)与壳聚糖发生酰胺缩合反应得到高强度的CNF/壳聚糖气凝胶。CNF/壳聚糖气凝胶具有相互连通的孔结构和高的水吸收能力,能迅速地吸收血液中的水分,同时壳聚糖的正电荷可与红细胞表面的负电荷反应,进一步加速了红细胞黏附,从而使血液凝固[39]。cCNF和SF可以通过冷冻干燥-EDC/NHS交联制得cCNF/SF海绵。cCNF/SF海绵与Th交联进一步制得cCNF/SF/Th海绵。相比于cCNF/SF海绵,cCNF/SF/Th海绵中的Th通过主动止血方式,激活了凝血途径,进一步促进了血小板活化,提高了止血性能[38]。
醛基化的CNC(aCNC)与PL通过冷冻凝胶化可以制备aCNC/PL冷冻凝胶。aCNC/PL冷冻凝胶中的PL可以激活血小板,诱导红细胞和血小板迅速地黏附和凝聚。相比于商业化明胶海绵,aCNC/PL冷冻凝胶具有很好的强度和优异的弹性,可以更加快速地吸收血液[37]。
PDA改性的羧基化的BC(cBC-PDA)、多巴胺包覆的蒙脱土(PDA-MMT)和Ag颗粒通过冷冻干燥可以制备cBC-PDA/PDA-MMT/Ag海绵。cBC-PDA/PDAMMT/Ag海绵中的多巴胺含有大量酚羟基,可以增加与血浆纤维连接蛋白的相互作用,促进红细胞和血小板的吸附,诱导红细胞聚集、血小板活化和凝块形成[36]。
2.2 纳米纤维素基促凝血材料的应用
2.2.1 止血材料
止血材料可以迅速有效地控制伤口部位的出血。理想的止血材料应具有快速的止血能力、良好的生物相容性和优异的力学稳定性[40]。对于不可压缩性创伤,止血材料还必须具有可注射性和快速的形状恢复性[32,41]。在止血材料领域,纳米纤维素基促凝血材料的形式主要是海绵和水凝胶,利用其多孔结构和活性组分实现快速止血(表2)。
CNF/壳聚糖(CS)(CNF/CS)海绵具有优异的亲水-疏水Janus性、良好的柔韧性、优异的形状记忆性和良好的细胞相容性。具有Janus性的CNF/CS海绵的亲水层有利于吸收血液中水分、促进血小板聚集和激活血液补体系统,其疏水层有利于防止血液渗透。在兔肝损伤模型中,相比于只有亲水性的CNF/CS海绵和商用化的纱布,具有Janus性的CNF/CS海绵具有更快的止血时间(83 s)和更低的血液损失量(0.60 g)[42]。负载了Th的cCNF/SF/Th海绵能够显著地降低鼠肝的血液损失量(0.60 g),可以达到与含有凝血酶商品止血剂(Floseal)相同的止血性能[38]。
cCNC/海藻酸(SA)(cCNC/SA)海绵具有较高的孔隙率、优异的拉伸强度和良好的细胞相容性,有利于吸收大量的血液,提高对血小板和红细胞的吸附能力,比商用化的纱布显示出更加快速地止血效果(表2)。当cCNC添加量为30%时,cCNC-30/SA海绵对兔子肝的止血时间和血液损失量分别为76 s和0.54 g[31]。醛基化的CNC/血小板裂解物(PL)(aCNC/PL)冷冻凝胶具有多孔的结构、良好的机械强度、快速的压缩回弹性和优异的生物相容性。当aCNC添加量为0.6%时,aCNC-0.6/PL冷冻凝胶比商用化的明胶泡沫具有更好的止血性能(表2),其止血时间和血液损失量分别为85 s和0.54 g[37]。
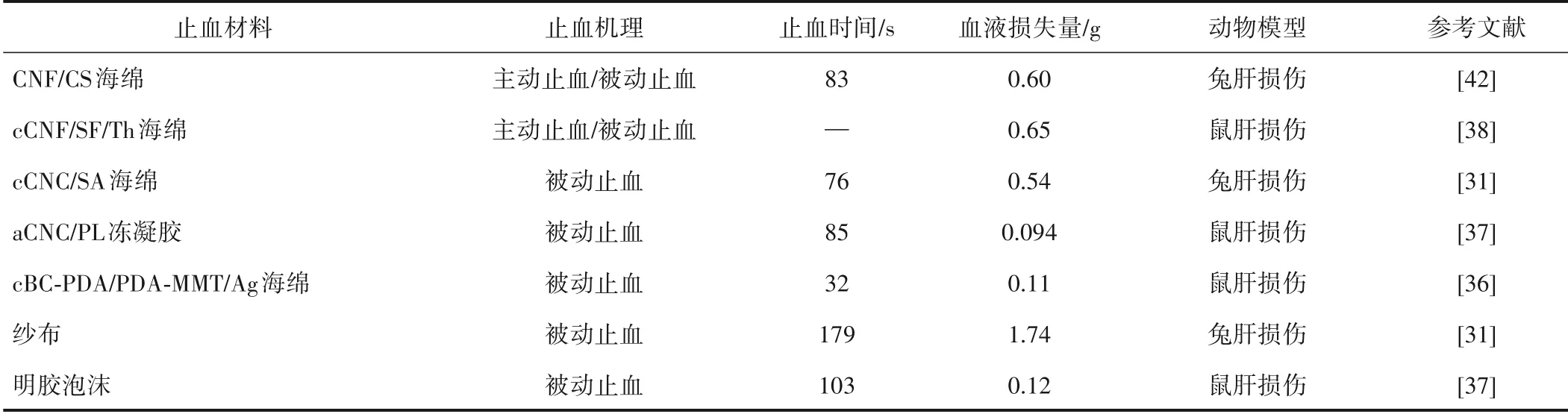
表2 纳米纤维素基促凝血材料和商用化材料的止血性能比较Table 2 Comparison of hemostatic properties between nanocellulose based procoagulant materials and commercial materials
cBC-PDA/PDA-MMT/Ag海绵具有优异的柔韧性和良好的生物降解性。在鼠肝损伤模型中,cBCPDA/PDA-MMT/Ag海绵对鼠肝的止血时间和血液损失量分别降低到32 s和0.11 g,可以用于不可压缩性创伤的止血[36]。
2.2.2 伤口敷料
伤口敷料作为一种暂时性皮肤替代物,可以用于治疗皮肤损伤或灼伤。理想的伤口敷料不仅应具有快速的止血性能,还应该具有优异的抗菌性能,可以有效降低伤口的炎症反应,促进伤口愈合[10]。
纳米纤维素基促凝血材料通过引入抗菌材料和醛基化改性,可以实现优异的抗菌性能[33,35,43]。天然抗生素指甲花醌具有抗炎和抗氧化作用。通过氢键相互作用,指甲花醌可以负载到cCNF/CS海绵上(图3(a))。负载指甲花醌的cCNF/CS(L-cCNF/CS)海绵能够实现指甲花醌持续释放,提高伤口部位抗菌活性。相比于商业化的壳聚糖伤口敷料,L-cCNF/CS海绵能够上调伤口愈合相关基因表达以及纤维连接蛋白和弹性蛋白的蛋白表达,加速伤口愈合,促进皮肤重塑[44]。通过静电纺丝/戊二醛交联的方法,普鲁兰多糖-ZnO(Pul-ZnO)纳米纤维可以修饰到氨烷基硅烷-g-BC(A-g-BC)(图3(b))。A-g-BC/Pul-ZnO敷料能够持续释放ZnO颗粒抗菌,减少伤口部位炎症。相比于BC,A-g-BC/Pul-ZnO敷料可以促进伤口愈合、再上皮化和胶原蛋白合成,并具有更快的凝血效果[45]。高碘酸钠能够氧化CNF葡萄糖环的中C2-C3键,形成2,3-二醛基结构(图3(c))。醛基化的CNF敷料不仅具有很好的止血能力,同时显示了优异的抗菌性能,可以加速伤口愈合,促进血管和再上皮化的形成[43]。
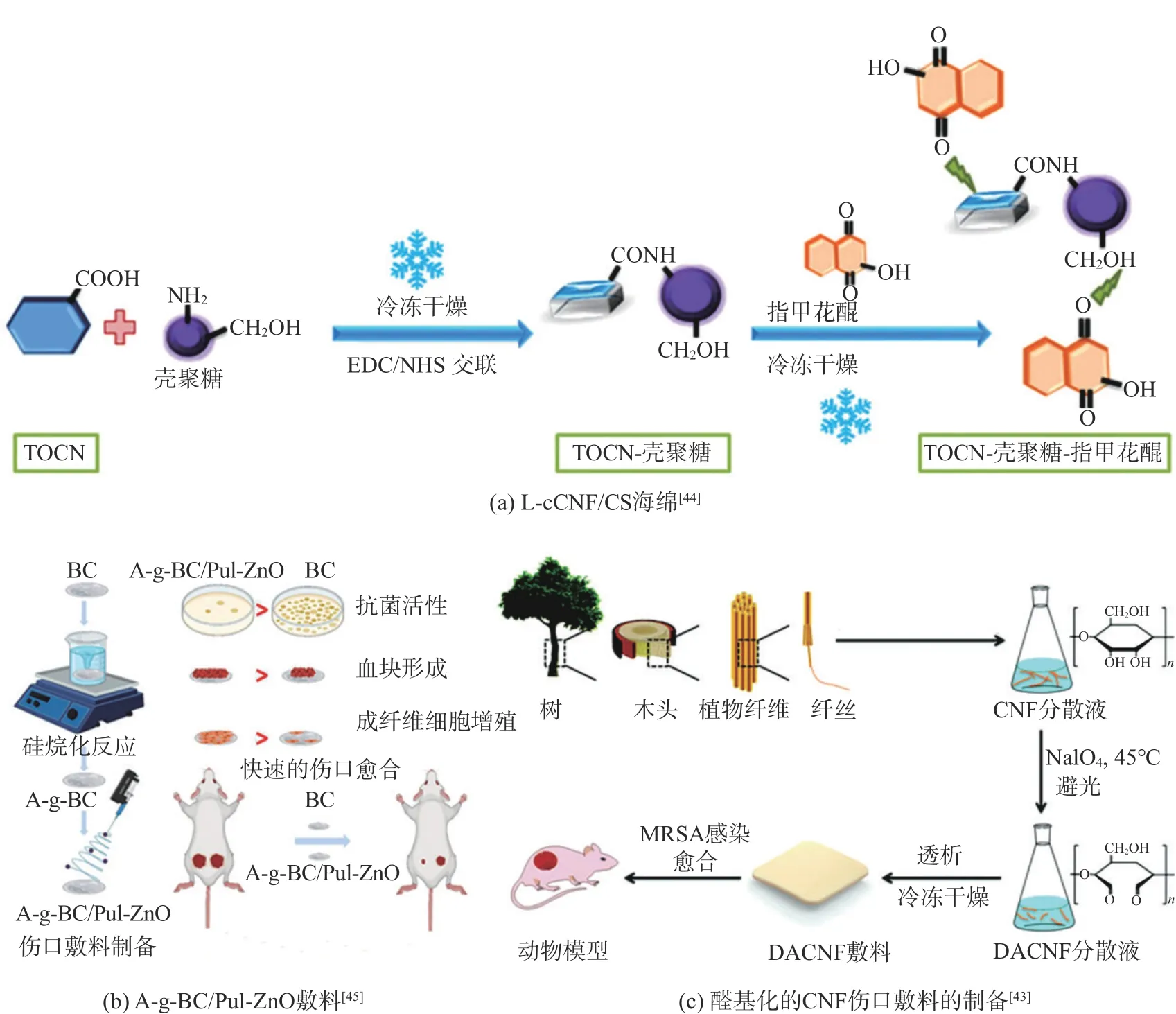
图3 纳米纤维素基伤口敷料的制备Fig.3 Preparation of nanocellulose-based wound dressing
纳米纤维素基伤口敷料具有良好的抗菌活性,其作为一种功能性伤口愈合替代品具有很大的发展空间。
3 结语与展望
纳米纤维素具有良好的亲水性、出色的力学性能和优异的生物相容性,其在血液接触性材料领域受到了广泛的关注。纳米纤维素基抗凝血材料主要通过对纳米纤维素的肝素化和磺酸化来实现长期抗凝血性,可以用于表面涂覆和填料,提高血液接触性材料的抗凝血性;纳米纤维素基促凝血材料主要通过对纳米纤维素的结构调控和添加促凝血组分来实现高促凝性,其可以用于不可压缩性创伤的快速止血。虽然纳米纤维素基血液接触性材料获得了广泛的发展,但是仍然存在一些亟待解决的问题。
(1)纳米纤维素基抗凝血材料的功能化改性。现有的纳米纤维素基抗凝血材料改性方法主要是通过肝素化和磺酸化,达到抑制凝血酶作用,因此需要探索更多的改性方法,如引入纤溶分子、抗血小板吸附分子和抗凝血酶分子等,可以进一步增强纳米纤维素基抗凝血材料对其他凝血途径的抑制,提高抗凝血性质。
(2)纳米纤维素基促凝血材料在特定场景下的应用。对于不可压缩性创伤,需要继续探索纳米纤维素基促凝血材料在快速止血的同时如何促进伤口快速愈合;对于自身凝血功能障碍的患者,需要继续研究纳米纤维素基促凝血材料如何结合被动止血和主动止血实现高效快速止血。
(3)纳米纤维素基促凝血材料的产品形态。纤维素基功能材料的优势可以通过湿部成形、流延或真空抽滤-热压等方式得到纤维素纸基材料,便于大规模应用。纳米纤维素基促凝血材料,特别是止血材料,目前主要是海绵和凝胶形态,探索采用湿法造纸工艺或后涂布工艺生产止血产品,将会大范围的拓展这一类材料的应用。
