EGFR-TKI分别联合化疗和贝伐珠单抗治疗EGFR突变晚期非小细胞肺癌的效果比较
2021-12-21焦书月张潇朱辉汤虹
焦书月,张潇,朱辉,汤虹
(郑州大学附属肿瘤医院/河南省肿瘤医院 呼吸内科,河南 郑州 450008)
肺癌是临床上常见的恶性肿瘤,是全球癌症死亡率高的主要原因。肺癌由小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC)组成,其中NSCLC占比约85%[1]。由于此类患者大多数一经诊断即为晚期,失去最佳治疗时机,5 a生存率不到20%[2]。含铂双药化疗成为该类患者标准的一线治疗,虽然给患者带来一定的获益,但严重的副作用往往也会影响疗效。人表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKI)的出现改变了标准的治疗模式,成为含有敏感EGFR突变的晚期NSCLC的标准一线治疗[3]。但是EGFR-TKI治疗后获得性耐药是不可避免的,因此,开发新的治疗策略十分必要。肿瘤新生血管的概念被定义后,抗血管生成药物在肿瘤学领域逐渐兴起。血管内皮生长因子(vascular endothelial growth factor,VEGF)具有促进血管新生的功能,贝伐珠单抗是第1个针对VEGF靶点的人源化的单克隆抗体,可高亲和力特异性地结合VEGF,达到抑制肿瘤血管生成的作用。研究证明,与EGFR-TKI单药治疗EGFR突变晚期NSCLC患者相比,EGFR-TKI联合化疗或抗血管生成药物能为患者带来更长的无进展生存期(progression-free survival,PFS)[4-5]。目前尚无临床研究对比EGFR-TKI联合化疗和EGFR-TKI联合抗血管生成药物的疗效差异。因此,本研究旨在收集郑州大学附属肿瘤医院接受EGFR-TKI联合化疗和EGFR-TKI联合抗血管生成药物治疗EGFR突变晚期NSCLC患者的临床资料,比较两种治疗模式的疗效。
1 资料与方法
1.1 病例选取标准纳入标准:(1)经病理证实为NSCLC,病理分型为腺癌且EGFR突变阳性[采用基因测序法测出19外显子缺失突变(19del)或21外显子L858R突变];(2)临床分期为Ⅳ期(根据第8版肿瘤原发灶-淋巴结-转移分期);(3)曾接受EGFR-TKI联合化疗和EGFR-TKI联合贝伐珠单抗治疗方案;(4)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~1分;(5)有完整的临床病理信息,包括吸烟、性别、年龄和临床分期等;(6)有可测量评估的病灶;(7)签署知情同意书。排除标准:(1)合并其他恶性肿瘤;(2)合并心、肝、肾功能衰竭,血液系统疾病,急性心脑血管事件,严重恶病质及肺部感染性病变。
1.2 一般资料根据纳入和排除标准收集2016年10月至2020年10月就诊于郑州大学附属肿瘤医院的185例EGFR突变晚期NSCLC患者的临床资料。根据已行的一线治疗方案将接受EGFR-TKI联合化疗的114例患者纳入C+T组,接受EGFR-TKI联合抗血管生成药物的71例患者纳入A+T组。两组患者的性别、年龄、ECOG评分、吸烟史、突变类型、脑转移比较,差异无统计学意义(P>0.05)。本研究经郑州大学附属肿瘤医院医学伦理委员会审批通过。见表1。
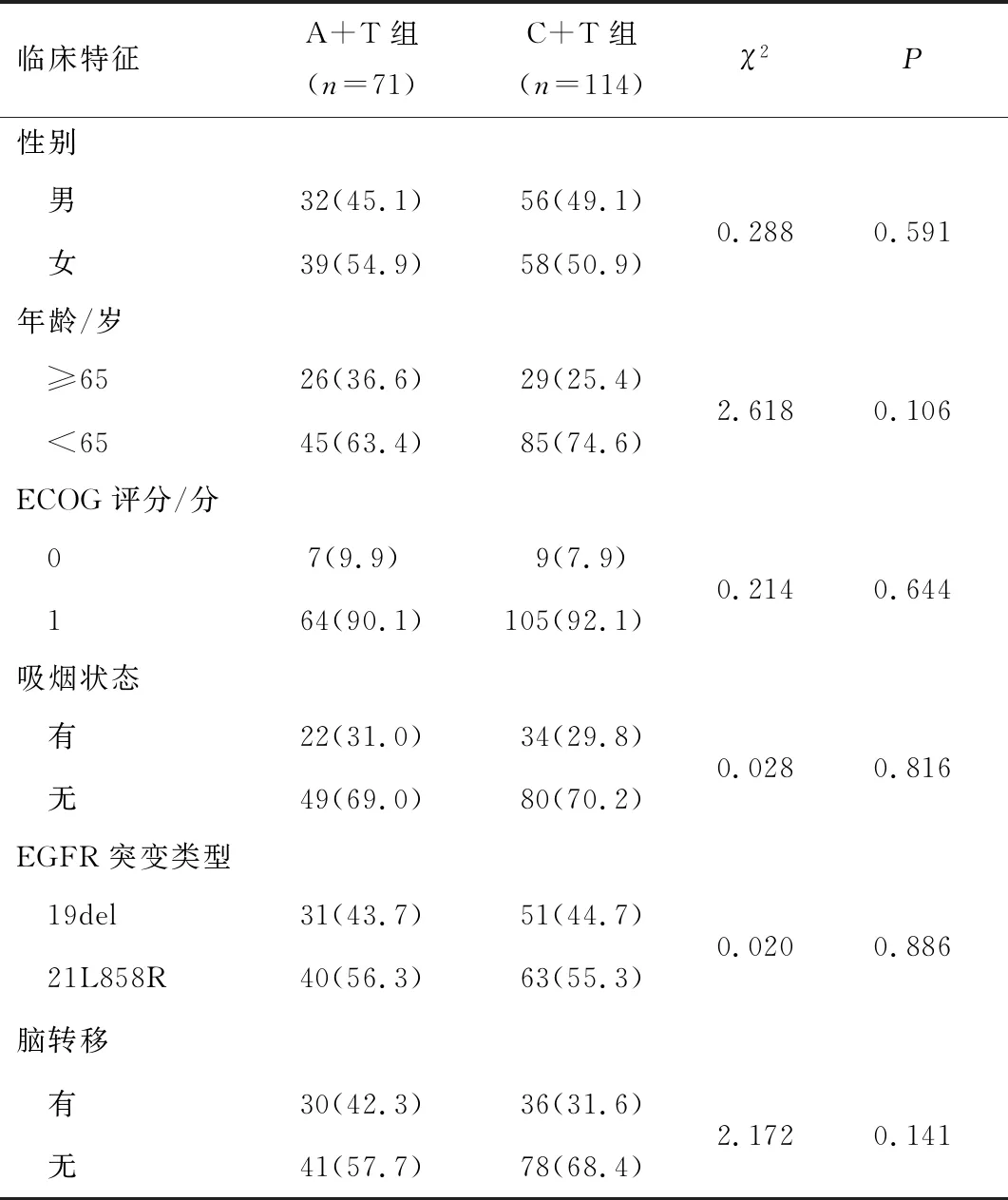
表1 两组患者临床特征[n(%)]
1.3 治疗方法
1.3.1A+T组 接受一代EGFR-TKI联合贝伐珠单抗[Roche Rpharma(Switzerland)Ltd,注册证号S20170035]方案治疗。一代EGFR-TKI具体为:吉非替尼(Kagamiishi Plant,Nipro Pharma Corporation,注册证号 H20171297),每日1次,每次250 mg,4周为1个周期,或厄洛替尼(上海罗氏制药有限公司,国药准字J20170031),每日1次,每次150 mg,4周为1个周期,或埃克替尼(贝达药业股份有限公司,国药准字H20110061),每日3次,每次125 mg,4周为1个周期。贝伐珠单抗7.5 mg·kg-1,静脉滴注,第1天使用完毕,21 d为1个周期,采用该治疗方案直至疾病进展或出现不能耐受的不良反应。
1.3.2C+T组 接受一代EGFR-TKI联合含铂双药化疗方案治疗。一代EGFR-TKI具体为:吉非替尼,每日1次,每次250 mg,4周为1个周期,或厄洛替尼,每日1次,每次150 mg,4周为1个周期,或埃克替尼,每日3次,每次125 mg,4周为1个周期;化疗方案采用培美曲塞(江苏豪森药业集团有限公司,国药准字 H20051288)500 mg·m-2,静脉滴注,第1天使用完毕,联合卡铂(齐鲁制药有限公司,国药准字 H20020180),血药浓度-时间曲线下面积设为5,按血药浓度-时间曲线下面积和肌酐清除率计算卡铂的剂量,静脉滴注,第1天使用完毕,或顺铂(江苏豪森药业集团有限公司,国药准字H20040812)75 mg·m-2,第1~3天静脉滴注,每21 d作为1个化疗周期。EGFR-TKI联合化疗连用4~6个周期后,停止化疗,继续口服EGFR-TKI进行维持治疗,直至疾病进展或出现不能耐受的不良反应。
1.4 观察指标及评价标准所有患者均定期随访,末次随访时间截止至2021年4月31日,患者无1例失访。所有患者以治疗开始前最近的1次影像学检查为基线,每治疗2个疗程复查胸腹部CT、脑部MRI等检查。参照实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1版[6]作为疗效评价标准,完全缓解(complete response,CR):患者咯血、胸闷等症状好转,病灶完全消失至少1个月,无新发病灶;部分缓解(partial response,PR):症状好转,基线病灶最大径之和减少30%,且维持时间超过1个月;疾病稳定(stable disease,SD):患者主要临床症状无明显变化,肿瘤缩小30%以下或增大20%以下;疾病进展(progressive disease,PD):患者临床症状加重恶化,肿瘤病灶增大超过20%,或发现新的病灶。客观缓解率(objective response rate,ORR)为CR率和PR率之和。疾病控制率(disease control rates,DCR)为CR率、PR率和SD率之和。PFS定义为开始用药到肿瘤出现进展的时间。根据美国国立癌症研究所通用不良反应术语标准4.0版对研究中出现的不良事件进行评估。在两组患者进展后对其石蜡包埋组织、外周血、脑脊液等再次采取二代测序技术(next generation sequencing,NGS)进行肺癌靶基因的检测,明确靶向药物的耐药机制。
1.5 统计学方法采用GraphPad 8.0.2统计软件对数据进行统计分析,生存分析采用Kaplan-Meier法和log-rank检验,并绘制生存曲线,计数资料以率(%)表示,进行χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 治疗效果A+T组ORR较C+T组高,差异有统计学意义(P<0.05);两组DCR比较,差异无统计学意义(P>0.05)。见表2。
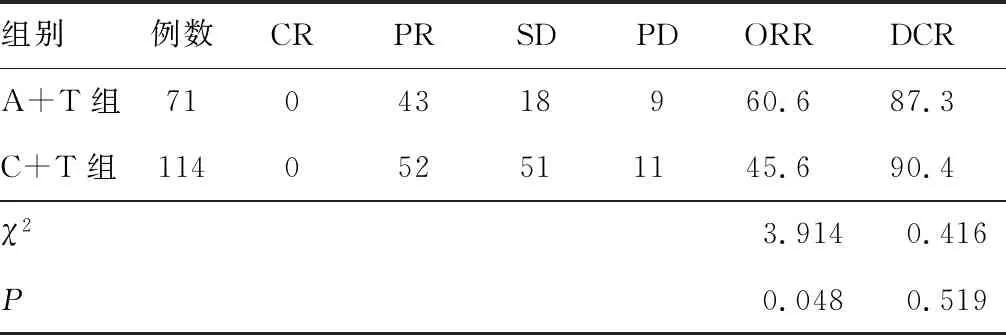
表2 两组临床效果比较(n,%)
2.2 PFSC+T组的中位PFS(18.74个月)较A+T组的中位PFS(15.10个月)长,差异有统计学意义(P<0.05);在21 L858R亚组中,C+T组的中位PFS(17.53个月)较A+T组的中位PFS(14.63个月)长,差异无统计学意义(P>0.05);在19del亚组中,C+T组的中位PFS(20.87个月)较A+T组的中位PFS(16.20个月)长,差异有统计学意义(P<0.05);在具有脑转移和无脑转移亚组中,A+T组的中位PFS(18.90个月)较C+T组的中位PFS(15.89个月)长,差异无统计学意义(P>0.05)。见图1。
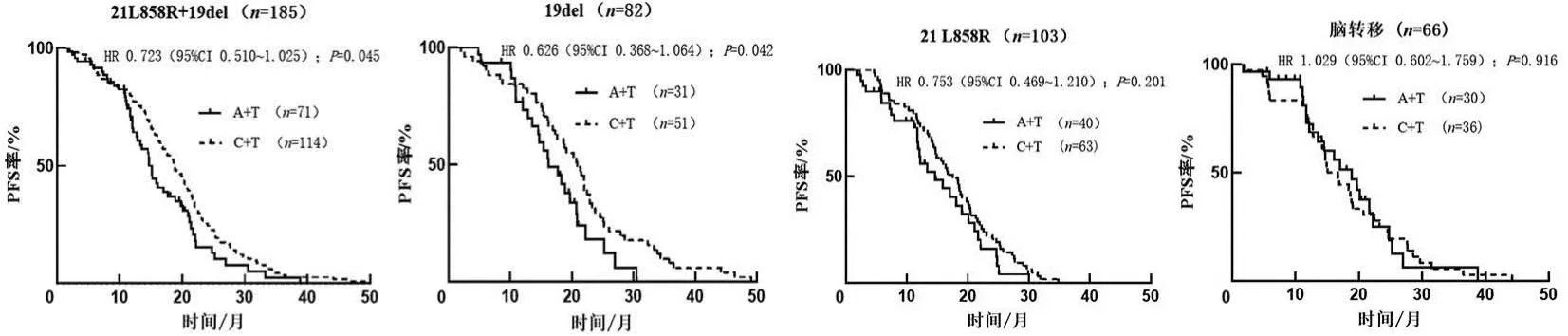
图1 两组患者在不同的亚组中PFS曲线
2.3 不良反应A+T组患者在治疗期间总不良反应率[95.77%(68/71)]较C+T组的总不良反应率[98.24%(112/114)]低。A+T组在治疗期间胃肠道反应和骨髓抑制发生率均较C+T组低,差异有统计学意义(P<0.05);C+T组在治疗期间高血压、皮肤反应和蛋白尿的发生率均较A+T组低,差异有统计学意义(P<0.05);两组肝毒性发生率比较,差异无统计学意义(P>0.05)。见表3。
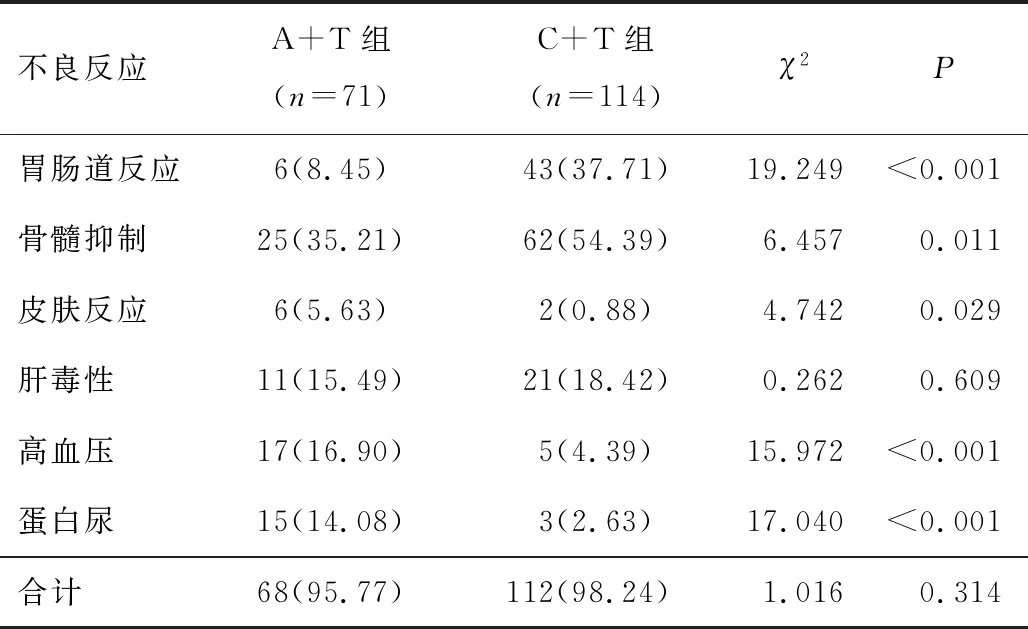
表3 两组用药不良反应发生情况比较[n(%)]
2.4 耐药后进展类型截至随访日期,A+T组患者共53例进展,C+T组患者全部进展,在两组患者进展后对其石蜡包埋组织、外周血、脑脊液等再次采取NGS进行肺癌靶基因的检测,发现主要突变位点以20外显子(T790M)为主,其中A+T组的T790M突变率较C+T组高,差异无统计学意义(P>0.05)。见表4。两组患者进展后均以原发病灶进展为主(P>0.05)。见图2。

表4 两组患者的耐药机制的对比[n(%)]
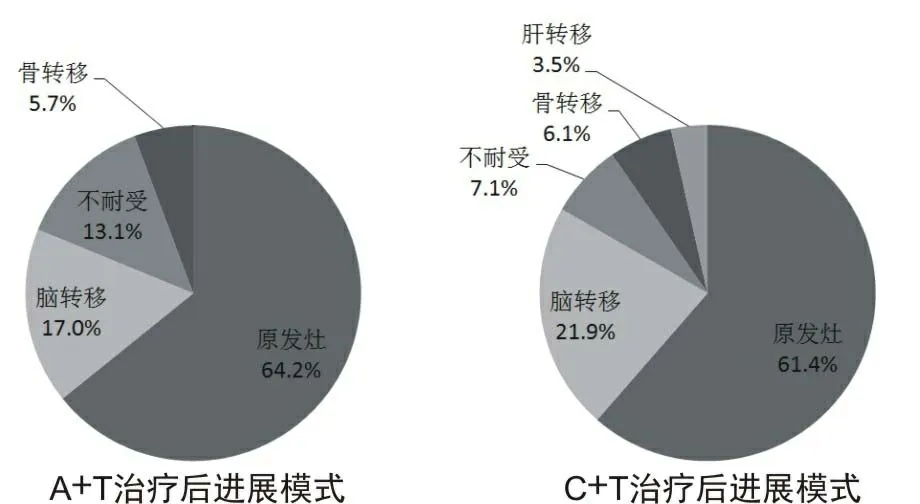
图2 两组患者治疗后的进展模式
3 讨论
肺癌是目前临床上发病率最高的恶性肿瘤,是导致患者死亡的主要原因之一,其中NSCLC占到全部肺癌病例的85%[1]。在之前已经有研究对化疗联合EGFR-TKI对NSCLC细胞增殖和存活产生协同抑制作用的潜在机制进行了探索。有研究提出,联合治疗较单纯TKI治疗更能抑制细胞周期蛋白和细胞周期的调节,同时还能够刺激细胞凋亡信号,联合治疗还能对一些和NSCLC的生长和进展有关的信号通路产生抑制作用,例如PI3K/AKT信号、TGF-β信号、SAPK/JNK信号、脂多糖刺激/紫外线A诱导的MAPK信号、端粒酶信号和AMPK信号,这些信号通路可以部分解释联合治疗对肿瘤增殖的协同抑制作用[7]。在NEJ009实验中,结果提示EGFR-TKI联合化疗组的PFS和OS均优于单药TKI[4]。
新生血管的生长是肿瘤生长和转移必需的,已经证实肿瘤微血管密度的增加与NSCLC的分期和预后密切相关。一直以来,VEGF都被认为是调节肿瘤血管生成的重要因子,高VEGF水平与不佳的临床预后相关,抑制VEGF通路是抗肿瘤的关键机制。之前有研究称,EGFR和VEGF享用共同的下游信号通路,同时在EGFR突变型NSCLC细胞中,EGFR的激活可能通过上调缺氧诱导因子-1α诱导VEGF的表达[8],VEGF也可以代替EGFR,通过激活PI3K/Akt通路促进生存效应支持肿瘤生长,并通过激活MAPK途径促进肿瘤增殖[5,9]。这为EGFR-TKI联合抗血管生成药物治疗提供了理论基础。JO25567试验是第1个在该领域开展的试验,还有后来在ASCO会议上公布了实验数据的NEJ026临床试验都相继展示出厄洛替尼联合贝伐珠单抗组优于单药厄洛替尼组的结果,在NEJ026临床试验中,厄洛替尼联合贝伐单抗组患者的PFS显著高于单独接受厄洛替尼的患者[5]。
在本研究中,患者接受贝伐珠单抗联合EGFR-TKI治疗,效果更加显著,ORR高于EGFR-TKI联合化疗组。在不良反应方面,A+T组以骨髓抑制、高血压为主,而C+T组胃肠道反应、骨髓抑制、肝毒性更为常见,相比较而言,A+T组耐受性更好一些。但是两组患者在中位PFS的对比上,仅在脑转移亚组中,A+T组的PFS高于C+T组,这可能与贝伐珠单抗可以改变血管通透性进而减轻患者脑水肿改善预后有关。
在一代、二代靶向药物的应用中,最终不可避免地都会出现耐药,在其中以T790M突变更为常见,大约占60%,ARUA3研究证实了奥希替尼在T790M阳性的NSCLC患者中可以获得较好的临床疗效,出现T790M突变的患者会从续贯奥希替尼中获益[10-11]。而对于T790M阴性的患者,对于其的处理还存在一定的争议,但是目前来说可能更以含铂类化疗为主[12]。在本研究中,A+T组患者在进展后耐药类型T790M突变率更高,这表明该类患者更容易从续贯治疗中获益。
综上所述,由于治疗时间长,C+T组的不良反应会更严重一些,但是基本上可控。同时就患者的长期获益来说,C+T可能更加优于A+T方案。鉴于这项回顾性临床研究样本量小,还有待于更大样本量的临床研究证实。期待有更多更有效的药物或联合治疗策略来进一步改善晚期NSCLC患者的预后,为患者带来更多生存希望。
