Fe3O4@MSCe/H2O2多相芬顿体系的分解性能及放热规律研究
2021-12-21闫云涛程星星
闫云涛, 张 柯, 程星星, 董 勇
(山东大学 能源与动力工程学院,燃煤污染物减排国家工程实验室,环境热工技术教育部工程研究中心,山东省能源碳减排技术与资源化利用重点实验室,济南 250061)
能源与环护是当今人类社会发展过程中的两大课题,在环境保护的同时兼顾能源回收的技术受到越来越多的关注. 垃圾焚烧发电技术是在消除生活垃圾污染的同时,通过焚烧发电的方式将垃圾的化学能转换为电能[1-2];厌氧消化技术是在处理污泥或高浓度有机废水的同时,将污泥或高浓度有机废水中的有机物转变为沼气等可再生能源[3-4];烟气余热回收技术是在净化锅炉烟气的同时,将烟气中的余热进行回收[5-6],等等. 上述技术均已获得了充分的研究和普遍应用,但污水高级氧化处理过程放热规律及热能利用技术的研究未见报道.
污水源热泵技术是利用输入少量高品位电能,将城市污水中不能直接利用的低品位热能提升为可用于企业生产或冬季供暖的高品位热能的绿色能源技术. 但是,由于受到冬季污水温度和环境排放温度的双重限制,提热后污水的可允许温度降低幅度一般控制在5 ℃左右,较低的水温降低幅度严重制约了热泵的提热量. 因此,研究污水处理过程伴有副产物热能,且可引起污水温度升高5 ℃左右及以上的技术,即可成倍提升污水源热泵的对外供热量,对污水的能源化利用具有重要意义.
多相芬顿催化氧化技术是一种典型的高级氧化技术[7-8],其主要利用反应过程产生的羟基自由基(·OH)来氧化污水中的难分解有机物,使水体中难分解的有机污染物实现高效矿化[9-10]. 多相芬顿催化氧化技术克服了均相芬顿催化氧化技术pH值适用范围窄、铁泥产量大的问题[11-12],具有pH值适用范围较宽、不产生或少量产生铁泥、催化剂可以重复利用的优点[13-14]. 目前非均相芬顿反应机理认为,非均相芬顿催化剂首先将H2O2分子和目标污染物分子吸附在催化剂的表面[15-16],固定在载体结构内或分散在载体表面的活性金属催化H2O2产生羟基自由基(·OH),羟基自由基(·OH)攻击目标污染物分子,促使目标污染物分解[17-18]. 非均相芬顿催化剂的吸附性能主要来自于催化剂的载体,因此,目前常用的催化剂载体均具有比表面积大和吸附性能强的特点[19-20]. 纳米碳管[21]、氧化石墨烯[22]、树脂[23]、分子筛[24]、活性炭[25]、粘土[26]等是目前较为常用的多相芬顿催化剂载体,具有多相Fenton催化剂载体所需要的主要特征. 但是,现有芬顿催化剂载体存在价格较高或制备过程复杂的缺点,因此寻求廉价易得,易于改性的催化剂载体成为一个研究的热点.
半焦是泥煤、褐煤或高挥发分的烟煤等经低温(500~700 ℃)干馏得到的固体产物,具有较为丰富的孔结构和较高的吸附性能,价格远低于常用的多相芬顿催化剂载体. 因此,本文以5~8 mm粒径半焦为载体,制备一种价格低廉的半焦负载Fe3O4复合材料(Fe3O4@MSCe),以难分解有机物邻苯二胺为目标污染物,研究Fe3O4@MSCe/H2O2多相类芬顿体系在分解邻苯二胺模拟废水过程中的分解性能和放热规律,为解决现有芬顿技术存在的问题和污水处理的能源化利用提供理论依据.
1 实验材料和方法
1.1 Fe3O4@MSCe的制备
半焦的改性:称取500 g粒径为5~8 mm的半焦于1 000 mL烧杯中,用去离子水冲洗洁净,然后用500 mL浓度为1.5 mol/L的氢氧化钠溶液浸泡24 h. 碱液浸泡完成后,用去离子水充分冲洗半焦至中性,然后用500 mL浓度为1.0 mol/L的硫酸溶液浸泡24 h. 酸液浸渍完成后,用去离子水充分冲洗半焦至中性. 然后将洗涤后的半焦于200 ℃干燥箱干燥12 h得到改性半焦(MSCe).
复合材料的制备:称取500 gMSCe放入500 mL浓度为0.4 mol/L的硫酸铁和0.4 mol/L硫酸亚铁混合溶液中,充分搅拌浸泡,24 h后过滤取出;将过滤后的半焦放入到500 mL浓度为0.6 mol/L的氢氧化钠溶液中浸渍,静置2 h后过滤取出;将样品用去离子水洗涤至溶液呈中性,然后将洗涤后的样品于200 ℃干燥箱干燥12 h 得到Fe3O4@MSCe复合材料.
1.2 实验装置与方法
仪器:pH测试仪(PHS-3C型,上海佑科仪器仪表有限公司),温湿度记录仪(TH22R-XX型,深圳市华汉维科技有限公司),COD测试仪(JHR-2型,青岛金仕达电子科技有限公司),场发射扫描电子显微镜(Quanta 400 FEG),X射线能谱仪(Edax appllo xl),X射线光电子能谱(Thermo ESCALAB 250Xi),X-射线衍射仪(SmartLab 3KW),傅里叶变换红外光谱仪(Thermo Scientific Nicolet iS50).
试剂:邻苯二胺(C6H8N2)、30%H2O2、Fe2(SO4)3、H2SO4、NaOH、Ag2SO4、(NH4)2Fe(SO4)2·6H2O、K2Cr2O7,试剂均为分析纯试剂(国药集团化学试剂有限公司).
实验装置:如图1所示,反应在500 mL圆底烧瓶内部进行,烧瓶内部设有测温管和搅拌杆,搅拌杆通过烧瓶口与搅拌机相连接,测温管通过导线与温湿度记录仪相连接,圆底烧瓶外壁包裹有保温层,保温层将圆底烧瓶外表面全部覆盖.

1—测温管; 2—温湿度记录仪; 3—搅拌机;
模拟废水的配制:用精密天平准确称取一定质量的邻苯二胺药剂,用去离子水在2 000 mL容量瓶中配制成一定浓度的邻苯二胺模拟废水. 模拟废水的pH用0.05 mol/L的硫酸溶液和0.1 mol/L的氢氧化钠溶液进行调节.
分解实验:将盛有邻苯二胺溶液的容量瓶放置在高于实验初始反应温度10 ℃左右的恒温水浴锅内,持续加热苯二胺溶液至接近水浴温度备用. 实验前,先后将称量好的Fe3O4@MSCe催化剂和300 mL加热好的邻苯二胺溶液倒入到图1实验装置的圆底烧瓶内,开启搅拌机(600 r/min),实验系统自然冷却. 邻苯二胺溶液温度降至设定的反应初始温度时,向邻苯二胺溶液中投加H2O2,同时启动温湿度记录仪,记录溶液的反应温度和反应时间,数据记录的频率为每10 min一次,采用重铬酸钾法来测定溶液的COD.
2 实验结果与讨论
2.1 SEM分析
图2为样品的SEM谱图和EDS能谱图. 由图2(a)和(b)可以看出,纳米颗粒均匀地分散在MSCe表面而没有团聚,促使暴露在催化剂表面的活性点位增多,增加了Fe3O4@MSCe复合材料的催化活性[27]. 由图2(c)和(d)对比后可以看出,MSCe样品负载前主要由C、O、Si、S、Ca等5种元素组成,负载后主要由C、O、Si、S、Ca、Fe等6种元素组成,表明Fe元素成功负载于Fe3O4@MSCe样品之上.
2.2 XPS分析
图3为Fe3O4@MSCe样品的XPS谱图. Fe2p的高分辨XPS光谱图(图3(a))显示, Fe2p的光谱图分峰拟合为5个单峰,分别对应Fe2+(711.6 eV和725.4 eV)、Fe3+(714.5 eV和732.5 eV)和卫星峰(719.1 eV),Fe3+与Fe2+的比例约为1∶2,表明Fe3O4@MSCe样品中的铁元素主要以Fe3+与Fe2+的形式存在. O1s的高分辨XPS光谱图可拟合为4个峰(图3(b)),其结合能分别为536.6 eV、533.9 eV、531.2 eV和529.4 eV,其中结合能529.4 eV归属于Fe氧化物的O-Fe键,结合能为533.9 eV和531.2 eV分别对应O=C键和O-C键,位于536.6 eV处的O1s特征峰可能归属于Na KLL,表明Fe3O4@MSCe样品中的铁元素主要以Fe的氧化物形态存在于复合材料中.

(a)

(c)

(b)
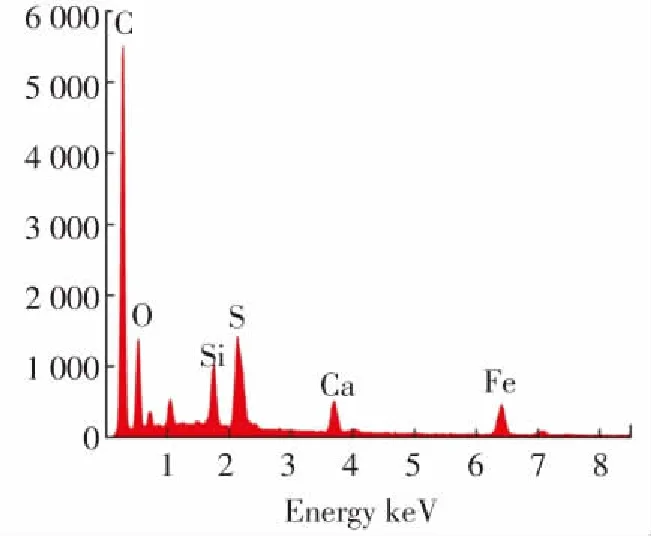
(d)
2.3 XRD分析
图4为Fe3O4@MSCe样品的XRD谱图. 从图4可知,Fe3O4@MSCe样品在2θ=30.12°,35.48°,49.58°,57.03°处出现了新的衍射峰,对比Fe3O4标准卡片(PDF:88-0866)可知,2θ=30.12°,35.48°,57.03°处衍射峰对应的晶体为Fe3O4,样品中的Fe3O4为等轴晶系磁铁矿相[28],说明Fe3O4已成功负载到MSCe载体表面;对比Fe2O3标准卡片(JCPDS:78—1996)可知,2θ=49.58°处衍射峰对应的晶体为Fe2O3[24],表明Fe3O4@MSCe样品中的晶体中还含有部分Fe2O3.
2.4 FTIR分析
图5为Fe3O4@MSCe的红外光谱图. 从图5可以看出,Fe3O4@MSCe样品的红外光谱图出现了546.2 cm-1伸缩振动峰,此处的红外波段吸收峰为Fe3O4中的Fe—O振动[29],进一步表明 Fe3O4成功负载于MSCe之上. 另外,3423.5 cm-1为O—H的伸缩振动吸收峰;2915.4cm-1为-CH2-的伸缩振动峰;1 592.9 cm-1为C=C的伸缩振动峰;1 420.3 cm-1为-CH2-、-COOH、-CH的伸缩振动峰;1 160.5 cm-1为硫酸盐SO42-的反对称伸缩峰;1 060.2 cm-1为C-O、C-C的伸缩振动峰,805.1 cm-1为无定型SiO2的伸缩振动峰,727.5 cm-1为-CH2-的伸缩振动峰,表明Fe3O4@MSCe样品含有大量官能团,有利于样品对溶液中游离分子的吸附.

(a)

(b)
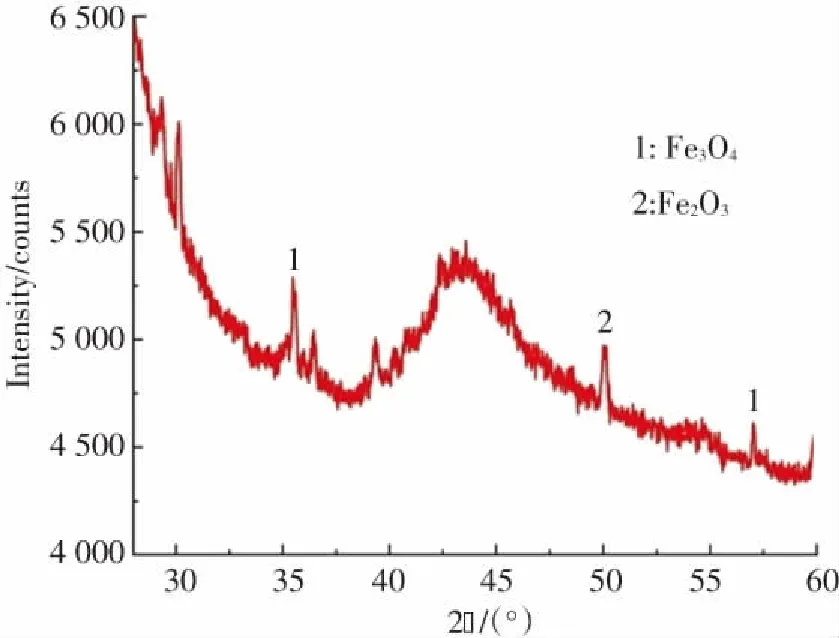
图4 Fe3O4@MSCe的XRD谱图
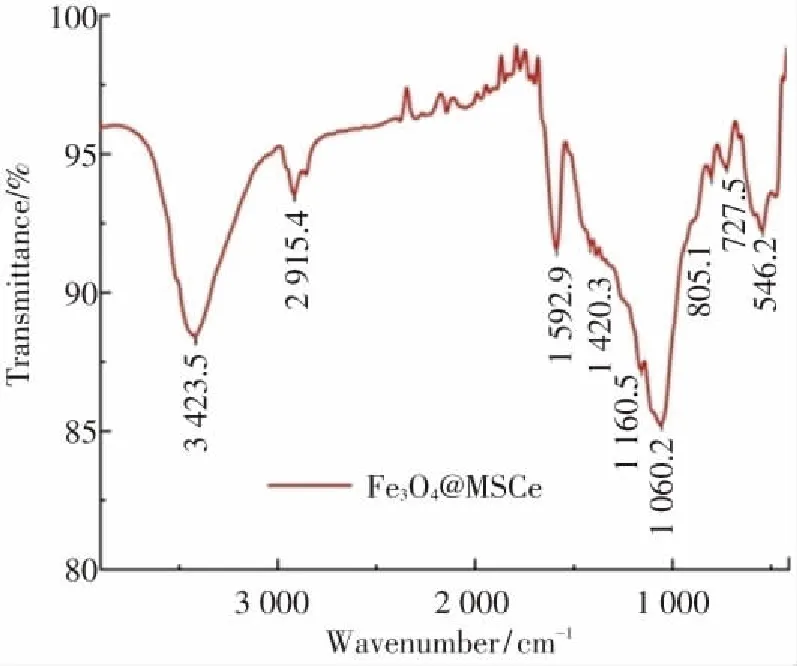
图5 Fe3O4@MSCe的FTIR谱图
2.5 污染物浓度的影响
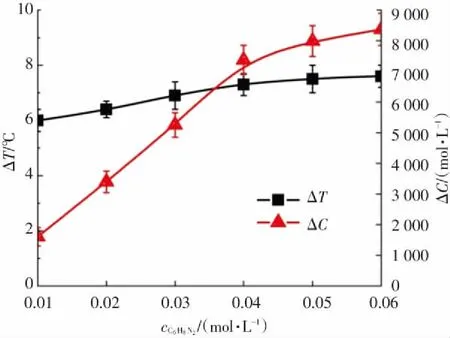
为研究污染物浓度对Fe3O4@MSCe/H2O2多相芬顿体系放热性能和分解放热关联性的影响,反应条件设为:邻苯二胺溶液的体积为300 mL,初始反应温度为30 ℃,H2O2投加浓度为0.25 mol/L,Fe3O4@MSCe催化剂的投加量为533 g/L,反应时间为180 min,调节邻苯二胺溶液的初始浓度由0 mol/L增加至0.06 mol/L,实验结果如图6所示.
由图6(a)可以看出,Fe3O4@MSCe/H2O2多相芬顿体系在自身反应和催化分解邻苯二胺溶液的过程中均出现了溶液温度升高的现象,说明芬顿体系反应过程有热量释放. 溶液中邻苯二胺的浓度为零,即溶液中仅存在Fe3O4@MSCe催化剂、H2O2和去离子水时,Fe3O4@MSCe/H2O2多相芬顿体系自身反应的溶液温升数值低于溶液中含有邻苯二胺时的溶液温升数值. 表明在无污染物存在时,Fe3O4@MSCe也可以催化H2O2发生自身淬灭反应,但邻苯二胺分子的存在促进了反应放热量的增加.
由图6(b)可知,反应180 min,邻苯二胺溶液的初始浓度由0.01 mol/L依次增加至0.04 mol/L时,邻苯二胺溶液的COD分解量(ΔC)分别为1 608.4 mg/L、3 396.7 mg/L、5 253.5 mg/L和7 374.7 mg/L,溶液温升数值(ΔT)分别为6.0 ℃、6.4 ℃、6.9 ℃和7.3 ℃;继续增加邻苯二胺溶液的初始浓度至0.05 mol/L和0.06 mol/L时,ΔC分别为7 987.5 mg/L和8 370.2 mg/L,ΔT分别为7.5 ℃和7.6 ℃. 邻苯二胺溶液的COD分解量(ΔC)和溶液温升数值(ΔT)均随邻苯二胺溶液初始浓度的增加而增加,但增加幅度依次递减. 这是由于溶液中同·OH和HO2·等自由基反应的邻苯二胺分子的数量随着邻苯二胺溶液初始浓度的增加而增加[30],但增加幅度在达到一定值后依次递减所致.
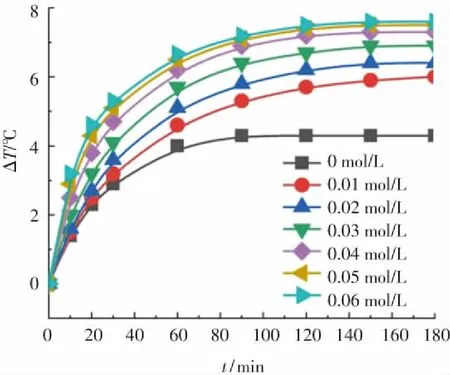
(a)
(b)
在催化剂投加量、H2O2投加浓度等反应条件相同的情况下,溶液中产生的·OH和HO2·等自由基数量可近似认为相同[24],·OH和HO2·等自由基和邻苯二胺分子反应数量增多时,意味着·OH和HO2·等自由基自身消耗数量的减少. 由此可以推出,·OH和HO2·等自由基同邻苯二胺分子反应时产生的热量大于其自身分解过程中产生的热量. 从图6(b)还可以看出,溶液温升数值(ΔT)并未同邻苯二胺溶液的初始浓度或邻苯二胺溶液的COD分解量(ΔC)成正比增长关系,表明·OH和HO2·等自由基同邻苯二胺分子反应时产生的热量仅是Fe3O4@MSCe/H2O2多相芬顿体系分解反应总放热量的一部分,Fe3O4@MSCe催化H2O2产生·OH和HO2·等自由基的过程或H2O2、·OH和HO2·等自由基发生淬灭反应的过程可能也产生了热量.
2.6 催化剂投加量的影响
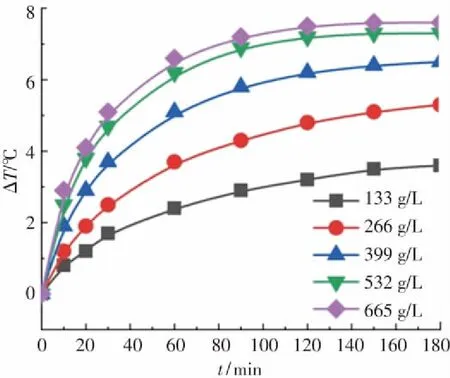
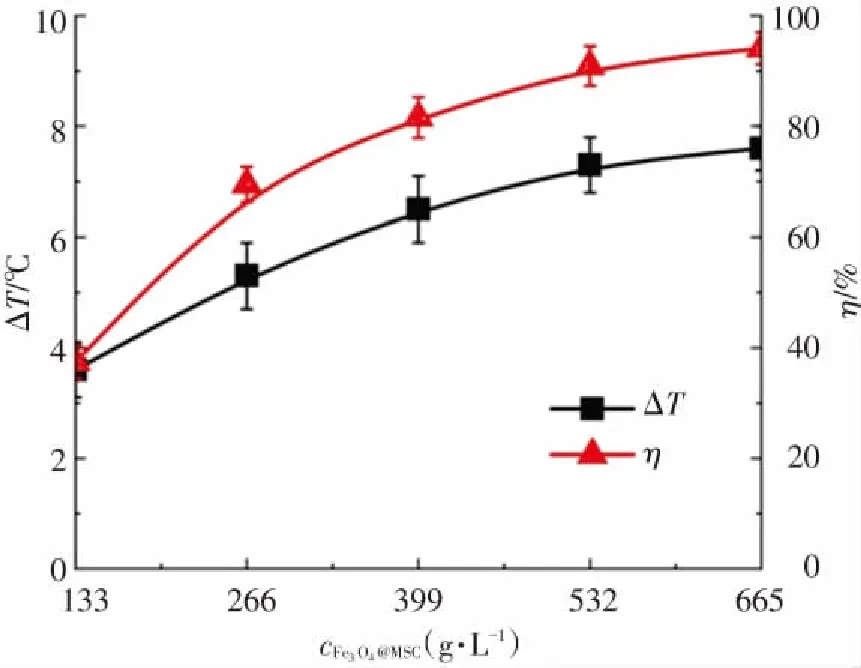
为研究Fe3O4@MSCe催化剂投加量对Fe3O4@MSCe/H2O2多相芬顿体系放热性能和分解放热关联性的影响,反应条件为:邻苯二胺溶液的浓度为0.04 mol/L,体积为300 mL,pH=7.8,初始反应温度为30 ℃,H2O2投加浓度为0.25 mol/L,反应时间为180 min,调节催化剂的投加量由133 g/L增加至665 g/L,实验结果如图7所示. 由图7(a)可知,反应时间均为180 min,催化剂的投加量从133 g/L增加到533 g/L时,邻苯二胺溶液的温度升高数值(ΔT)由3.6 ℃增加到7.3 ℃,溶液温度升高数值随催化剂投加量的增加而增加且增幅较大;催化剂的投加量从533 g/L增加到665 g/L时,溶液的温度升高数值(ΔT)由7.3 ℃增加到7.6 ℃,溶液温度升高数值随催化剂投加量的增加而增加但增幅较小. 这可能是由于多相芬顿体系中的总放热量与体系中的总反应量相关,在H2O2的投加浓度等其他反应条件相同的情况下,体系中的总反应量主要取决于溶液中活性点位的数量和H2O2在催化剂表面的吸附量两个因素. 催化剂的投加量增加时,溶液中催化剂表面活性点位的数量和H2O2在催化剂表面的吸附量均增加[7],H2O2同催化剂的反应量以及由此引起的分解反应量和·OH和HO2·等自由基的淬灭反应量均增加,反应的总放热量相应增加;继续增加催化剂的投加量时,虽然溶液中催化剂表面活性点位的数量继续增加,但由于受到溶液中H2O2投加浓度的限制,H2O2在催化剂表面的吸附量达到极限值后不再增加,催化剂投加量仅是部分提高了H2O2利用率.
从图7(b)可以看出,催化剂的投加量从133 g/L增加到665 g/L时,邻苯二胺溶液的分解率(η)分别为37.4%、69.5%、81.6%、90.9%和94.1%. 邻苯二胺溶液的分解率随Fe3O4@MSCe催化剂投加量的增加而增加[31],但增长幅度依次递减. 这是由于在一定浓度范围内,随着催化剂投加量的增加,催化活性点位增加,单位时间内催化H2O2产生的·OH和HO2·等自由基的数量相应增加,邻苯二胺溶液的分解反应速率和分解率均迅速上升;当催化剂的投加量达到一定数值时,继续增加催化剂的投加量,由于受到溶液中H2O2投加浓度的限制,催化H2O2产生的·OH和HO2·等自由基的数量仅略微增加所致. 由图7(b)还可以看出,邻苯二胺溶液分解率的变化规律和溶液的温度升高数值(ΔT)的变化规律相类似,表明在实验投加量范围内,催化剂投加量的增加可同时增强Fe3O4@MSCe/H2O2多相芬顿体系的放热性能和分解性能.
(a)
(b)
2.7 溶液pH值的影响
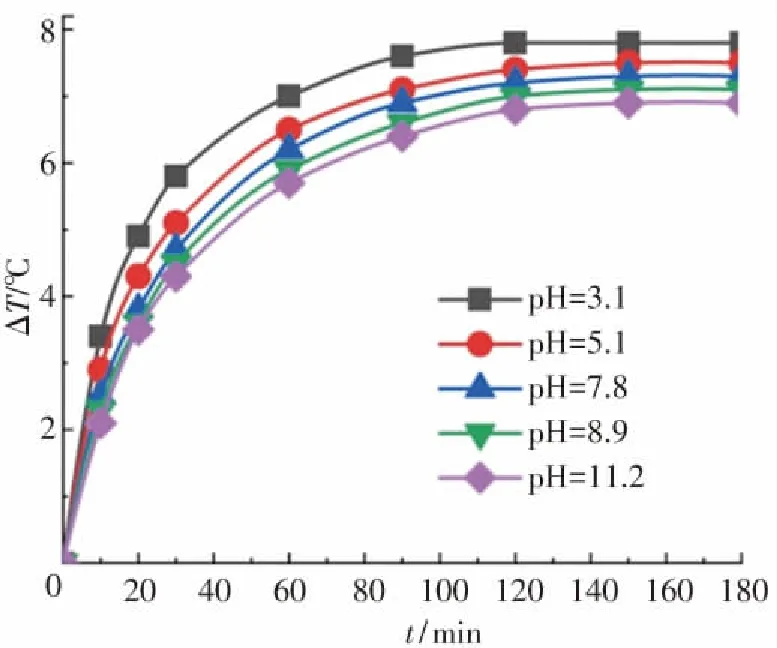
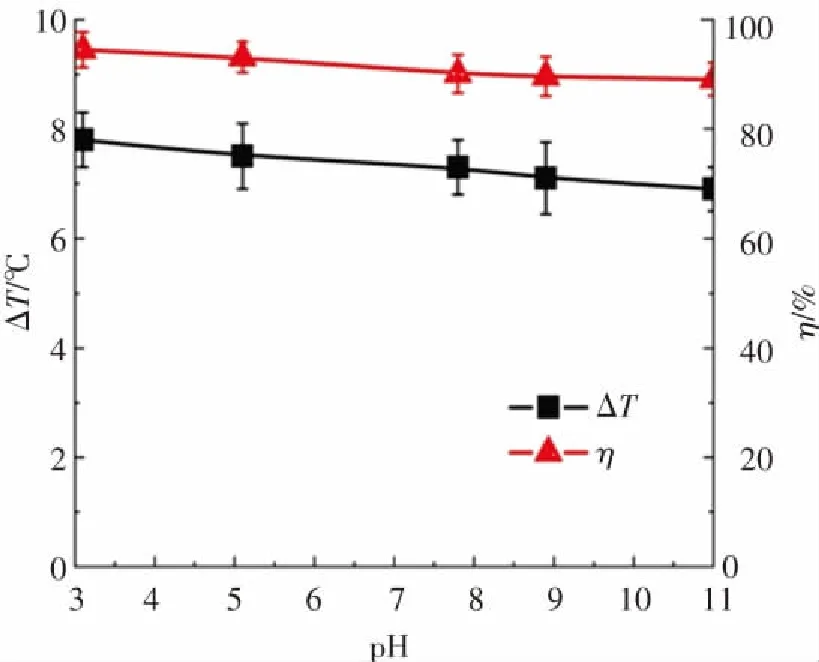
为研究邻苯二胺溶液初始pH值对Fe3O4@MSCe/H2O2多相芬顿体系放热性能和分解放热关联性的影响,反应条件为:邻苯二胺溶液的浓度为0.04 mol/L,体积为300 mL,初始反应温度为30 ℃,H2O2投加浓度为0.25 mol/L,Fe3O4@MSCe催化剂的投加量为533 g/L,反应时间为180 min,调节反应溶液的初始pH值分别为3.1、5.1、7.8、8.9和11.2,实验结果如图8所示. 由图8可知,反应180 min后,溶液的pH值由3.1升至11.2时,溶液的温度升高数值(ΔT)分别为7.8 ℃、7.5 ℃、7.3 ℃、6.7 ℃和6.1 ℃;邻苯二胺溶液的分解率(η)分别为94.5%、93.7、90.9%、85.2%和78.2%. 邻苯二胺溶液的温度升高数值和分解率均随溶液初始pH值的增加略微降低[32],表明溶液的初始pH值对总反应放热量和分解率的影响较小. 由图8还可以看出,在pH=3.1~11.2范围内,溶液pH值对反应的分解率和放热量有近似的影响规律,表明在其余反应条件相同的情况下,溶液pH值对分解反应和放热反应的影响类似.
2.8 H2O2投加浓度的影响
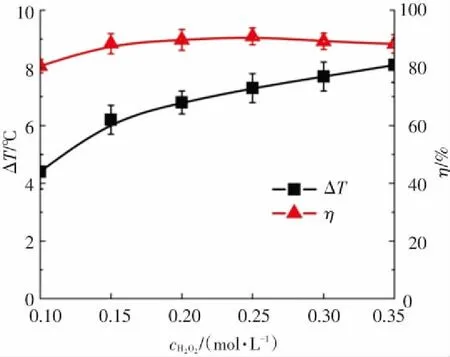
为研究H2O2投加浓度对Fe3O4@MSCe/H2O2多相芬顿体系放热性能和分解放热关联性的影响,反应条件为:邻苯二胺溶液的浓度为0.04 mol/L,体积为300 mL,pH=7.8,初始反应温度为30 ℃,Fe3O4@MSCe催化剂投加量为533 g·L-1,反应时间为180 min,调节H2O2的投加浓度由0.10 mol/L增加至0.35 mol/L,实验结果如图9所示. 由图9(a)可知,Fe3O4@MSCe/H2O2多相Fenton体系在分解邻苯二胺溶液时,不同的H2O2投加浓度对应着不同的溶液温升数值,H2O2的投加浓度从0.10 mol/L增加到0.35 mol/L时,邻苯二胺溶液的温度升高数值(ΔT)值由4.4 ℃依次增加到8.1 ℃,溶液温升数值随H2O2随投加浓度的升高而升高,这是由于H2O2投加浓度越大,溶液中由H2O2起源的相关总反应量越大,所引起的总反应放热量越大所致[33].
(a)
(b)
从图9(b)中可以看出,H2O2的投加浓度从0.10 mol/L依次增加到0.35 mol/L时,反应180 min时,邻苯二胺的分解率(η)分别为80.6%、88.4%、89.7%、90.9%、89.2%和88.3%,η值随H2O2投加浓度的增加呈现先增加后降低的规律. 这是由于H2O2经催化产生的·OH和HO2·等自由基的数量会随着H2O2投加浓度的升高而增多,邻苯二胺分子和·OH、HO2·等自由基反应的数量相应增加,邻苯二胺溶液的分解率随H2O2投加浓度的升高而升高[31];当H2O2的投加浓度达到一定数值再继续增加时,溶液中H2O2、·OH和HO2·等自由基之间的淬灭反应速率也相应增加,当·OH和HO2·等自由基之间的淬灭反应速率超过同邻苯二胺分子之间的反应速率时,邻苯二胺溶液的分解率开始下降[34].

(a)
(b)
由图9(b)还可以看出,分解率随H2O2投加浓度的增加呈现先增加后降低的规律,溶液温度升高数值随H2O2投加浓度的增加呈现近似正比增长的规律,H2O2的投加浓度增加时,邻苯二胺溶液的分解率(η)和溶液温度升高数值(ΔT)并未出现相同的变化规律. 结合上述邻苯二胺溶液初始浓度、催化剂投加量和溶液初始pH值对分解邻苯二胺溶液过程放热性能和分解放热关联性的影响分析可以推导出,Fe3O4@MSCe/H2O2多相芬顿体系的分解性能取决于溶液中和邻苯二胺分子反应的·OH、HO2·等自由基反应的数量,相同条件下,和邻苯二胺分子反应的·OH、HO2·等自由基反应的数量越多,芬顿体系的分解性能越强;Fe3O4@MSCe/H2O2多相芬顿体系的放热性能取决于溶液中总反应量的数量,总反应量的数量越多,分解过程的放热越大[35]. 由上述实验数据可以看出,H2O2的投加浓度是影响放热反应量的主要因素,邻苯二胺溶液初始浓度是影响放热反应量的第二因素,在实验投加量范围内,催化剂投加量的增加可同时提高Fe3O4@MSCe/H2O2多相芬顿体系的放热性能和分解性能.
3 结 论
1)Fe3O4@MSCe/H2O2多相芬顿体系在分解邻苯二胺有机废水的过程中表现出较好的分解性能和放热性能,300 mL浓度为0.04 mol/L的邻苯二胺溶液在[H2O2]=0.25 mol/L、Fe3O4@MSCe投加量为533 g·L-1、pH=7.8、T0=30 ℃反应条件下溶液的η为90.9%,ΔT为7.3℃.
2)Fe3O4@MSCe/H2O2多相芬顿体系在分解邻苯二胺有机废水的过程中,H2O2的投加浓度是影响放热反应量的主要因素,邻苯二胺溶液初始浓度是影响放热反应量的第二因素,在实验投加量范围内,催化剂投加量的增加可同时提高Fe3O4@MSCe/H2O2多相芬顿体系的放热性能和分解性能.
3)自由基同邻苯二胺分子反应的放热量高于自由基自身发生淬灭反应的放热量,特定条件下提高邻苯二胺溶液的分解率有利于提高反应的放热量.
4)本文总结了Fe3O4@MSCe/H2O2多相芬顿体系的分解性能、放热性能以及两者之间的相互关系,对污水处理的能源化利用具有积极意义. 但是有关体系中各反应过程放热量以及反应放热对反应进程的影响等内容的研究还存在不足,后续研究将从各反应过程放热量以及反应放热对反应进程的影响等方面来进行进一步分析.
