NCOA7在缺氧条件下通过AhR调控OSCC细胞糖酵解过程
2021-12-20罗笛谢小燕尹晓敏程秀凤张妮候雅高义军
罗笛 谢小燕 尹晓敏 程秀凤 张妮 候雅 高义军
中图分类号:R739.8 文献标志码:A doi:10.3969/j.issn.1001-3733.2021.06.014
据统计口腔鳞癌患者5年生存率约为50%[1],且半数患者在初次治疗后出现复发或转移[2]。低氧环境下的糖酵解途径加强有助于促进口腔鳞癌的迁移和侵袭[3-4]。而核受体辅激活蛋白7(nuclear receptor coactivator 7,NCOA7)是近年发现在口腔癌发生发展中可能有重要作用的因子,可作为芳香烃受体(Aryl hydrocarbon receptor,AhR)的核共激活因子发挥其作用[5]。研究表明激活AhR可在缺氧条件下明显抑制CD4+T细胞糖酵解效应,而在常氧条件下未产生这些作用[6]。这为研究低氧环境下口腔鳞癌的进展提供了研究思路。
本研究在体外构建了口腔鳞癌细胞株的缺氧模型,并确定了缺氧条件下NCOA7和AhR在口腔癌细胞株中的表达变化及对糖酵解效应的调控作用,深入了解低氧环境下口腔鳞癌发生发展的具体机制。
1 材料与方法
1.1 实验材料
1.1.1 实验标本 收集2019 年07月~2019 年08 月在中南大学湘雅二医院收治的口腔鳞癌患者5 例,分别取每位患者舌部的OSCC组织和OSCC癌旁组织(约癌旁3 cm处)标本,固定包埋,切片。本项研究已通过中南大学湘雅二医院伦理委员会批准[批准号:(2019)伦审第(研138)],并取得患者书面知情同意。
1.1.2 实验试剂 氯化钴(CoCl2·6H2O)(Sigma公司,美国);豆蔻素(Cardamonin)(MedChemExpress,美国);葡萄糖测定试剂盒和乳酸测定试剂盒(南京建成公司);CCK8试剂盒(Dojindo公司,日本);兔抗人NCOA7多克隆抗体(Abcam公司,英国);鼠抗人AhR单克隆抗体(Santa Cruz Biotechnology,美国);鼠抗人HIF1α多克隆抗体(Affinity Biosciences,美国);鼠抗人β-actin多克隆抗体、兔,鼠二抗(Proteintech公司,美国);jetPRIME®转染试剂盒(jetPRIME®公司,瑞士);SYBR Green qRCR 试剂盒(TaKaRa公司,日本)。
1.2 实验方法
1.2.1 免疫荧光双重染色 将标本切片用二甲苯脱蜡,水化。PBS冲洗后,抗原修复-高压热修复,冲洗,非免疫正常山羊血清封闭切片60 min。一抗为NCOA7(1∶200)和AhR(1∶200),4 ℃孵育过夜。荧光二抗在室温下避光孵育30 min,DAPI复染3 min,冲洗,封片。滴加适量抗荧光淬灭封片液后进行显微镜检查。
1.2.2 细胞培养 人舌鳞癌细胞(SCC9)由中南大学湘雅二医院口腔医学研究中心龚朝建教授惠赠。DMEM/F12细胞培养基和10%胎牛血清,添加400 ng/mL氢化可的松培养, 5%CO2,37 ℃。
1.2.3 SCC9细胞缺氧模型的构建 无菌超纯水溶解CoCl2·6H2O至0.1 mol/L,使用时用DMEM/F12细胞培养液稀释,工作液浓度为0~800 μmol/L。CCK8实验用于检测细胞活力。取对数生长期的细胞种入96 孔板,37 ℃孵育,待其生长至亚单层后,每孔更换含不同浓度CoCl2的培养基100 μL,设置不加CoCl2的阴性对照组及无细胞的空白对照组,每组设6 个复孔,干预24 h。检测时,加入10 μL CCK8溶液/孔,37 ℃孵育,每半小时检测450 nm波长光下各孔的吸光度值(A值),各组A值均为1~2 h计算细胞存活率及半最大效应浓度(concentration for 50% of maximal effect,EC50)。细胞存活率(%)=(加药组A值-空白对照组A值)/(阴性对照组A值-空白对照组A值)×100%。同时用WB方法检测细胞中缺氧诱导因子1α(hypoxia-inducible factor 1α,HIF1α)的表达情况以确认缺氧模型诱导成功[7]。
1.2.4 逆转录聚合酶链反应 用TRIzol试剂从SCC9细胞中提取总RNA,反转录成互补cDNA。取1 μg cDNA,使用SYBR Green Master Mix一步法进行扩增。在LightCycler®96仪器上将反应混合物加热至95 ℃持续30 s,将95 ℃持续5 s;60 ℃持续31 s进行40 个循环,后加热至97 ℃持续1 s,以GAPDH为内参。
1.2.5 蛋白质印迹 从SCC9细胞中提取总蛋白。8%的SDS聚丙烯酰胺凝胶电泳分离蛋白,每个泳道25 μg总蛋白。分离后将蛋白转移到PVDF膜上。5%脱脂牛奶溶于TBST溶液用于封闭,室温下封闭60 min。修剪条带,一抗NCOA7(1∶1 000),HIF1α(1∶500)和AhR(1∶1 000),4 ℃孵育过夜。充分洗涤(TBS-T溶液,4×15 min)后,室温下二抗(1∶1 000)孵育1 h。通过化学发光检测将蛋白质条带可视化。以β-actin(1∶1 000)为内参。
1.2.6 细胞转染 按照jetPRIME®siRNA转染试剂说明书中的方案进行转染。转染细胞在5%CO2,37 ℃孵育。正常细胞和转染无义siRNA(siRNA-NC)细胞为对照。
1.2.7 葡萄糖消耗及乳酸生成测定 按照葡萄糖测定试剂盒和乳酸测定试剂盒说明书,以比色法测定培养上清液中的葡萄糖和乳酸含量(检测波长为505 nm),同时使用CCK8实验检测细胞增殖情况,排除由于细胞数目不均产生的干扰。
1.3 统计学分析
2 结 果
2.1 NCOA7和AhR在口腔鳞癌组织中表达
NCOA7(67.66±5.19: 25.94±2.18,t=18.150,P<0.000 1)和AhR(35.02±1.72: 24.94±3.31,t=6.627,P<0.000 1)在口腔鳞癌组织中平均荧光强度高于癌旁组织,即在癌组织中高表达(图1)。

图1 NCOA7及AhR在口腔鳞癌组织及癌旁组织中的表达情况
2.2 氯化钴诱导细胞缺氧模型的构建
随着CoCl2干预浓度升高SCC9细胞出现生长抑制,EC50为386.4 μmol/L(图2A),而HIF1α表达逐步增加(图2B、2C,P<0.01)。故细胞缺氧诱导成功,选350 μmol/L为中心处理浓度。
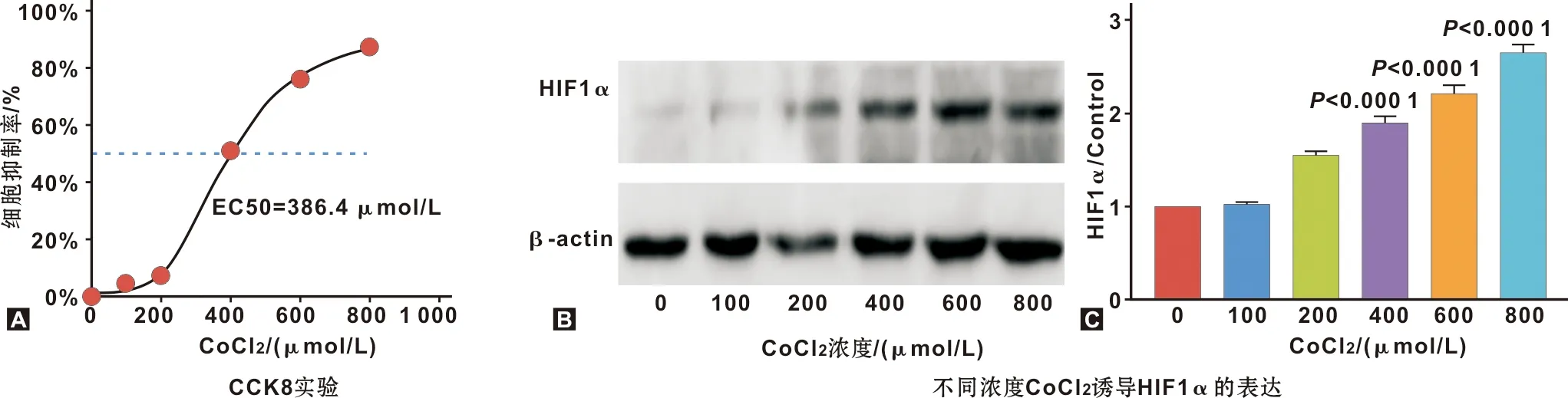
图2 氯化钴诱导OSCC细胞缺氧模型的构建
2.3 缺氧条件下AhR和NCOA7的表达情况
以是否CoCl2干预为常氧组和缺氧组,发现缺氧条件下AhR蛋白表达(图3A、3B,P=0.031 2<0.05,t=3.255)和mRNA表达(图3C,P=0.033 2<0.05,t=3.190)均出现下降,而NCOA7的表达不受影响(图3D~3F)。
2.4 缺氧条件下沉默NCOA7对AhR表达的影响
综合不同浓度siNCOA7的转染效率(图4A)及沉默效率(图4B),选用30 nmol/L为处理浓度。沉默NCOA7后发现AhR蛋白表达(图4C,常氧:P=0.000 9<0.001,t=8.790; 缺氧:P=0.001 9<0.01,t=7.270)和mRNA表达(图4D,常氧:P=0.008 6<0.01,t=4.810; 缺氧:P=0.004 2<0.01,t=5.887)均降低,且缺氧时沉默NCOA7对AhR的蛋白表达抑制率从34.1%升至40.7%(P=0.002 6<0.01,t=6.656),mRNA抑制率从37%升至89.5%(P=0.003 4<0.01,t=6.212)。
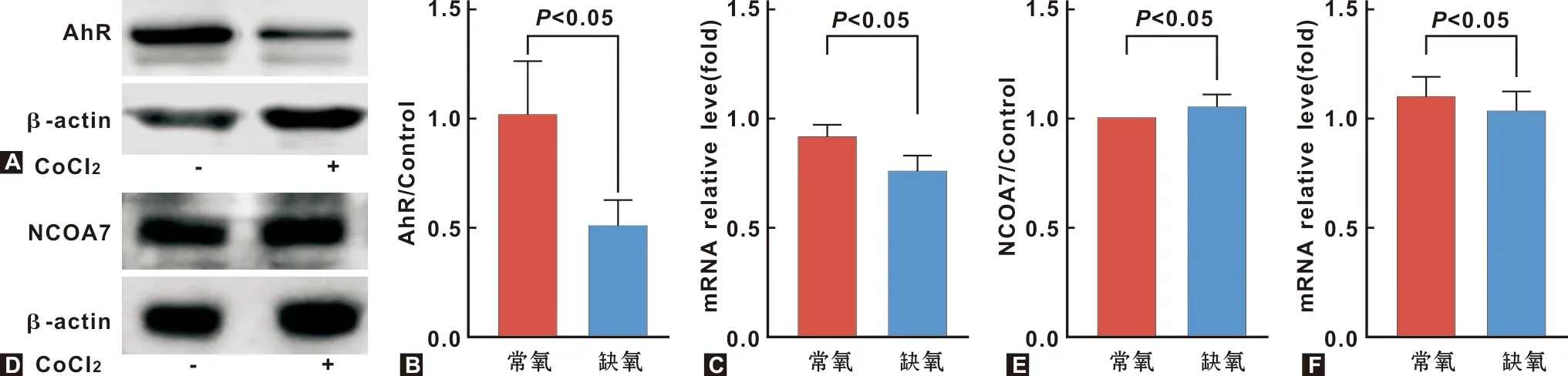
A~B: 常氧及缺氧条件下AhR蛋白的差异表达; C: AhR mRNA的表达差异; D~E: 常氧及缺氧条件下NCOA7蛋白的差异表达; F: NCOA7 mRNA的表达差异
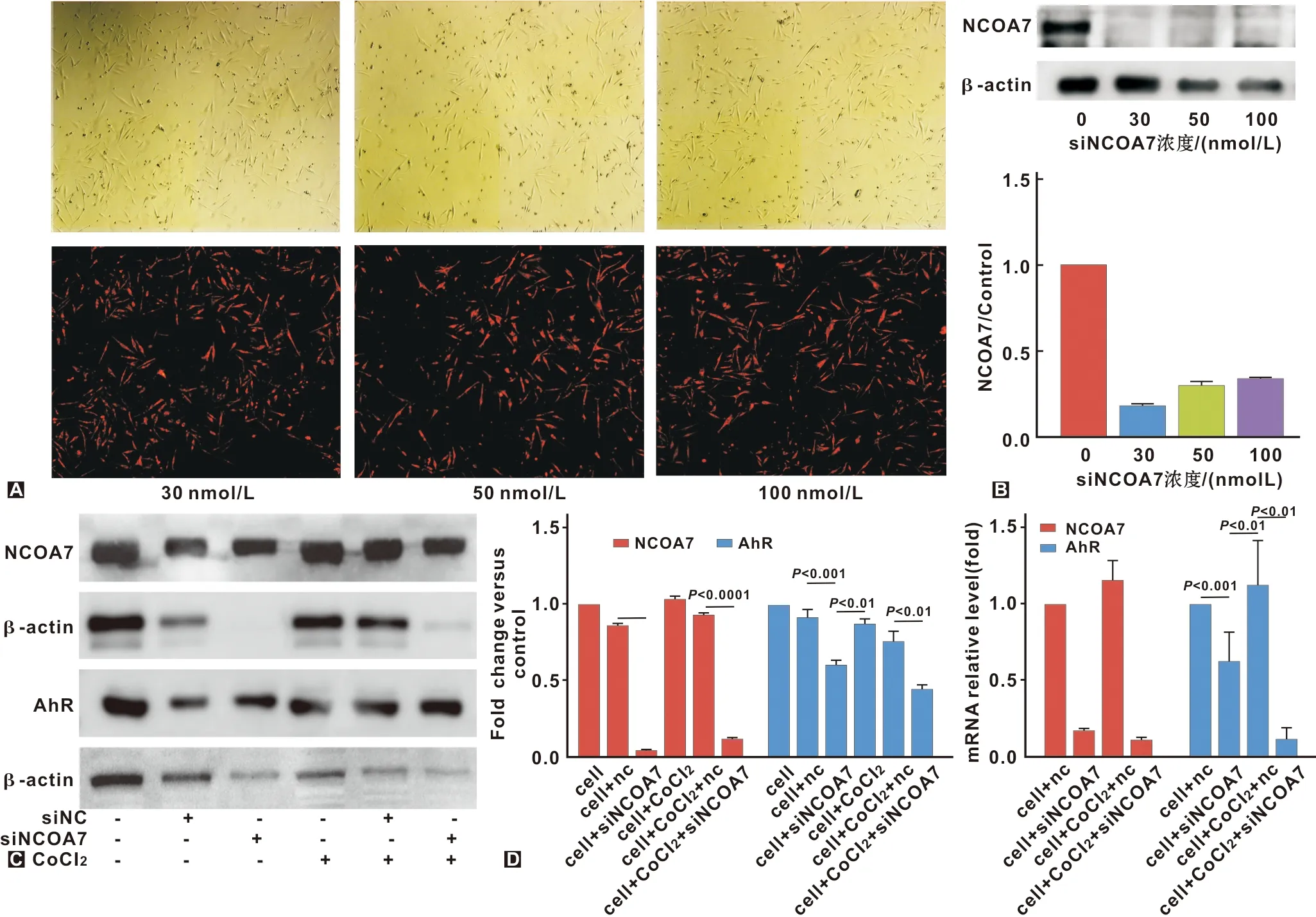
A:siNCOA7(红色荧光标记)转染效率; B:siNCOA7沉默效率; C:常氧及缺氧条件下沉默NCOA7后,NCOA7及AhR的蛋白表达差异; D:常氧及缺氧条件下沉默NCOA7后,NCOA7及AhR的mRNA表达差异
2.5 缺氧条件下NCOA7及AhR对口腔鳞癌细胞糖酵解的调节
图5示缺氧条件下NCOA7沉默细胞糖酵解水平增强(葡萄糖消耗:P=0.017 8<0.05,t=3.883;乳酸生成:P=0.007 0<0.01,t=5.089)。而常氧条件下,无论NCOA7沉默与否细胞糖酵解水平无明显变化。NCOA7沉默细胞用豆蔻素(Cardamonin,AhR激活剂[8],浓度30 μmol/L)干预后,发现缺氧条件下豆蔻素可使沉默NCOA7增强的糖酵解水平回落(葡萄糖消耗:P=0.005 6<0.01,t=5.433; 乳酸生成:P=0.028 7<0.05,t=3.344)。
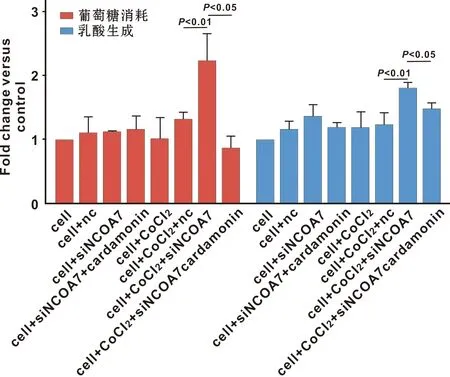
图5 缺氧条件下NCOA7及AhR对SCC9细胞糖酵解水平的调节作用
3 讨 论
核受体辅激活蛋白7,抗氧化基因OXR家族的一员[9]。芳香烃受体AhR,一种可被多种外源和内源性配体激活的转录因子[10]。AhR受环境中多环芳烃激活后转移到细胞核中与AhR核转运蛋白(ARNT)及其他几种核受体共激活剂(包括NCOA7)形成复合物,这种复合物与癌症的发生有关[11]。本研究发现NCOA7和AhR同时在口腔鳞癌组织细胞核中高表达,佐证了NCOA7是在细胞核与AhR结合而发挥其作用。缺氧环境下AhR表达下降,而NCOA7表达无明显变化。这可能是由于缺氧条件下,HIF1α-ARNT(HIF1α和AhR的共同辅因子)异二聚体的丰度和活性增加抑制了AhR的表达[12]。高效率沉默NCOA7表达后AhR表达下降证明了NCOA7对AhR的正向调控作用。一项有趣的发现是缺氧条件可加强沉默NCOA7对AhR的抑制作用。
糖酵解增强是快速进展型癌症的微环境特征之一[13]。Lv等[6]发现,激活AhR在缺氧条件下可明显抑制CD4+T细胞的糖酵解效应,而常氧下并无调控作用,为研究鳞癌缺氧条件下的糖酵解效应提供了思路。本研究沉默NCOA7后发现同样仅在缺氧条件下癌细胞的糖酵解水平才有所增加。进而为验证AhR是否参与NCOA7对糖酵解的调节作用,本研究使用AhR激活剂(豆蔻素[8])进行干预,发现豆蔻素可使沉默NCOA7增强的糖酵解水平回落。由此缺氧条件下NCOA7可通过AhR干预口腔鳞癌细胞的糖酵解水平。
口腔鳞癌进展过程中缺氧环境可显著增加HIF1α水平,并通过螯合ARNT激活糖酵解效应[12]。而AhR同样受多环芳烃刺激而升高,在细胞核内竞争与ARNT的结合并吸附NCOA7[11]。本研究发现在缺氧条件下NCOA7可通过AhR干预口腔鳞癌的糖酵解水平。这为靶向NCOA7的药物治疗提供了新思路和实验基础。
