全外显子测序检测非综合征型多数牙先天缺失家系中EDAR基因新突变的研究
2021-12-20张红玉杨丽媛孟令强郑书深马文盛杨冬茹沈文静侯彦刘晔任嘉宝
张红玉 杨丽媛 孟令强 郑书深 马文盛 杨冬茹 沈文静 侯彦 刘晔 任嘉宝
中图分类号:R781.9 文献标志码:A doi:10.3969/j.issn.1001-3733.2021.06.011
选择性先天缺牙特指遗传因素导致的一组非综合征型或综合征型先天性牙缺失,常为恒牙缺失,乳牙缺失较为罕见。根据恒牙缺失数目(不含第三磨牙),可将先天缺牙分为Ⅰ型先天缺牙(或称少数牙缺失,1~6 颗牙缺失)(hypodontia)、Ⅱ型先天缺牙(或称多数牙缺失,缺牙数目大于6)(oligodontia)和Ⅲ型先天缺牙(或称全口无牙,所有乳恒牙缺失)(anodontia)。除全口无牙外,发生在恒牙的少数牙缺失及多数牙缺失患病率分别为4.6%~9.6%、0.16%[1-2]。有研究报道,选择性先天缺牙发病与MSX1、PAX9[3]、AXIN2、EDA、EDAR、EDARADD、WNT10A[4]、WNT10B[5],LRP6[6]和GREM2[7]等突变有关。其中EDA、EDAR、EDARADD和WNT10A是非综合征型先天缺牙(non-syndromic tooth agenesis,NSTA)和综合征型先天缺牙(syndromic tooth agenesis,STA)的候选基因。Ectodysplasin-A(EDA)可与其特异性受体ectodysplasin-A receptor(EDAR)结合,并激活转录子核因子-κB(nuclear factor-kappaB, NF-κB)[8]。EDA-EDAR-NF-κB信号通路与WNT通路和BMP通路互有交叉[9],共同在胚胎外胚层的发育中发挥重要作用[10-11]。
EDAR突变导致的综合征型先天缺牙已被广泛报道,Yu等[6]总结文献发现关于STA已报道58 个EDAR突变;然而,在非综合征型先天缺牙患者中EDAR基因突变检出率较低,仅报道了7 个EDAR突变[4,12-14]。近期,Zhang等[15]在一个大样本非综合征型多数牙缺失的患者中又发现5个新的EDAR突变位点。
本研究通过全外显子测序发现一个新的错义突变EDARc.338G>A(p.Cys113Tyr),并证实其为该家系先证者的致病突变;并同时发现1 例已报道的错义突变EDARc.1138A>C(Ser380Arg)[16],为该家系的遗传咨询提供理论依据,拓展了非综合征型先天缺牙的疾病谱。
1 资料与方法
1.1 研究对象
2012~2020 年河北医科大学口腔医院收集的非综合征型多数牙先天缺失家系,经医师检查确认口内牙齿缺失情况。排除拔牙史后,曲面断层检查证实缺牙区无恒牙胚,选取无综合征表现、缺牙数目大于等于6 颗(除外第三磨牙)患者21 例,知情同意后纳入研究对象。选取18 周岁以上、所有恒牙均萌出(除第三磨牙)且无外胚叶器官发育异常的正常对照组成员共100 例。本研究通过了河北医科大学口腔医院伦理委员会审查批准(NO: [2016]004)。
1.2 采集外周血及提取基因组DNA
在知情同意的基础上,针对收集到的家系及对照组成员,采集外周静脉血(4 mL/人),使用20%枸橼酸葡萄糖抗凝。采用小量血液基因组DNA提取试剂盒[天根生化科技(北京)有限公司],提取外周血基因组DNA,-20 ℃冻存备用。
1.3 全外显子测序及Sanger测序
将提取的外周血基因组DNA交由艾吉泰康生物科技(北京)有限公司进行全外显子测序,IlluminaNovaSeq 6000基因组分析仪平台(Illumina,美国)用于对目标区域进行外显子测序。测序产量超过17 550 Mb原始碱基,测序达到的平均深度为138×。使用Burrows-Wheeler Aligner将读数与Genome Reference Consortium Human Build 37(GRCh37/hg19)进行比对。用SAMtools和Genome Analysis Toolkit(GATK)鉴定出单核苷酸变异体和小插入缺失,然后由ANNOVAR进行注释。通过筛选条件:“MAF<1%”、“外显子”筛选出候选致病突变。使用SIFT[17]、PolyPhen-2[18]和Mutation Taster[19]等生物信息学软件对候选突变进行功能预测,排除无功能影响的变异(SIFT预测分值范围为0~1),阈值为0.05,分值越小表示突变对该蛋白影响越显著。分值为0.05~1,预测为T:Tolerated(无害突变); PolyPhen-2(使用HumVar模型)预测评分范围为0~1 分,分值越大表示突变对该蛋白影响越显著,分值为0~0.446预测为B:Benign(良性突变);MutationTaster预测的概率值为0~1,分值越大,表示预测结果的可靠性越高。取值为A、D、N或者P。A:Disease_causing_automatic:已知有害;D:Disease_causing:很可能有害;N:Polymorphism:很可能无害;P:polymorphism_automatic:已知无害;N和P都表示该突变位点可能无害)最终获得可能的致病突变基因及其位点。而后将突变位点信息交由生工生物工程(上海)股份有限公司设计包含该位点的EDAR基因双向引物,并进行PCR以及Sanger测序验证。EDAR的参考序列为NM_022336.4。
1.4 突变位点的保守性分析及构建EDAR突变蛋白质三维模型
通过NCBI数据库(mational center of biotechnology information,NCBI)获取人(>NP_071731.1)、鸡(>NP_001012629.1)、小鼠(>NP_034230.1)、斑马鱼(>NP_001108536.2 )、狗(>XP_005626028.2)、黑猩猩(>XP_024210387.1)、马(>XP_014586337.1)7 种脊椎动物的EDAR氨基酸序列,使用在线工具Clustal Omega(https://www.ebi.ac.uk/Tools/msa/clustalo)对EDAR氨基酸序列进行了跨物种的保守性分析。使用Swiss-Model软件分析EDAR蛋白结构域突变前后的三维结构模型。
2 结 果
2.1 临床表现
检测到EDAR突变的2 个NSTA家系先证者,临床检查均表现为先天性牙齿缺失,皮肤、毛发发育正常,未见汗液、泪液或唾液分泌减少等其它外胚叶器官发育不良的症状。经全面口腔检查和曲面断层X线片证实患者恒牙先天缺失,余留牙齿的形状和大小均较正常。患者1缺失18 颗恒牙,母亲缺失恒牙17 颗,其哥哥与父亲未见牙齿缺失或其他外胚叶器官发育不良(图1);患者2缺失14 颗恒牙,他们的父母均无牙齿缺失(不包括第3磨牙,图1)。
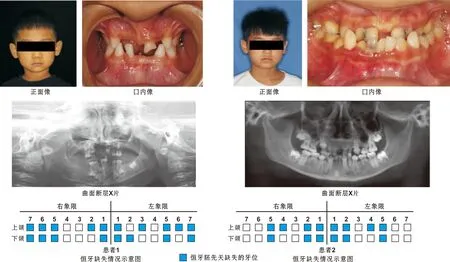
图1 先证者面像、口内像及曲面断层X线片
2.2 全外显子检测及分析
通过全外显子测序以及Sanger测序对21 例非综合征型多数牙先天缺失患者进行检测,在患者1家系中发现1 例新EDAR基因4号外显子错义突变c.338G>A(Cys113Tyr),在患者2家系中发现已报道EDAR12号外显子错义突变c.1138A>C(Ser380Arg)。经Sanger测序验证,患者1EDAR突变遗传自母亲,其哥哥未检测到EDAR基因相同突变位点(图2A);患者2突变遗传自父亲(图2B)。针对EDARc.338G>A(p.Cys113Tyr)突变位点进行生物学预测,SIFT分值为0.00、Polyphen2分值为0.996、Mutation Taster预测评级为Disease_causing,概率值分值为1.00,均提示该突变为有害变异。
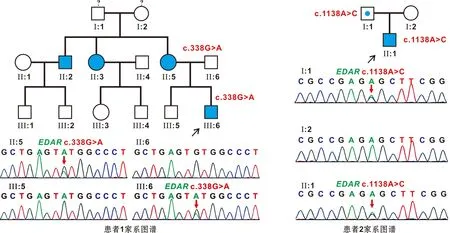
图2 家系测序图
2.3 EDAR突变保守序列分析
进化保守序列分析结果显示:EDARc.338G>A(p.Cys113Tyr)突变位点位于EDAR蛋白胞外配体结合结构域(LBD);而EDARc.1138A>C(p.Ser380Arg)位于EDAR蛋白死亡结构(DD)上,均位于蛋白质功能结构域的保守序列上,并且这两个突变位点在人、鸡、小鼠、斑马鱼、狗、黑猩猩、马中均高度保守(图3)。

图3 保守性分析
2.4 突变EDAR蛋白三维重建分析
EDAR蛋白结构域三维重建发现EDARc.338G>A(p.Cys113Tyr)导致EDAR蛋白在第113个氨基酸处由疏水性残基半胱氨酸突变为侧链体积较大的带有芳香环的极性残基酪氨酸,影响了其与周围残基的相互作用;EDARc.1138A>C(p.Ser380Arg)导致EDAR蛋白在第380个氨基酸处由侧链体积较小的丝氨酸突变为了侧链体积较大的并带有正电荷的精氨酸,引起较大的构象变化(图4)。
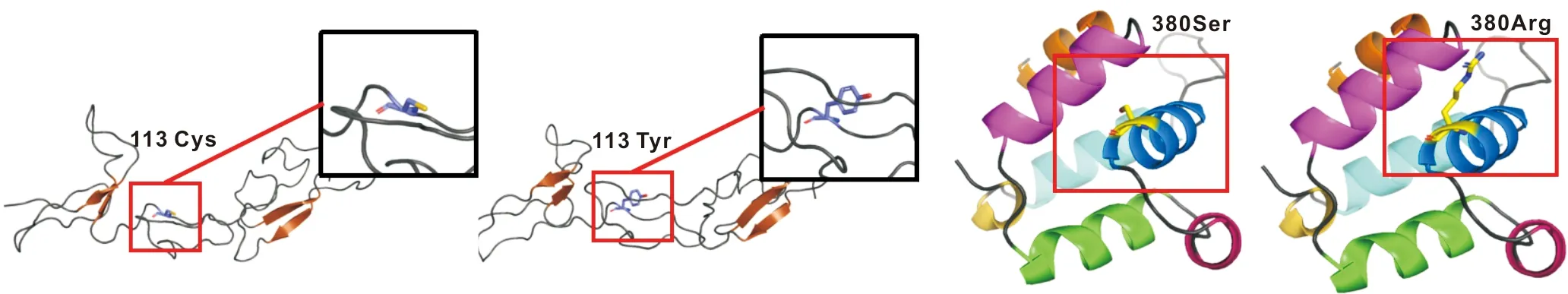
图4 EDAR蛋白功能结构域三维重建
3 讨 论
到目前为止,只有11 个基因与非综合征型多数牙先天缺失相关[20-21]。其中PAX9[22]、MSX1[23]、EDA、AXIN2[24]和WNT10A是最常见的致病基因,而其它6 个基因EDAR、EDARADD、KRT17、NEMO、LRP6和WNT10B很少与非综合征型多数牙先天缺失相关[4-6,21,25]。因此,有必要识别与非综合征型多数牙先天缺失相关的新的候选基因或突变。以往的研究发现EDAR基因突变可导致少汗性外胚层发育不良(hypohidrotic ectodermal dysplasia,HED)[26-27],人类基因突变数据库(HGMD Professional,2018.3)中记录了62 个EDAR的致病突变,其中50 个EDAR突变位点导致HED[28]。近年来学者在NSTA患者中共检测出出12 个EDAR突变位点[4,13-15,29],分布在第2、3、4、5、10、11和 12 号外显子,并且主要集中在EDAR羧基端12号外显子编码的死亡结构域(death domain),以错义突变和无义突变等突变类型居多。非综合征型多数牙先天缺失的EDAR突变已报道的仅10 个[4,13-15],本研究通过对21 个非综合征型多数牙先天缺失家系中发现了一个新的EDAR基因错义突变c.338G>A(Cys113Tyr),生物信息学分析结果显示EDARc.338G>A突变位点在7 个物种间均高度保守。
Zhang等[15]针对112 个非综合征型多数牙先天缺失患者进行了突变筛查,对EDAR突变患者进行了基因型-表型分析,他们研究发现,EDAR突变导致的非综合征型多数牙先天缺失患者最易缺失下颌第二前磨牙,而上颌中切牙均未受影响。然而,本研究两个先证者均发现上颌中切牙的缺失,拓展了EDAR突变的表型。先证者1口内及X线检查发现:11、12、15-17、21、23、25-27、31、32、35、37、41、45-47共计18 颗缺失;先证者2 检查发现:11、12、14、15、21、22、24、25、31、32、35、41、42、45共计14 颗缺失,家系中患病者均未见其它器官的损伤。 Arte等[4]和Mumtaz等[14]研究也认为,前牙区尤其是切牙对于EDAR基因突变的敏感性最高,与本研究的结果一致。导致该现象的原因可能是由于目前报道的非综合征型先天缺牙EDAR突变较少、样本量较小,因此对于EDAR突变的非综合征型先天缺牙患者的基因型-表型关系还有待进一步研究。
EDAR基因定位于2号染色体q11-13,共有12 个外显子。其编码的EDAR蛋白是含有448 个氨基酸的I型跨膜蛋白,有3 个结构域:胞外配体结合结构域(ligand binding domain,LBD)(由外显子3、4和5编码的151 个氨基酸组成),由一个完整和两个不完整的富含半胱氨酸结构域组成跨膜区;细胞内的死亡结构域(death domain,DD)(由外显子12编码的84 个氨基酸组成)。EDAR是TNF受体超家族的成员,EDAR通过胞外配体结合结构域(LBD) 与其细胞外配体EDA结合,细胞内的死亡结构域(DD)招募细胞内EDARADD形成复合物,进而进一步激活下游核因子NF-κB以介导靶基因的转录[28-32]。
本研究通过对EDAR保守序列分析发现,EDARc.338G>A(p.Cys113Tyr) 突变位点在6 个物种中均位于基因的保守序列上,因此该位点的突变对蛋白质的影响较大。同时,本研究通过EDAR蛋白质三维重建发现,EDARc.338G>A(p.Cys113Tyr) 突变位点位于第4号外显子编码的胞外配体结合结构域(LBD)上,编码第113位氨基酸,该突变导致疏水性残基半胱氨酸(Cys)突变为侧链体积较大的带有芳香环的极性残基酪氨酸(Tyr),推测EDAR的Cys113Tyr取代,从而改变EDAR蛋白LBD结构域的空间构象,从而影响与其配体EDA的结合能力。EDARc.1138A>C(Ser380Arg)位于第12号外显子编码的死亡结构域(DD),突变S380R导致EDAR蛋白相应位置由侧链体积较小的丝氨酸(Ser)突变为了侧链体积较大的并带有正电荷的精氨酸(Arg),影响了其与周围残基的相互作用,引起较大的构象变化,这与Zhang等[15]的研究一致。因此推测这两个突变位点突变引起EDAR蛋白功能结构域的构象改变,导致信号通路中信号分子的变化,最终影响核因子NF-κB的转录活性,造成牙齿发育障碍。
综上所述,本研究通过全外显子组测序在非综合征型多数牙先天缺失患者中发现了一个新EDARc.338G>A(Cys113Tyr)错义突变,扩大了该基因的突变谱及表型。为协助医疗人员对这种罕见的先天性异常进行基因型-表型分析及基因诊断提供依据,为该家系的遗传咨询提供了理论依据。
(致谢: 衷心感谢所有参与本研究的受试者和医务人员在样本采集、诊断和分析中给予的帮助,同时也非常感谢河北医科大学法医学院和河北省法医重点实验室提供的实验室仪器和技术支持。)
