RNF187在脑胶质瘤中的表达及其与预后生存的关系
2021-12-20赵恒奎尹亚东孙中磊刘英富
赵恒奎,尹亚东,孙中磊,刘英富
(1.枣庄矿业集团滕南医院 外三科,山东 济宁 277606;2.枣庄矿业集团中心医院 神经外科,山东 枣庄 277000;3.沧州医学高等专科学校,沧州纳米技术创新中心,河北 沧州 061001)
胶质瘤是中枢神经系统中常见的恶性脑肿瘤,由于其高侵袭性和增殖能力,无论是手术切除还是联合放化疗都不能彻底治愈[1-2]。随着对脑胶质瘤分子机制的深入研究,发现某些特定基因和蛋白质的变化对神经胶质瘤的预后和生物学特性有很大的影响[3]。环指蛋白187(RNF187),也称为RING域AP-1共激活因子1,是一种包含RING域的泛素E3连接酶[4]。RNF187是生长因子信号的c-Jun共激活剂,对于AP-1在细胞增殖中的功能至关重要[5]。最近的研究表明,泛素连接酶与肝癌、胶质瘤等多种癌症相关[6-7]。泛素化是指翻译后再修饰,调节一系列生物过程,其功能障碍与肿瘤发生有关[8]。Notch1通路在从细胞翻译复制到分化的各种生物学过程中起着基础性的作用,改变Notch1通路不仅会导致多系统发育缺陷,还会导致多种类型的癌症的发生和发展[9-10]。而且,Notch1信号途径促进脑胶质瘤细胞的迁移和侵袭[11]。因此,本研究推测在脑胶质瘤细胞中RNF187的E3泛素化可能与Notch1通路存在某些联系。
1 材料与方法
1.1 材料 人脑胶质瘤细胞系U251(上海中科院细胞库);RNF187沉默腺病毒表达载体AAVrh.10 RNF187 siRNA与无表达基因腺病毒衣壳AAVrh.10 Negative(广州云舟生物科技有限公司);RNF187、Notch1(abcam公司);MTT、Trizol及去RNA酶试剂(Cayman Chemical公司);RT-PCR引物(赛默飞世尔科技有限公司);Tranwell小室、细胞培养板及计数板(康宁公司);DMEM培养基、胎牛血清、胰酶(Gibco公司);其它试剂如非特殊说明均由当地试剂商提供。
1.2 标本来源及分组 脑胶质瘤标本来源于2015年1月至2018年10月我院神经外科首次住院并行手术治疗的患者,根据术后病理49例脑胶质瘤患者纳入本次研究。49例患者中,男24例(49%),女25例(51%);年龄为(39.5±7.5)岁;肿瘤最大径为(4.5±2.1)cm。随访时间为(41±15)个月(27~63个月)。根据神经胶质瘤分级,将Ⅰ级和Ⅱ级肿瘤分类为低度恶性脑胶质瘤组(LM组,n=18例),将Ⅲ级和Ⅳ级的肿瘤分类为高度恶性脑胶质瘤组(HG组,n=31例),商业购买正常非肿瘤性大脑组织用于正常对照(Control组)。本研究获得枣矿集团中心医院伦理委员会批准(审批号:201504001),所有患者或家属均签署知情同意书。
1.3 细胞转染与分组 U251细胞在DMEM 培养基进行常规培养。实验分3组:对照组(Control组)、阴性对照组(Negative组)和RNF187沉默组(RNF187 siRNA组)。Negative组和RNF187 siRNA组U251细胞分别加入等滴度纯化的腺病毒表达载体AAVrh.10 Negative、AAVrh.10 RNF181 siRNA,Control组加入等体积PBS,共培养12 h。根据细胞的密度进行换液或者传代。将一部分细胞用于后续实验,另一部分冻存保种。
1.4 RT-qPCR试验 使用Trizol试剂盒提取细胞内总RNA,利用反转录试剂盒将RNA反转录成cDNA链,利用RT-qPCR试剂盒检测细胞内各蛋白mNRA的表达,GAPDH作为内参。引物序列如表1。
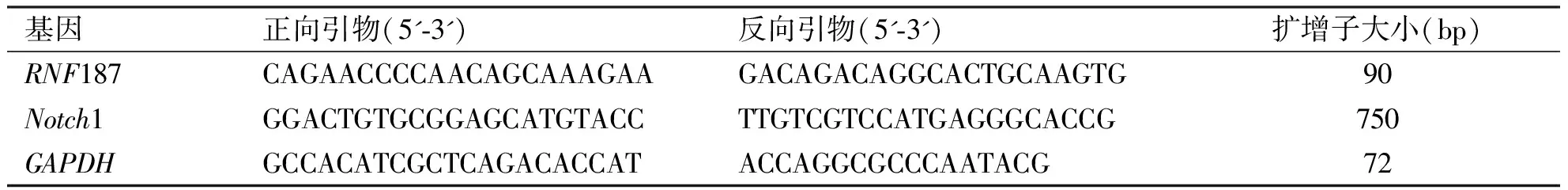
表1 实时PCR中使用的引物序列
1.5 免疫沉淀 用裂解液在冰上裂解细胞30 min,然后4 ℃离心纯化 15 min,在4 ℃下抗体孵育1 h,然后用蛋白质 A 珠在 4 ℃下共孵育2 h, 2×SDS 缓冲液洗脱附在珠中蛋白(100 ℃,10 min),样品离心用于Western blot 分析。
1.6 Western blot检测 分别破碎肿瘤组织和细胞提取蛋白质,电泳分离蛋白后转膜。封闭后4 ℃孵育一抗体Notch1(1∶10 000)、RNF187(1∶10 000)和GAPDH(1∶10 000)过夜。膜清洗后与二抗在室温下孵育1 h。使用增强的化学发光系统(ECL试剂盒)检测免疫反应性条带,以GAPDH为内参,使用Image J 1.42q软件程序分析图像。
1.7 MTT增殖试验 取细胞悬液约100 μL,37 ℃ 5% CO2条件下,在具有完全培养基的96 孔板中培养至约2×105/孔。用20 μL的MTT处理后,相同条件下继续培养4 h,加150 μL DMSO终止反应,用酶标仪测定各孔在490 nm处的吸光值。
1.8 Transwell实验 取各组重悬细胞(1×104/mL)200 μL加入Transwell小室中,培养24 h,取出Transwell小室,PBS清洗后,利用棉签擦去小室薄膜上层细胞后,结晶紫染色薄膜下层细胞后,置于显微镜下计数拍照。
2 结果
2.1 脑胶质瘤中RNF187和Notch1的mRNA 与蛋白表达水平 如图1所示,LM组RNF187和Notch1的mRNA 与蛋白表达水平高于对照组,而HM组RNF187 mRNA 与蛋白表达水平低于对照组,差异具有统计学意义(P<0.05);HM组与LM组相比,RNF187 mRNA 与蛋白表达水平显著下降,差异具有统计学意义(P<0.05)(见图1A~C)。
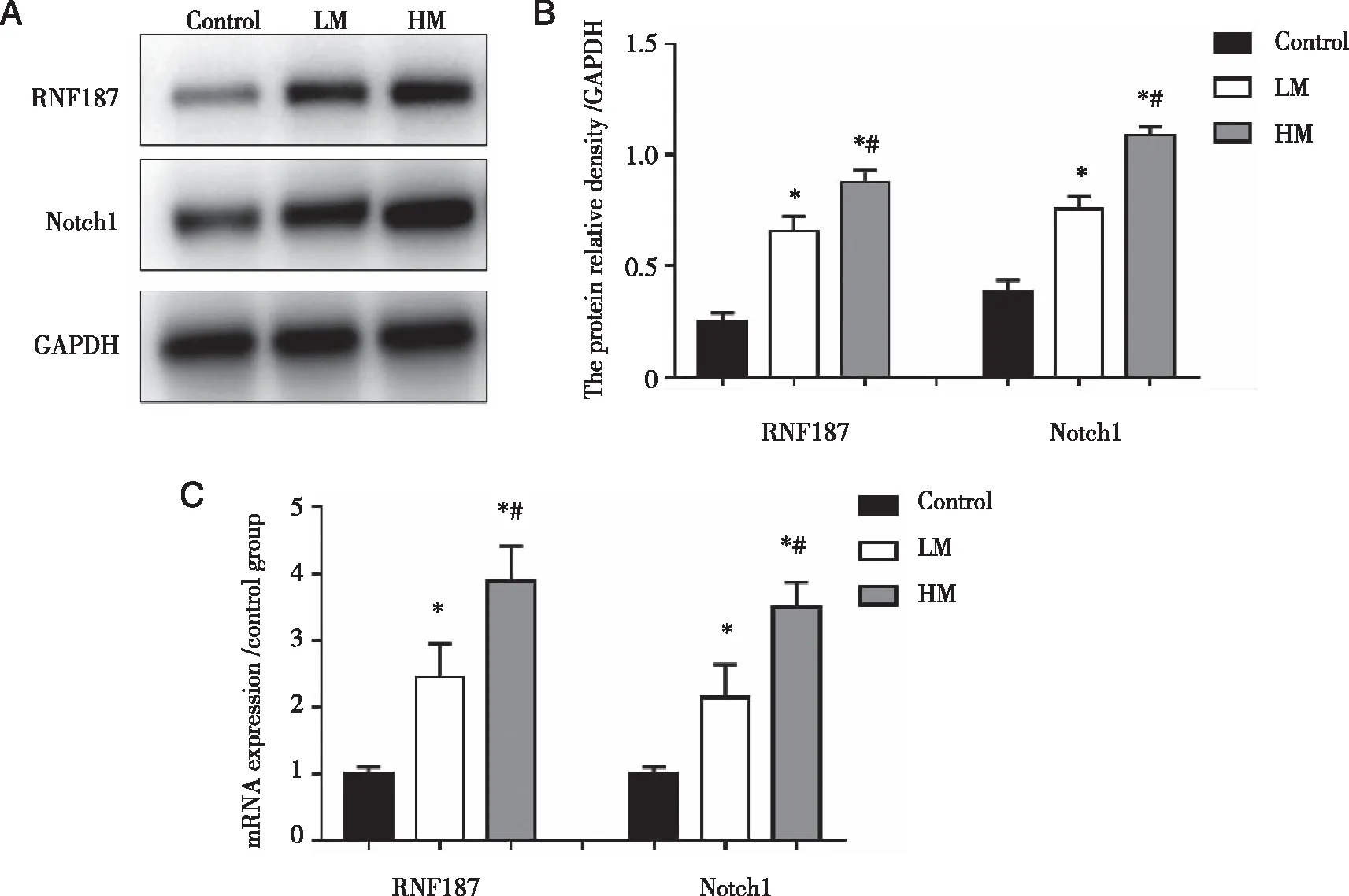
*:与Control组相比, P <0.05;#:与LM组相比,P<0.05。图1 脑胶质瘤中RNF187和Notch1的mRNA与蛋白表达水平
2.2 RNF187表达水平与脑胶质瘤分级和Notch1表达相关性比较RNF187 mRNA表达水平与神经胶质瘤分级正相关(r=0.858,P<0.05),RNF187 mRNA表达水平与Notch1 mRNA表达正相关(r=0.447,P<0.05),按照WHO分级分组,4个分组间差异具有统计学意义(P<0.05,见表2)。

表2 神经胶质瘤各分组RNF187 mRNA比较
2.3 RNF187表达水平与总生存期的影响 将患者分为低表达量RNF187亚组(L组,n=24)和高表达量RNF187亚组(H组,n=25),高表达量RNF187亚组生存率低于低表达量RNF187亚组,差异具有统计学意义(P=0.017,见图2)。
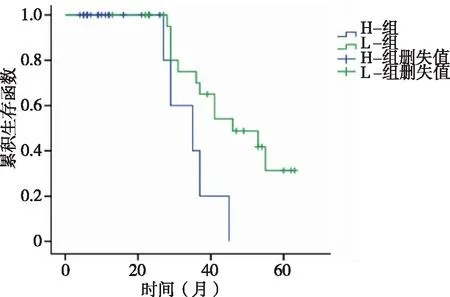
图2 RNF187表达与脑胶质瘤患者 Kaplan-Meier生存曲线
2.4 RNF187沉默抑制Notch1表达 RT-qPCR和 Western blot实验结果显示,与 Control组相比, Negative组RNF187和Notch1的 mRNA及蛋白均没有显著差别(P>0.05),与 Control组和 Negative组相比, RNF187沉默组RNF187和Notch1的mRNA及蛋白表达水平均明显下降(见图3A~C)。
2.5 RNF181与 Notch1蛋白共表达 免疫共沉淀(Co-IP)表明 RNF187可能与SHG-44细胞中的Notch1结合(图 4A)。本研究还分析了阴性对照和沉默RNF181的 Notch1蛋白的半衰期,结果分析表明半衰期分析表明 RNF187沉默显著抑制了Notch1蛋白的稳定性(见图4B、C)
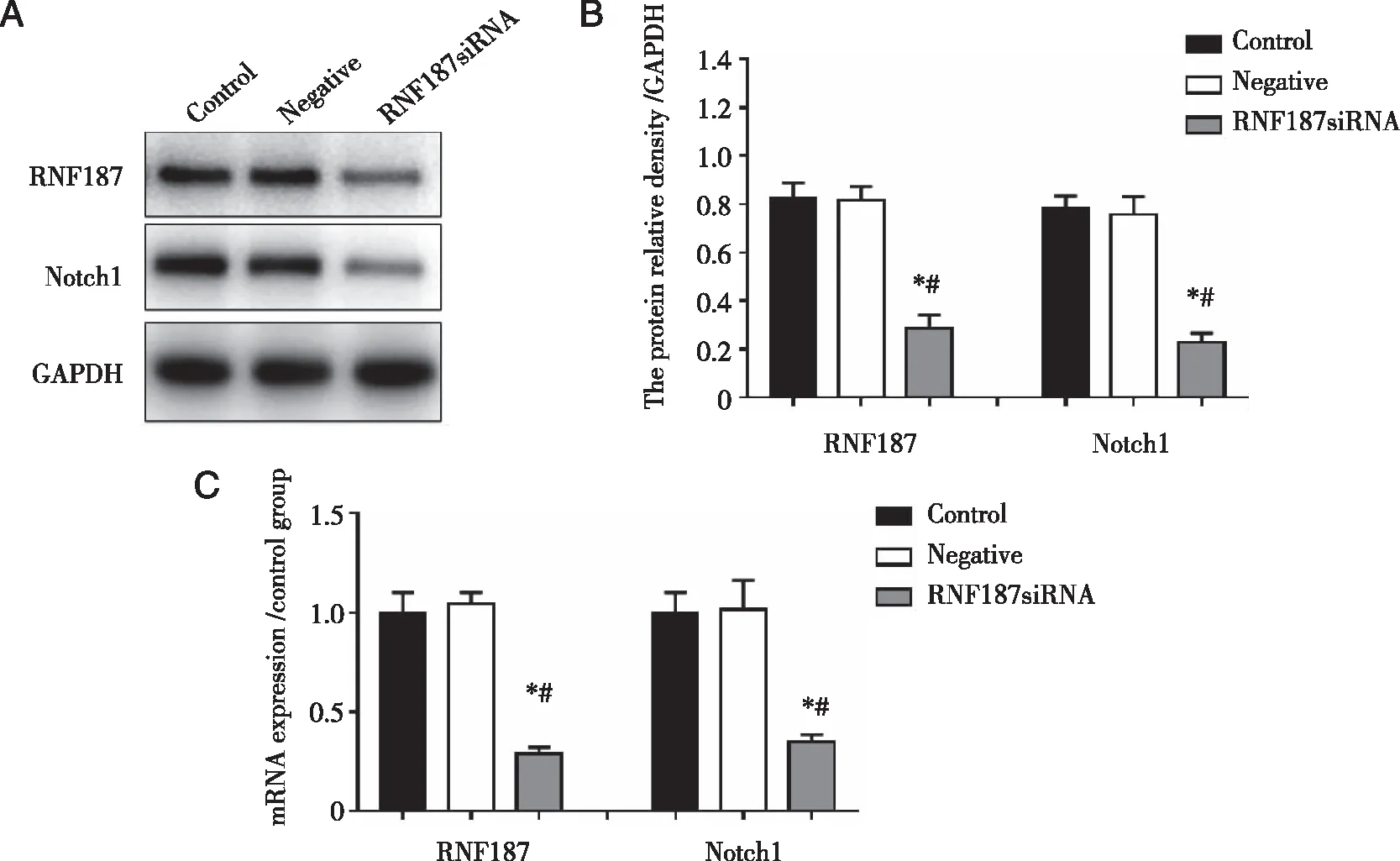
*:与Control组相比, P<0.05;#:与Negative组相比,P<0.05。图3 RNF187沉默抑制Notch1表达
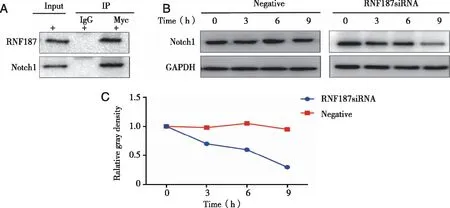
图4 RNF187与 Notch1蛋白共表达
2.6 RNF187沉默抑制U87细胞增殖、迁移和侵袭 MTT实验结果显示,Control组与Negative组细胞增殖率没有差异(P>0.05),RNF187沉默组细胞增殖率明显低于其他两组(P<0.05,图5A)。Transwell实验结果显示,Control组和Negative组相比穿膜细胞数没有差别(P>0.05),而RNF187组的U251穿膜细胞数较其他两组明显降低(P<0.05,见图5B)。
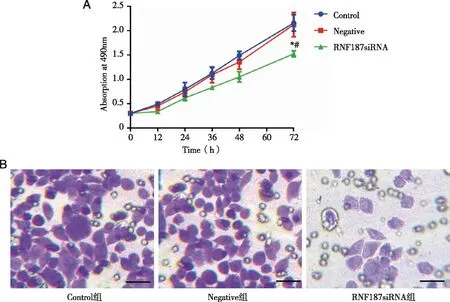
A:MTT实验各组细胞增殖率;B:Transwell实验各组细胞穿膜数,紫色标记细胞核;放大倍数均为400倍;*:与Control组相比, P<0.05;#:与Negative组相比,P<0.05。图5 U251细胞沉默RNF181后细胞增殖与Transwell实验
3 讨论
虽然已经报道了多种生物标记物参与神经胶质瘤的调节,但是目前对神经胶质瘤的分子机制的理解仍然有限,许多潜在的基因需要探索[12]。有研究表明,RNF187作为RING结构域的泛素E3连接酶,在肝癌中RNF187过表达不仅预示着临床病理特征差、预后生存期短,还与肝癌的发生有关[13];在非小细胞肺癌细胞中,RNF187的过表达通过激活MAPK和PI3K信号传导诱导EMT,增加细胞凋亡的抗性[14]。这些研究表明RNF187是肿瘤进展的关键因素。本研究旨在分析RNF187在脑胶质瘤发生发展进程中的作用,以期为脑胶质瘤治疗和诊断提供新的方向。
有研究表明在胶质瘤细胞中RNF2过表达,下调RNF2后促进U87神经胶质瘤细胞凋亡并增强其放射敏感性[15]。而本研究中发现在神经胶质瘤组织中RNF187过表达,而且,神经胶质瘤患者RNF187异常高表达组较低表达组的临床预后更差,总体存活率更低。为了探索RNF187在神经胶质瘤中的作用,本研究在人神经胶质瘤细胞系U251中敲低RNF187,结果抑制了U251细胞活力、增殖、迁移和侵袭。这些结果表明RNF187的表达与脑胶质瘤的恶性度相关,可以用来评估脑胶质瘤的预后生存。 Notch1通路在从细胞翻译复制到分化的各种生物学过程中起着基础性的作用,Notch1异常表达与多种癌症的发生和发展相关[9-10]。在前列腺癌中,Notch1沉默可通过基质金属蛋白酶9(MMP9)和尿激酶纤溶酶原激活剂(uPA)抑制侵袭[16]。Notch1过表达可以通过E-catenin和NF-κB途径促进神经胶质瘤细胞的迁移和侵袭[17]。还有研究表明Notch1通路可以作为胶质母细胞瘤的治疗靶点[18]。本研究分析了49例脑胶质瘤患者RNF187 mRNA与Notch1 mRNA表达的相关性,结果表明RNF187的表达与Notch1的表达正相关。因此,本研究推测RNF187作为泛素化酶参与的多种生物过程可能与notch1参与的生物过程部分重合。Notch1和RNF187表达的结合可预测脑胶质瘤的预后,进一步验证了Notch1/RNF187轴的重要性。这与RNF187在肝细胞癌中联合Notch1介导癌细胞转移的研究结果一致[19]。考虑到Notch1和RNF187表达在脑胶质瘤发生中的关键作用,本研究旨在确定引起Notch1和RNF187表达在脑胶质瘤细胞之间相关性的潜在机制。沉默RNF187后不仅抑制了Notch1的mRNA和蛋白的表达,还抑制了胶质瘤细胞的增殖和侵袭。为进一步分析二者之间的联系,本研究开展了免疫共沉淀实验,结果表明发现RNF187与Notch1共同表达,并且沉默RNF187后Notch1的稳定性降低,Notch1表达抑制。这表明RNF187可能是通过维持Notch1的稳定性调控脑胶质瘤的恶性度。
综上所述,RNF187表达与脑胶质瘤的恶性度正相关,可能是通过Notch1信号途径引起的,为脑胶质瘤的治疗提供新的线索。
