黄连素对脊髓损伤大鼠BMP-4 mRNA表达及神经元活性的影响
2021-12-20仲华,华祥,陈辉
仲 华,华 祥,陈 辉
(1.邛崃市医疗中心医院 骨二科,四川 邛崃 611530;2.陆军军医大学第三附属大坪医院 创伤科 ,重庆 400042)
脊髓损伤(Spinal cord injury,SCI)是临床中常见的疾病之一,其中,该病的主要发病原因为外力损伤,例如:车祸、打击伤、坠落伤等[1]。近年来,SCI的发病率逐年上升,给患者本身带来巨大的影响,同时,给社会造成严重经济负担[2]。骨形态发生蛋白4(BMP-4)是TGF-beita家族中的一员。近年来的研究表明BMP4与神经系统的修复有着密切的关联[3]。研究人员通过免疫组化法发现在整个中枢神经系统的星形胶质细胞、灰质的神经纤维、多巴胺能神经元、去甲肾上腺素能神经元中均观察到BMP4表达,说明BMP4在中枢神经系统发育过程中具有重要作用[4]。黄连素又名小檗碱属于活性生物碱的一种,是从植物中提取的。研究表明,黄连素有抗菌、抗氧化等诸多的药理作用,该药物能够对临床常见疾病有一定治疗效果。既往研究表明,黄连素可减轻SCI小鼠脊髓组织中神经细胞凋亡,这可能与其抑制线粒体氧化损伤,减少Cyt C释放,降低凋亡蛋白表达有关[5-6]。近年来,黄连素在神经系统疾病中的作用日益被重视,但临床中尚未见黄连素对脊髓损伤大鼠体内BMP4表达水平影响的报道[7-8]。因此,本研究探究黄连素(BBR)对脊髓损伤大鼠HE病理、BMP-4 mRNA表达及神经元活性的影响。
1 材料与方法
1.1 动物与分组 在广东省医学SD大鼠中心购买30只雄性SD大鼠,体重224~292 g,鼠龄接近。将所购买的大鼠随机分为脊髓损伤组(S组):该组大鼠制作脊髓损伤大鼠模型;健康对照组(H组):该组大鼠在脊椎做切口后不做任何处理;黄连素组(B组):该组大鼠制作脊髓损伤模型后给予黄连素,每组10只。
1.2 模型制备 采用脊髓钳夹损伤建立模型,大鼠禁食12 h后,使用1%的戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,大鼠俯卧位固定于37℃恒温板上。备皮后消毒铺单,以T8~10棘突为中心做纵向切口,长约3 cm。剥离皮下组织,暴露T8~10棘突及两侧椎板。剪开T9~10的棘间韧带和黄韧带,咬除T9椎板,暴露T9平面脊髓。使用特制的平头镊(尖端为宽5 mm平面,中间有1.2 mm填充物,夹持后留有1.2 mm空隙)从两边加持脊髓,夹持时间为15 s。生理盐水冲洗止血。造模完成后,维持大鼠正常生命,正常进食、饮水,并按摩大鼠腹部,协助排尿、排便。同时,给予B组大鼠腹腔注射黄连素治疗,每天1次,每次10 mg/kg,持续治疗1周。在此期间,所有大鼠在相同环境下生活,并保持鼠笼清洁卫生。
将3组大鼠分别断头处死,完整切取受损脊髓组织,以损伤点为中心切取脊髓1 cm 制成10 %脊髓匀浆,1 600 r/min离心20 min,弃上清液,取脊髓细胞为材料进行后续试验。
1.3 仪器与试剂 黄连素(宁陕国圣生物科技公司,中国);荧光显微镜(上海万衡精密仪器公司,中国);苏木精(宝鸡市辰光生物公司,中国);DBA(上海晶抗生物工程公司,中国)。
1.4 观察指标
1.4.1 流式细胞法 利用Annexin-V-FITC试剂盒对脊髓细胞凋亡情况进行检测,选取1×106个细胞,震荡,静止15 min,将脊髓细胞以2×103个数量置于6孔板,1d后,在细胞内加入少量胰蛋白酶,消化4 h后,用冷藏在-20 ℃的医用酒精固定,静置1 d后,离心,弃去上清液,PBS洗涤多次,每次3~5 min,避光染色,后采用流式细胞仪分析细胞凋亡程度。
1.4.2 Tunel法 将盖玻片置于六孔板内,种入细胞培养过夜,使约为70 %~80 %满。随后严格按照厂家说明书进行TUNEL染色。加Vectashield Hard Set 封固涂片样本,标记反应,于荧光显微镜下观察染色结果并拍照。
1.4.3 HE染色法 取3组大鼠脊髓细胞,固定15 min,乙醇溶液脱水,石蜡包埋后切片4 μm,封闭处理应用山羊血清进行,苏木精和伊红染色液复染分别为6~8 min和10 s,于显微镜下观察3组大鼠脊髓细胞结构改变情况。
1.4.4 免疫组化法 将脊髓细胞脱蜡及水化,并进行烤片处理,将热玻片放入二甲苯中处理2次,每次10分钟,无水乙醇2次,每次10分钟,用H2O2阻断20 min,PBS冲洗3次,将玻片置于0.01M 枸椽酸中修复液,微波修复2次,1次5 min,冷却后,PBS冲洗3次,将非免疫血清滴加于玻片上置37 ℃恒温箱孵育30 min,抹干切片后,滴加特异性抗体,恒温箱孵育20 min,在放入冰箱过夜,滴加标记的二抗,恒温箱孵育,PBS冲洗3次,每张玻片上滴加链亲和素抗生物素过氧化物酶溶液,配置DAB液体,滴加到切片上,直到染色满意后为止,染色后用自来水冲洗,苏木素复染,脱水烘干后用中性树胶封,光镜下观察切片染色情况并摄影,观察BMP-4蛋白表达情况。
1.4.5 qRT-PCR法 按200 μL氯仿/mL Trigol加入氯仿配置氯仿/Trigol试剂,加入6孔板中振荡混匀,室温放置15 min,随后转入EP管中,4 ℃ 12 000 r/min离心15 min,吸取上清水相至另一离心管内,加入吸上清量的0.7~1倍体积的异丙醇,室温放置10~30 min,12 000 r/min离心10 min,弃上清,RNA沉于管底,按1 mL 75%乙醇/mL Trigol加入75%乙醇,温和振荡离心管,悬浮沉淀,4 ℃ 12 000 r/min离心5 min,尽量弃上清超净台吹干10~20 min,加10~50 μL DEPC(焦炭酸二乙酯)处理过的ddH2O溶沉淀,使用one Drop微量分光光度仪测定浓度。按照RNase free dH2O 4.5μL、5×RT反应缓冲液 2 μL、Randam primer 0.5 μL、Oligo dT 0.5 μL、反转录酶 0.5 μL、RNA 2 μL进行反转录反应。将cDNA样品分成3份,每组总cDNA样本稀释20倍,取3 μL的cDNA进行PCR扩增反应。使用5%琼脂糖凝胶电泳验证靶基因的扩增水平。使用LabWorks 4.0图像采集和分析软件进行定量和数据处理。为获得可靠的数据,每组样本重复3次。在本次研究中应用2-ΔΔCt法分析、目标基因的相对表达含量变化。本次研究中使用的引物序列如表1所示。
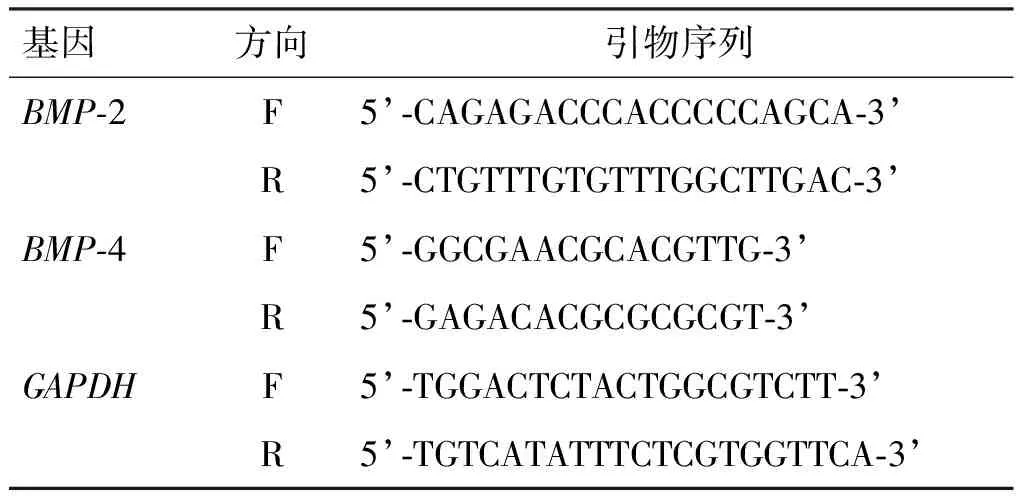
表1 引物序列
1.5 统计学分析 通过SPSS 22.0软件进行结果整理,S、B、H组大鼠脊髓神经元细胞凋亡情况、BMP-4 mRNA的表达含量、BMP-4蛋白阳性表达情况、细胞病变程度的差异性先采用单因素方差分析,若方差分析结果具有统计学意义,再采用LSD-t进行组间两两比较,以P<0.05为差异有统计学意义。
2 结果
2.1 S、B、H组大鼠脊髓中神经元细胞凋亡数量比较 结果显示,H组神经元细胞凋亡数量最少,S组神经元细胞凋亡最多,S组与B组相比较,S组神经元细胞凋亡数量显著多于B组(P<0.05),B组与H组相比较,B组神经元细胞凋亡数量显著多于H组(P<0.05,见图1)。
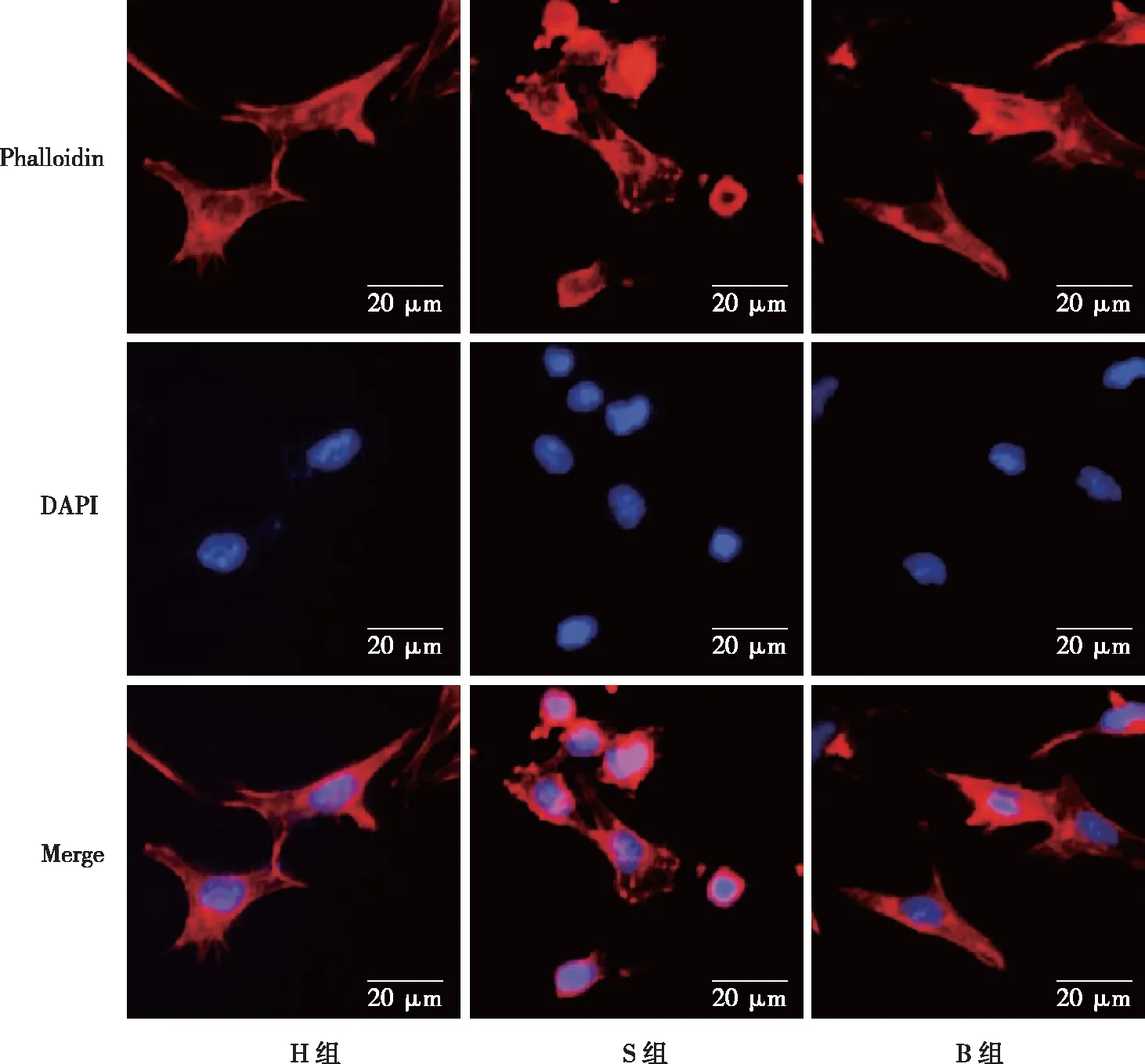
图1 神经元细胞凋亡情况(×200)
2.2 S、B、H组大鼠脊髓神经元细胞凋亡率 结果显示,S、B、H组大鼠神经元细胞凋亡率为(37.36±5.38)%、(28.09±3.75)%、(28.09±3.75)%。S组大鼠神经元细胞凋亡数量最多,H组大鼠神经元细胞凋亡数量最少,B组与S组相比较,B组神经元细胞的凋亡情况显著减少(P<0.05,见图2)。
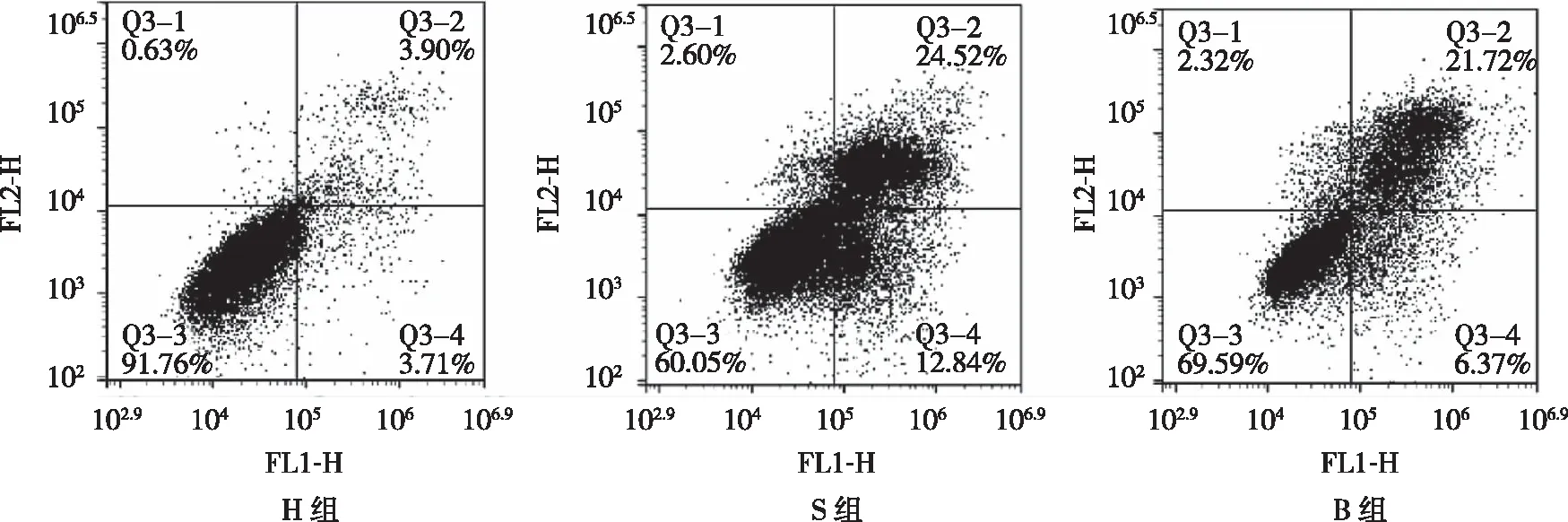
图2 神经元细胞凋亡率比较
2.3 S、B、H组大鼠脊髓细胞病变程度 H组大鼠脊髓细胞正常,未见明显变化,无胶质细胞增生,S组大鼠脊髓细胞出现明显异常,灰白质内有大量出血,有轻度水肿现象,结构疏松化,胞元坏死数目大量增加,与S组比较,B组大鼠脊髓水肿减轻,损伤程度有好转趋势,细胞坏死数目有减少(见图3)。
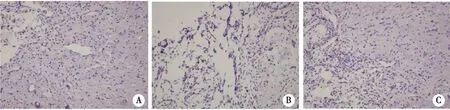
A:H 组;B:S 组;C:B 组。图3 脊髓细胞病变程度(×400)
2.4 S、B、H组大鼠脊髓细胞中BMP-4蛋白阳性表达 由图可知,S组脊髓细胞中BMP-4阳性数最多,H组脊髓细胞中BMP-4阳性数最少,与S组相比较,B组脊髓细胞中BMP-4阳性数显著降低(P<0.05)。与B相比较,H组细胞BMP-4阳性数显著下降(P<0.05,见图4)。
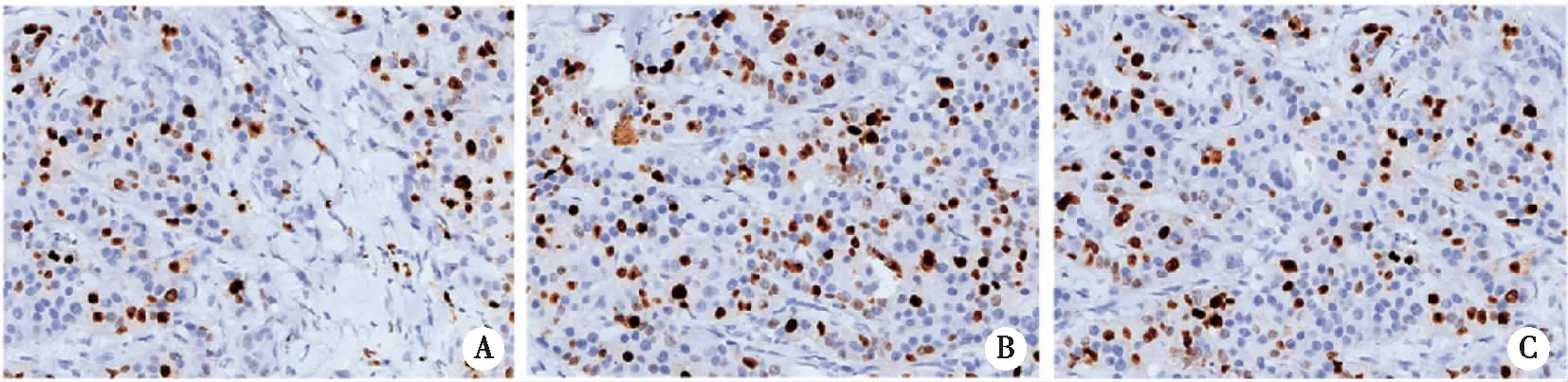
A:H 组;B:S 组;C:B 组。图4 BMP-4蛋白阳性表达(×200)
2.5 S、B、H组大鼠脊髓细胞中BMP-4、BMP-2 mRNA的表达含量比较 qRT-PCR检测结果显示,S、B、H组脊髓细胞中BMP-4 mRNA表达量分别为1.01±0.14、0.67±0.09、0.32±0.07,S、B、H组脊髓细胞中BMP-2 mRNA表达量分别为0.37±0.08、0.69±0.10、0.89±0.12,H组脊髓细胞内的BMP-4 mRNA表达量最低,BMP-2 mRNA表达量最高,S组脊髓细胞内的BMP-4 mRNA表达量最高,BMP-2 mRNA表达量最低,B组与S组相比较,B组大鼠BMP-4 mRNA表达含量显著降低,BMP-2 mRNA表达量显著上升(P均<0.05),H组与B组相比较,H组BMP-4 mRNA表达含量显著降低,BMP-2 mRNA表达量显著上升(P均<0.05,见图5)。
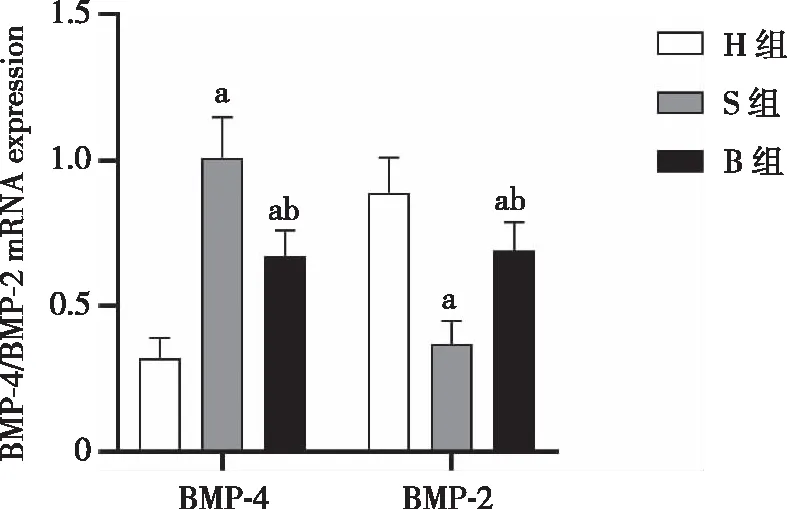
图5 BMP-4、BMP-2 mRNA表达量
3 讨论
脊髓损伤为临床中脊柱损伤最严重的并发症之一,SCI发病原因有多种,可能是暴力外伤引起的,如:暴力压迫、撕裂等,也可能是机体出现异常变化或疾病而引起的[7-8]。SCI的临床表现为脊髓震荡、休克等[9]。脊髓受伤部位不同,所造成的伤害也不近相同,例如:若第一、二脊髓出现损伤,则受伤患者多数立即死亡,救治希望渺茫[10]。SCI对机体造成危害较大,预后差,因此发病时的早期治疗在整个治疗过程中占重要地位,可通过现场救护、急诊救治等专业操作来为患者提供救治。临床中,常采用皮质类固醇、神经节苷脂等药物治疗SCI[8,11]。
黄连素是一种重要的生物碱,是我国应用很久的中药。可从黄连、黄柏、三颗针等植物中提取[12]。它具有显著的抑菌作用。黄连素能对抗病原微生物,对多种细菌如结核杆菌、肺炎球菌等都有抑制作用[13]。黄连素是临床的常用药物之一,近年来发现,黄连素在神经系统疾病中具有一定的效果,例如:AD、癫痫及缺血性脑血管病等,猜测其作用机制可能与其抗炎、抗氧化的药理作用有关[14-15]。黄连素具有显著的抗心力衰竭、抗心律失常、降低胆固醇、抑制血管平滑肌增殖、改善胰岛素抵抗、抗血小板、抗炎等作用,因而在心血管系统和神经系统疾病方面将可能有广泛、重要的应用前景,日益受到重视[16]。本研究结果表明S组脊髓细胞凋亡数量显著多于B组,B组脊髓细胞凋亡数量显著多于H组。与S组比较,B组大鼠脊髓水肿减轻,损伤程度有好转趋势,细胞坏死数目有减少。表明黄连素能够治疗脊髓损伤大鼠,改善大鼠脊髓细胞的病变程度,缓解大鼠神经元细胞的凋亡速率,提高大鼠的神经功能。文献报道,黄连素可以保护血脑屏障的完整性,减少炎症细胞渗透入脑内,也可通过直接抑制胶质细胞的激活,减少炎症细胞因子的分泌,这两种途径可能都参与了黄连素治疗神经系统疾病[17]。动物实验表明[18],在脊髓损伤大鼠体内检测到神经元细胞增殖的活性显著降低,由此猜想,脊髓损伤的发生发展可能通过神经元细胞的活性来展现。在实验中发现,黄连素作用于患病大鼠时,大鼠体内神经元细胞的活性随之上升,且随着作用时间的增长,大鼠的运动功能、神经功能等评分都有显著上升,表明黄连素对脊髓损伤大鼠有一定的治疗效果[19]。大量研究表明[20],黄连素能够抑制脊髓神经损伤大鼠的脊髓细胞凋亡,促进脊髓细胞增殖,显著改善脊髓细胞形态学变化。研究人员[21]给予脊髓损伤大鼠黄连素进行治疗后,试验结果显示,黄连素可以上调大鼠脊髓损伤组织的自噬活性,降低损伤部位细胞的死亡率,从而促进神经功能恢复,且实验结果显示,黄连素是通过降低Caspase-3的表达水平进而减少细胞凋亡的。实验结果表明[22],黄连素在SCI小鼠脊髓组织的康复过程中占重要地位,黄连素能够抑制神经细胞凋亡的速率,促进其再生功能,黄连素这一作用机制可能与其抑制线粒体氧化损伤,降低凋亡蛋白表达有关。黄连素与脊髓损伤的关系为脊髓损伤的诊断和治疗发展提供新的科研方向。
骨形态发生蛋白(BMPs)是一类TGF-β超家族蛋白,不仅参与胚胎时期骨组织的发育,对成年骨缺损修复及机体某些骨疾患的发生过程均有重要意义,而且在脂肪、肾脏、肝脏及神经系统发育中起一定作用[23]。目前已有研究表明,BMPs 在神经系统发育的不同时期、不同部位,均起着相当重要的作用,且对神经干细胞的作用相当复杂。因BMP-2与BMP-4结构相似,属于同一个亚型,与相同的受体结合。在胚胎早期,BMP-2与BMP-4协同作用促使神经系统发生。研究发现[24-25],通过将标记的BMP4移植治疗大脑中动脉闭塞的卒中小鼠模型中,发现梗塞面积明显缩小,说明BMP4具有神经保护功能。我们实验结果发现,与S组相比较,B组大鼠BMP-4 mRNA表达含量显著降低,BMP-2 mRNA表达量显著上升,与B组相比较,H组BMP-4 mRNA表达含量显著降低,BMP-2 mRNA表达量显著上升。试验研究结果表明[26],在正常大鼠脊髓中BMP4 mRNA的表达水平与脊髓损伤大鼠脊髓中BMP4 mRNA的表达水平存在显著差异,其中,后者BMP4 mRNA的表达水平明显升高,表明BMP4在脊髓损伤的过程中占重要地位。报道表明[27-28],下调BMP4的表达能够促进脑缺血大鼠神经树突的生长,同时促进大鼠神经功能恢复,推测BMP4在脊髓损伤的早期起到了保护作用。实验结果表明[29-30],成年SD大鼠脊髓损伤原代培养的细胞中BMP2的表达水平显著低于健康大鼠脊髓细胞中BMP2的表达水平,同时在给予相应治疗后的脊髓损伤大鼠脊髓细胞中BMP2的表达水平出现显著上升趋势,表明BMP2可刺激反应性星形胶质细胞的增殖,同时在脊髓细胞的恢复过程中起重要作用。本试验研究结果与上述结论相符。本实验由于时间、成本等问题,对大鼠的研究仅选取治疗后1周这一个时间段,在今后的研究中,应添加多个时间段进行对比研究。
综上所述,黄连素(BBR)对脊髓损伤大鼠具有一定治疗作用,BBR干预后能够显著减少大鼠脊髓细胞的凋亡数量,降低凋亡率,同时,改善大鼠脊髓细胞的病理形态,促进康复,BBR对脊髓损伤大鼠的作用机制可能与下调脊髓细胞中骨形态发生蛋白4(BMP-4)的表达有关。
