LncRNA MAGI2-AS3靶向调控miR-1277-5p对帕金森病细胞模型损伤的影响
2021-12-20姚玉芳张福波杨潮萍
徐 鑫,姚玉芳,张福波,苗 娜,王 男,杨潮萍
(沧州市中心医院 1.中医一科;2.神经内七科;3.神经内四科,河北 沧州 061000)
帕金森病是一种发病率较高的中枢神经系统退行性疾病,其发病机制与遗传、黑质多巴胺神经元退行性病变及氧化应激密切相关,神经细胞氧化应激损伤是引起帕金森病的重要因素之一,1-甲基-4-苯基自由基离子(1-methyl- 4-phenylpy ridinium,MPP+)可引起神经细胞氧化应激损伤及促使细胞凋亡,并可用于建立帕金森病细胞模型的诱导剂[1-2]。长链非编码RNA(LncRNA)是一类长度超过220 nt的RNA分子,其可通过充当miRNA竞争性内源RNA分子而降解靶基因或抑制靶基因表达,进而参与帕金森病的形成过程[3-4]。LncRNA MAGI2-AS3在阿尔茨海默病和β-淀粉样蛋白诱导的神经细胞中表达上调,下调其表达可抑制细胞炎症反应及减轻细胞损伤[5]。但MAGI2-AS3在帕金森病发生发展过程中的作用尚未见报道。生物信息学分析显示MAGI2-AS3与miR-1277-5p存在结合位点,研究表明miR-1277-5p在MPP+诱导的SK-N-SH细胞中表达下调,抑制LncRNA NEAT1表达可通过miR-1277-5p/ARHGAP26轴抑制细胞炎症反应、氧化应激及凋亡[6]。但MAGI2-AS3/miR-1277-5p轴在帕金森病形成过程中的作用机制尚未阐明。因此,本研究从2019年12月至2020年10月期间采用MPP+诱导SK-N-SH细胞建立帕金森病细胞模型,探讨MAGI2-AS3是否可靶向调控miR-1277-5p的表达而参与帕金森病细胞模型损伤过程。
1 材料与方法
1.1 材料与试剂 人神经母细胞瘤细胞SK-N-SH购自美国ATCC;MPP+购自美国Sigma;DMEM购自美国Gibco;Lipofectamine2000、Trizol购自美国Invitrogen;反转录试剂盒、SYBR Green试剂盒购自美国Thermo Fisher;si-NC、si-MAGI2-AS3、miR-NC、miR-1277-5p mimics、anti-miR-NC、anti-miR-1277-5p购自广州锐博生物;LDH、MDA、GSH检测试剂盒购自南京建成生物工程研究所;CCK-8、凋亡检测试剂盒购自北京索莱宝;兔抗人Bcl-2、Bax与二抗购自美国Abcam。
1.2 方法
1.2.1 实验分组 SK-N-SH细胞按照每孔1×104个细胞的密度接种于12孔板,于培养箱内培养12 h后加入0.3 mmol/L的MPP+处理SK-N-SH细胞24 h[7],记为MPP+组。将正常培养的SK-N-SH细胞记为Con组。用Lipofectamine2000试剂将si-NC、si-MAGI2-AS3、miR-NC、miR-1277-5p mimics分别转染至SK-N-SH细胞12 h后加入0.3 mmol/L的MPP+处理细胞24 h,分别记为MPP++si-NC组、MPP++si-MAGI2-AS3组、MPP++miR-NC组、MPP++miR-1277-5p组。用Lipofectamine2000试剂将si-MAGI2-AS3与anti-miR-NC、si-MAGI2-AS3与anti-miR-1277-5p分别共转染至SK-N-SH细胞12 h后加入0.3 mmol/L的MPP+处理细胞24 h,分别记为MPP++si-MAGI2-AS3+anti-miR-NC组、MPP++si-MAGI2-AS3+anti-miR-1277-5p组。
1.2.2 qRT-PCR检测细胞中MAGI2-AS3、miR-1277-5p的表达水平 收集各组SK-N-SH细胞,用Trizol试剂分别提取细胞总RNA,利用反转录试剂盒将RNA反转录合成cDNA,按照SYBR Green试剂盒说明书,分别以GAPDH和U6为内参进行qRT-PCR反应,得到Ct值,用2-ΔΔCt法计算MAGI2-AS3、miR-1277-5p相对表达量。MAGI2-AS3正向引物5’-TGGGTCTGTGCAGAGTTGAG-3’,反向引物5’-AGGGAGTCTAGGCCCCTTCT-3’;miR-1277-5p正向引物5’-TACGTAGATATATATGTATTTT-3’,反向引物5’-TTTTTTCTTTTTTTTCTTCGTT-3’;U6正向引物5’-ATTGGAACGATACAGAGAAGATT-3’,反向引物5’-GGAACGCTTCACGAATTTG-3’;GAPDH正向引物5’-AACGGATTTGGTCGTATTG-3’,反向引物5’-GGAAGATGGTGATGGGATT-3’。
1.2.3 检测氧化应激指标LDH、MDA、GSH的含量 取各组SK-N-SH细胞培养上清液,利用试剂盒检测LDH的含量,用反复冻融法裂解细胞后利用试剂盒检测MDA、GSH的含量,严格按照试剂盒说明书操作。
1.2.4 CCK-8实验检测细胞增殖 各组SK-N-SH细胞消化后(3×103个/mL)接种于96孔板,于培养箱内培养48 h后弃培养基,每孔加入10 μL CCK-8溶液孵育2 h,用美国Biotek公司生产的酶标仪检测每孔在450 nm处的吸光度值并计算细胞存活率[实验组OD值/对照组OD值×100%]。
1.2.5 流式细胞术检测细胞凋亡率 取各组SK-N-SH细胞加入500 μL结合缓冲液重悬细胞,根据凋亡检测试剂盒说明书分别加入5 μL Annexin V-FITC与5 μL PI,室温孵育10 min后用FACS Calibur流式细胞仪检测细胞凋亡率[(早期凋亡细胞+晚期凋亡细胞)/细胞总数×100%]。
1.2.6 双荧光素酶报告基因检测MAGI2-AS3与miR-1277-5p的靶向关系 根据MAGI2-AS3与miR-1277-5p相互作用片段的序列设计野生型载体WT-MAGI2-AS3及缺失MAGI2-AS3结合区域的突变型载体MUT-MAGI2-AS3,WT-MAGI2-AS3、MUT-MAGI2-AS3分别与miR-NC、miR-1277-5p mimics共转染至SK-N-SH细胞,48 h后检测其荧光素酶活性。
1.2.7 Western blot检测Bcl-2、Bax蛋白表达 用RIPA裂解液提取SK-N-SH细胞总蛋白后用超微量分光光度计检测蛋白浓度,将Loading buffer加入蛋白中沸水煮5 min蛋白变性,取40 μg蛋白样品进行SDS-PAGE电泳分离,用电转方式将蛋白凝胶转移至PVDF膜,将PVDF膜放入含有5%脱脂奶粉的封闭液中封闭2 h,以1∶1 000比例稀释一抗后孵育PVDF膜,4 ℃孵育一抗过夜,二抗以1∶3 000的比例稀释后室温孵育PVDF膜1 h,ECL显影,用Image J软件分析各条带灰度值。
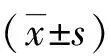
2 结果
2.1 MPP+诱导的SK-N-SH细胞中MAGI2-AS3、miR-1277-5p表达量比较 与Con组比较,MPP+组MAGI2-AS3表达量升高(P<0.05),miR-1277-5p表达量降低(P<0.05,见表1)。

表1 MPP+诱导的SK-N-SH细胞中MAGI2-AS3、miR-1277-5p表达量比较
2.2 干扰MAGI2-AS3表达对MPP+诱导的SK-N-SH细胞氧化应激的影响 与Con组比较,MPP+组LDH、MDA水平升高(P<0.05),GSH水平降低(P<0.05);与MPP++si-NC组比较,MPP++si-MAGI2-AS3组LDH、MDA水平降低(P<0.05),GSH水平升高(P<0.05,见表2)。

表2 干扰MAGI2-AS3表达对MPP+诱导的SK-N-SH细胞氧化应激的影响
2.3 干扰MAGI2-AS3表达对MPP+诱导的SK-N-SH细胞增殖及凋亡的影响 与Con组比较,MPP+组细胞存活率降低(P<0.05),凋亡率和Bax蛋白水平升高(P<0.05),Bcl-2蛋白水平降低(P<0.05);与MPP++si-NC组比较,MPP++si-MAGI2-AS3组细胞存活率升高(P<0.05),凋亡率和Bax蛋白水平降低(P<0.05),Bcl-2蛋白水平升高(P<0.05),见图1、表3。

图1 干扰MAGI2-AS3表达对MPP+诱导的SK-N-SH细胞凋亡的影响

表3 干扰MAGI2-AS3表达对MPP+诱导的SK-N-SH细胞增殖及凋亡的影响
2.4 MAGI2-AS3靶向调控miR-1277-5p MAGI2-AS3与miR-1277-5p存在结合位点,见图2A。转染miR-1277-5p mimics可降低野生型载体WT-MAGI2-AS3的荧光素酶活性(P<0.05),而未能影响MUT-MAGI2-AS3的荧光素酶活性,见图2B。与pcDNA组比较,pcDNA-MAGI2-AS3组miR-1277-5p表达量降低(P<0.05);与si-NC组比较,si-MAGI2-AS3组miR-1277-5p表达量升高(P<0.05),见图2C。

A:LncBase Predicted v.2预测显示MAGI2-AS3与miR-1277-5p存在结合位点;B:双荧光素酶报告基因实验;C:MAGI2-AS3负向调控miR-1277-5p;*:与miR-NC组比较,P<0.05;#:与pcDNA组比较,P<0.05;&:与si-NC组比较,P<0.05。图2 MAGI2-AS3靶向调控miR-1277-5p
2.5 miR-1277-5p过表达对MPP+诱导的SK-N-SH细胞氧化应激、增殖及凋亡的影响 与MPP++miR-NC组比较,MPP++miR-1277-5p组LDH、MDA的水平降低(P<0.05),GSH的水平升高(P<0.05),细胞存活率和Bcl-2蛋白水平升高(P<0.05),凋亡率和Bax蛋白水平降低(P<0.05),见图3、表4。

图3 miR-1277-5p过表达对MPP+诱导的SK-N-SH细胞凋亡的影响

表4 miR-1277-5p过表达对MPP+诱导的SK-N-SH细胞氧化应激、增殖及凋亡的影响
2.6 抑制miR-1277-5p可逆转干扰MAGI2-AS3表达对MPP+诱导的SK-N-SH细胞氧化应激、增殖及凋亡的作用 与MPP++si-MAGI2-AS3+anti-miR-NC组比较,MPP++si-MAGI2-AS3+anti-miR-1277-5p组LDH、MDA的水平升高(P<0.05),GSH的水平降低(P<0.05),细胞存活率和Bcl-2蛋白水平降低(P<0.05),凋亡率和Bax蛋白水平升高(P<0.05),见图4、表5。

图4 抑制miR-1277-5p可逆转干扰MAGI2-AS3表达对MPP+诱导的SK-N-SH细胞凋亡的作用

表5 抑制miR-1277-5p可逆转干扰MAGI2-AS3表达对MPP+诱导的SK-N-SH细胞氧化应激、增殖及凋亡的作用
3 讨论
目前MAGI2-AS3与帕金森病相关报道尚少。本研究结果显示,MPP+诱导的SK-N-SH细胞中MAGI2-AS3的表达量升高。研究表明MAGI2-AS3在胃癌中表达上调,并可促进胃癌细胞增殖及转移[8]。但有研究发现MAGI2-AS3在肝癌细胞中表达下调,上调其表达可抑制细胞增殖及迁移[9]。提示MAGI2-AS3高表达量可能促进帕金森病的发生。氧化应激可诱导细胞凋亡从而造成细胞损伤,本研究结果显示,MPP+诱导的SK-N-SH细胞中LDH、MDA水平升高,GSH水平降低,与既往研究结果相似[10],提示成功建立帕金森病细胞模型。本研究发现干扰MAGI2-AS3表达后MPP+诱导的SK-N-SH细胞中LDH、MDA水平降低,GSH水平升高,提示干扰MAGI2-AS3表达可抑制MPP+诱导的SK-N-SH细胞氧化应激反应。氧化应激可促使神经细胞凋亡,抗凋亡蛋白Bcl-2与促凋亡蛋白Bax的比值降低,可促进细胞凋亡,其比值升高时抑制细胞凋亡[11]。本研究结果显示,MPP+诱导的SK-N-SH细胞存活率降低,凋亡率和Bax蛋白水平升高,Bcl-2蛋白水平降低,而干扰MAGI2-AS3表达后MPP+诱导的SK-N-SH细胞存活率升高,凋亡率和Bax蛋白水平降低,Bcl-2蛋白水平升高,提示干扰MAGI2-AS3表达可促进MPP+诱导的SK-N-SH细胞存活而抑制细胞凋亡。但MAGI2-AS3在帕金森病细胞模型损伤中的作用机制仍需进一步探究。
本研究证实SK-N-SH细胞中MAGI2-AS3可靶向结合miR-1277-5p,并可负向调控miR-1277-5p的表达。研究表明LncRNA XIST通过充当miR-1277-5p的海绵分子而促进骨关节炎软骨细胞外基质降解进而参与骨关节炎的发生过程[12]。miR-1277-5p在帕金森病细胞模型中表达下调,上调其表达可抑制细胞凋亡[13]。本研究结果显示,MPP+诱导的SK-N-SH细胞中miR-1277-5p表达量降低,miR-1277-5p过表达可降低MPP+诱导的SK-N-SH细胞中LDH、MDA水平,而促使GSH水平升高,同时miR-1277-5p过表达后MPP+诱导的SK-N-SH细胞存活率升高,而凋亡率降低,进一步研究发现,抑制miR-1277-5p表达能够拮抗干扰MAGI2-AS3表达对MPP+诱导的SK-N-SH细胞增殖、凋亡及氧化应激的作用。
综上所述,MPP+诱导的SK-N-SH细胞中MAGI2-AS3的表达量升高,而miR-1277-5p的表达量降低,干扰MAGI2-AS3表达可通过上调miR-1277-5p而抑制MPP+诱导的SK-N-SH细胞氧化应激反应、凋亡及促进细胞增殖,MAGI2-AS3/miR-1277-5p轴可参与帕金森病细胞模型损伤过程,并可能作为帕金森病治疗的潜在靶点,还可为进一步揭示帕金森病的发病机制奠定实验基础。但下一步将进行体内动物实验验证MAGI2-AS3在帕金森病形成过程中的可能作用机制。
