广谱抗稻瘟病基因BSR-d1在75份北方粳稻品种中的多态性分布与表达分析
2021-12-20陈晓军马洪文白海波马斯霜李树华
陈晓军,惠 建,马洪文,白海波,马 静,马斯霜,李树华
(1.宁夏农林科学院 农业生物技术研究中心,银川 750002;2.宁夏农林科学院 农作物研究所,银川 750002)
稻瘟病是危害水稻最严重的病害之一,由真菌(Magnaportheoryzae)引起,分布在世界各稻区,可引起水稻大幅度减产,严重时减产40%~50%,甚至颗粒无收[1]。利用分子标记选育抗病品种是防治该病害最有效、最经济的方法。目前至少报道了69个抗稻瘟病位点,共84个主效基因。这些基因成簇地分布于除第3 染色体外的所有水稻染色体上(2个隐性,其他显性),其中,Pid2,Pid3,Pb1,Pia,Pib,Pik,Pik-h/Pi54,Pit,Pik-m,Pik-p,Piz-t,Pish,Pita,Pi1,Pi2,Pi9,Pi5,pi21,Pi36,Pi25,Pi37,Pi63,Pi56,PiCO39等24个基因已被成功克隆(Piz-t、Pi9、Pi2同为Piz位点上的复等位基因;Pik-h/Pi54、Pi1、Pik-m、Pik-p同为Pik位点上的复等位基因;Pia与PiCO39等位;Pid3与Pi25等位)(http://www.ricedata.cn/gene/gene_pi.htm)[2-6]。
Li等[7]在广谱高抗水稻地谷中,发现BSR-d1的启动子变异后对稻瘟病具有广谱水平抗性,它是编码 C 2 H 2 类转录因子的基因。BSR-d1基因的启动子区域一个核苷酸变异(A→G),导致上游 MYB 转录因子对BSR-d1的启动子区域结合能力增强,抑制了BSR-d1诱导表达,并导致BSR-d1直接调控的H2O2降解酶基因表达下调,细胞内大量的H2O2赋予其抗病性,从新的角度提出了水稻抗病性分子机理。该等位基因变异对稻米品质和产量性状没有明显影响,具有十分重要的应用价值。
受环境条件和人为因素影响,传统稻瘟病抗病育种仅通过田间或室内抗性表型鉴定,降低了目标基因的前景选择。分子标记辅助选择是利用与目标基因紧密连锁或基因共分离的分子标记来区分材料的基因型。水稻全生育期,包括种子在内都可以鉴定目标基因, 它不受环境影响, 从而大大提高了育种选择的效率和准确性。然而开发分子标记的前提是对目标基因的变异结构有较为深刻的理解。本研究以75份北方粳稻品种为研究对象,利用PCR扩增测序的方法研究BSR-d1有利等位基因的序列结构变异,并验证其变异对靶基因的调控,为粳稻育种中骨干亲本的选择及抗病基因的聚合等提供理论参考。
1 材料与方法
1.1 试验材料
2×Mixture PCR扩增试剂盒购自北京擎天生物科技有限公司;DNA Marker DL 2000、琼脂糖为北京天根生化科技有限公司产品。
北方区试材料共计75份。材料具体名称见表1。

表1 75份北方粳稻品种名称Table 1 Names of 76 northern japonica rice varieties
1.2 BSR-d1 基因测序引物设计和合成
对稻瘟病抗性基因BSR-d1的克隆结果显示,BSR-d1(LOC_Os03g32230)抗病基因在其启动子 618 位核苷酸碱基为G,而感病基因在该位点核苷酸碱基为A。在水稻基因组数据库 (http://rice.plantbiology.msu.edu/)下载BSR-d1(LOC_Os03g32230)基因的核苷酸序列, 并分析相关序列, 利用Premier 5.0软件在单核苷酸变异区域的前后两侧500 bp,设计包含该变异位点的引物, 预期PCR扩增片段大小387 bp,设计引物序列如下 ,由北京捷瑞生物科技有限责任公司合成。
BSR-RP:gggcgtggttttggtgtggg
BSR-FP:gatacggactcatcgtttcgc
1.3 水稻叶片DNA和RNA提取
在水稻分蘖盛期选取新鲜幼嫩叶片,采用快速简易的方法提取水稻基因组 DNA,具体参考陈晓军等[8]的方法。同时,利用TRZOL法提取对照材料富源4号和钱稻2号相应时期叶片总RNA,备用。
1.4 目标片段PCR 扩增和测序
使用实验室常规 PCR 扩增技术,配制40 μL 反应体系:模板 DNA (约20 ng·μL-1) 2 μL、BSR-FP引物 (10 μmol·L-1) 1 μL、BSR-RP引物 (10 μmol·L-1) 1 μL、2×Mixture 4 μL、添加灭菌双蒸水 32 μL。反应条件为:94 ℃,预变性 5 min;94 ℃,30 s;55 ℃,30 s;72 ℃,45 s;共 35 个循环;72 ℃10 min延伸。反应产物经1% 的琼脂糖(含0.1% Gel Read)凝胶电泳分离, 紫外凝胶成像系统成像检测 PCR 产物是否为单一扩增产物。将单一扩增产物送北京擎科生物科技公司测序,测序引物为BSR-RP (10 μmol·μL-1)。
注:M为DL 2 000 bp DNA marker, 各泳道为样品的PCR扩增产物。图1 北方粳稻品种(部分)BSR-d1启动子区PCR扩增Fig.1 PCR amplification of BSR-d1 promoter region in part of northern japonica rice varieties
1.5 BSR-d1 基因的序列比对
利用DNAMAN version 7.0软件进行序列比对分析。
1.6 BSR-d1 相关基因的表达分析
在预冷的RNase free 的反应管内加入以下试剂至总体积13 μL。试剂组分体积终浓度总 RNA 1 μg,60 μmol·L-1Oligo(dT)181 μL ,DEPC水至总体积13 μL;混匀RNA引物混合物 ,进行短暂离心,65 ℃变性10 min后立即放置冰上。在上述反应管内加入以下试剂至总体积25 μL。5×RT Reaction Buffer 5 μL,25 mmol·L-1dNTP 1 μL ;25 U·μL-1RNase Inhibitor 1 μL;200 U·μL-1M-MLV RTase 1 μL;DEPC水 4 μL。混匀反应,短暂离心后42 ℃孵育1 h,反应结束后85 ℃灭活处理5min,最后-20 ℃保存反转录产物。
采用染料法(SYBR Green I)以水稻泛素基因UBQ为内参基因进行过氧化物酶前体(Os05g04470,Os10g39170)两个基因表达的相对定量分析。实验步骤如下:将2×Universal SYBR qPCR Master在室温下融解,轻轻上下颠倒混匀并进行瞬时离心。 实时PCR 反应体系如下: 2×Universal SYBRqPCR Master 10 μL ;ddH2O 1 μL;PCR Forward Primer(4 μmol·L-1) 2 μL;PCR Reverse Primer(4 μmol·L-1) 2 μL;cDNA 5 μL;总体积 20 μL。实时荧光PCR反应程序为: 95 ℃,预变性 30 s;95 ℃,10 s;60 ℃,10 s;共 40 个循环。
所用引物序列如下:
Os05g04470-Real-F:CCATGGCGCCGTCCGCAACG
Os05g04470-Real-R:CTTGGCGCGGTCGATGACGC
Os10g39170-Real-F:CGACATCCTCGCCTTCGCCG
Os10g39170-Real-R:CCCGGTACAGGCGGCTGCTG
UBQ-F:CAAGATGATCTGCCGCAAATGC
UBQ-R:TTTAACCAGTCCATGAACCCG
2 结果与分析
2.1 BSR-d1 基因扩增
以75份北方粳稻品种的 DNA 为模板, 扩增产物经 1%琼脂糖凝胶电泳分析(图1)。由图 1 可以看出,退火温度为55 ℃扩增的PCR产物条带清晰、单一且没有杂带, 其产物可以用于进一步的DNA测序分析。
2.2 BSR-d1基因测序比对分析
利用DNAMAN 7.0序列分析软件,将75份测序结果进行序列比对分析,序列一致性达91.46%,见图2。75个北方粳稻品种中,在BSR-d1基因启动子-618位不存在A和G的多态性,但花139和花140在其启动子-540位插入了CCCCG 5个碱基,在其启动子上游604位至上游609位ATATAA突变成TATAAG,同时还存在4个SNP位点(C-653T、G-716 A、T-724 A、T-762 C);钱稻2号在启动子上游553位至559位缺失TGGCAAA 7个碱基,详细位置见图2。值得注意的是花139和花140的上游540位插入CCCCG 5个碱基、上游604位至609位ATATAA突变成TATAAG、4个SNP位点(C-653 T、G-716A、T-724 A、T-762 C) 突变类型与Digu的广谱抗稻瘟病基因BSR-d1一致,暗示这两个品种很可能具有相同的亲缘关系,其抗病机理与地谷可能相同。

注:C-653 T,-604-609位ATATAA突变成TATAAG;钱稻2号-553-559位缺失TGGCAAA;花139和花140-540位插入CCCCG。图2 BSR-d1测序部分序列比对分析Fig.2 Comparative analysis of BSR-d1 sequences
2.3 BSR-d1相关基因表达分析
荧光定量PCR的结果表明,在相同生长条件和生育期下,对照材料富源4号与携带BSR-d1基因材料钱稻2号过氧化物酶相关基因Os05g04470和Os10g39170表达略微不同。过氧化物酶两个相关基因在正常条件下,钱稻2号中表达比在富源4号中低。这暗示其过氧化物酶活性在携带BSR-d1基因材料中较低,推测H2O2水平高,使其具有水平抗性,与Li等[7]的研究结果一致。
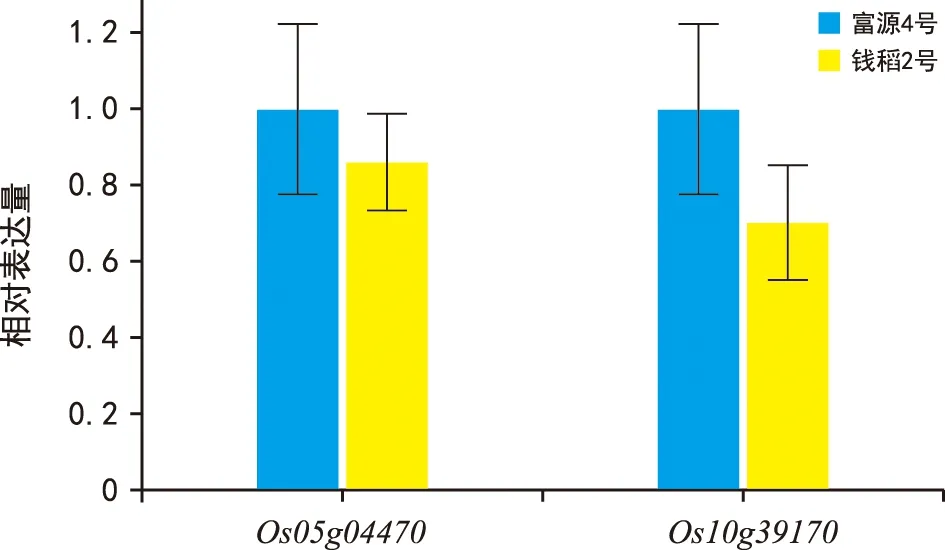
图3 BSR-d1相关基因表达分析Fig.3 Expression analysis of BSR-d1 related genes
3 讨 论
对稻瘟病的防御,水稻中同时存在垂直抗性和水平抗性。垂直抗性是由一类编码NBS-LRR(Nucleotide-binding site-leucine rich repeats)蛋白介导的抗性。在育种应用上,这类主效抗性基因可操作性强、效果明显,开展垂直抗性基因的鉴定及其应用研究较多[9-17]。同样,水稻中还存在着水平抗性,抗性是稳定和持久的,也不会导致品种抗性的丧失。它对病原菌生理小种不形成定向选择压力,不致引起生理小种的变化。王军等[18]对 324 份不同类型江苏省和太湖流域的水稻品种和资源检测发现,271 份粳型资源中均不携带BSR-d1基因,11个籼稻品种和资源中含有BSR-d1基因,说明BSR-d1主要分布在籼型水稻资源中,并指出在粳型资源中几乎不存在,这可能是该基因的功能位点突变发生在籼粳分化以后所致。通过本研究,发现了北方粳稻品种也有该基因的有利等位基因,3种单倍型只占3.95%(3/76)。刘畅媛等[19]在缅甸、老挝79份地方稻种资源中发现抗性基因BSR-d1变异频率为10.13%,品种间存在18个变异位点和22个碱基差异,可划分为6 种单倍型。缅甸老挝水稻资源携带持久抗性基因BSR-d1的品种比例远高于中国品种。这对我国选育稻瘟病持久抗性品种具有重要的利用价值。
本研究在粳稻背景中,发现了这些有利等位基因,有利于BSR-d1基因在北方粳稻育种中发挥更大作用。
