NOXO1 通过调节免疫细胞浸润影响胃癌患者预后
2021-12-20段安乐赵剑芳郭艳周欢王云霞李汭璇段磊
段安乐,赵剑芳,郭艳,周欢,王云霞,李汭璇,段磊
1.甘肃省第三人民医院消化科,甘肃兰州 730000;2.兰州大学第二附属医院神经外科,甘肃兰州 730000
胃癌大多起源于胃黏膜细胞,是第四大最常见的癌症[1]。 约70%~85%的胃癌患者在确诊后5年内死亡,与多数癌症类似,胃癌的高病死率主要是由于确诊时间过晚和治疗方法有限所致[2]。尽管近几十年来,包括免疫疗法,放射疗法和手术切除在内的多模式治疗策略已经取得了很大进展,然而胃癌依然是难以解决的公共卫生问题[3]。自 “精准医学” 概念提出以来,分子病理学检测方法和靶向疗法的改进显着提高了胃癌患者的生存率[4]。 然而由于胃癌分子机制目前尚不明确, 使得胃癌分子病理学和靶向治疗面临诸多困难。 因此,探究更有效的关键分子对于胃癌的治疗至关重要。
烟酰胺腺嘌呤二核苷酸磷酸氧化酶形成体1(NADPH Oxidase Organizer 1, NOXO1) 是NADPH 氧化酶家族的成员之一,该家族是体内氧化还原信号的关键酶[5]。NADPH 氧化酶催化生成的活性氧可促进肿瘤的生成,而肿瘤细胞产生的活性氧促进了肿瘤的发生发展[6]。NADPH 氧化酶家族成员在肺癌、肝癌、黑色素瘤、前列腺癌和食管癌等肿瘤中发挥着重要的作用[7]。关于NOXO1 在胃癌中的作用尚未报道。 因此该研究是应用生物信息学分析,从而探究了NOXO1 在胃癌中的关键作用。 该研究填补了NOXO1 在胃癌中研究的空白,为胃癌分子病理学和靶向治疗的研究提供指导,现报道如下。
1 资料与方法
1.1 一般资料
该研究用于分析NOXO1 的数据来源于TCGA数据库(https://portal.gdc.cancer.gov/),从TCGA 数据库获得胃癌患者的年龄、性别、种族、分析、肿瘤纯度、基因测序数据和临床预后资料。 探究NOXO1 在胃癌中作用的分析均基于TCGA 数据库中所有的胃癌患者数据。 探究NOXO1 在正常人体中表达情况的数据来源于人类蛋白质表达图谱。
1.2 方法
应用GEPIA2 和TIMER 在线工具基于胃癌基因测序数据和临床预后资料探究了NOXO1 在胃癌中的表达情况和预后价值。 为了确定NOXO1 是否为胃癌患者的独立预后因素,在该研究中我们对胃癌常见的临床特征(年龄、性别、种族、分期和肿瘤纯度)进行了单因素Cox 回归和多因素Cox 回归。应用人类蛋白质表达图谱绘制了NOXO1 在人体各个器官中的表达图谱,主要分析了mRNA 和蛋白水平的表达情况。为了确定NOXO1 与胃癌治疗靶点的相关性,该研究不仅探究了NOXO1 与VEGFA 在胃癌中的相关性,而且探究了其在所有肿瘤中是否存在相关性。 在TIMER 数据库对NOXO1 与免疫细胞的相关性进行了探究。 为了更深入探究NOXO1 与免疫细胞的相关性,该研究探究了其与免疫细胞亚型的相关性。
1.3 统计方法
采用Limma 分析用于分析NOXO1 在胃癌与正常组织的表达差异; 应用Kaplan-Meier 生存分析探究NOXO1 在胃癌中的预后价值;单因素Cox 回归和多因素Cox 回归探究包括NOXO1 在内的多种因素对于胃癌预后的影响。 所有相关性分析方法采用Pearson 相关性分析,基于R 语言实现(版本:4.1.0)实现,P<0.05 为差异有统计学意义。
2 结果
2.1 NOXO1 的表达验证
在TIMER 中,NOXO1 与在各种癌肿中的表达结果显示(见图1A),相比于癌旁组织,NOXO1 在BLCA,BRCA,COAD,ESCA,HNSC,KIHC,KIRC,LUAD,LUSC和STAD 等诸多癌症中表达增高。 在GEPIA2 中,NOXO1 在COAD,PAAD 和STAD 中表达增高, 而其在GBM 和TGCT 中的表达降低(见图1B)。 两分析平台结果均显示NOXO1 在胃癌中表达增高,差异有统计学意义(P<0.05)。
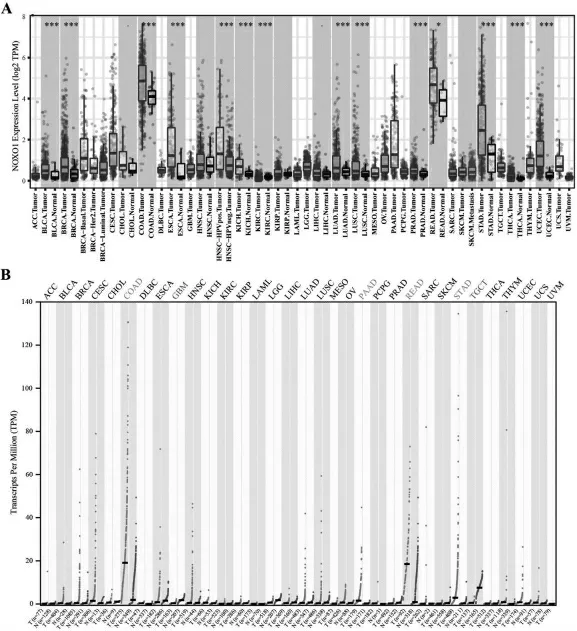
图1 NOXO1 在各种癌症中的差异表达
2.2 NOXO1 与胃癌和其他肿瘤预后的相关性
NOXO1 在不同数据库中与胃癌预后的相关性分析结果显示,NOXO1 的高表达均与胃癌患者预后较好呈正相关(见图2 A, B)。 NOXO1 与所有肿瘤患者预后的热图显示(见图2C),NOXO1 与ACC,CHOL,HNSC 和STAD 等患者的预后密切相关, 差异有统计学意义(P<0.05)。

图2 NOXO1 与在不同数据库与胃癌和其他肿瘤预后的关系
2.3 NOXO1 与临床特征单多变量Cox 回归分析的结果
单变量Cox 回归分析结果显示,年龄(HR=1.020,P=0.009),3 期(HR=2.526, P=0.003),4 期(HR=4.088,P<0.001)和NOXO1(HR=0.834, P=0.001)与胃癌患者的预后关系密切,差异有统计学意义(P<0.05)。 多变量Cox 回归分析的结果也表明,年龄(HR=1.032, P=0.001),3 期(HR=2.753, P=0.005),4 期(HR=3.921, P=0.007)和NOXO1(HR=0.801, P=0.001)与胃癌患者的预后关系密切,差异有统计学意义(P<0.05)。 见表1、表2。
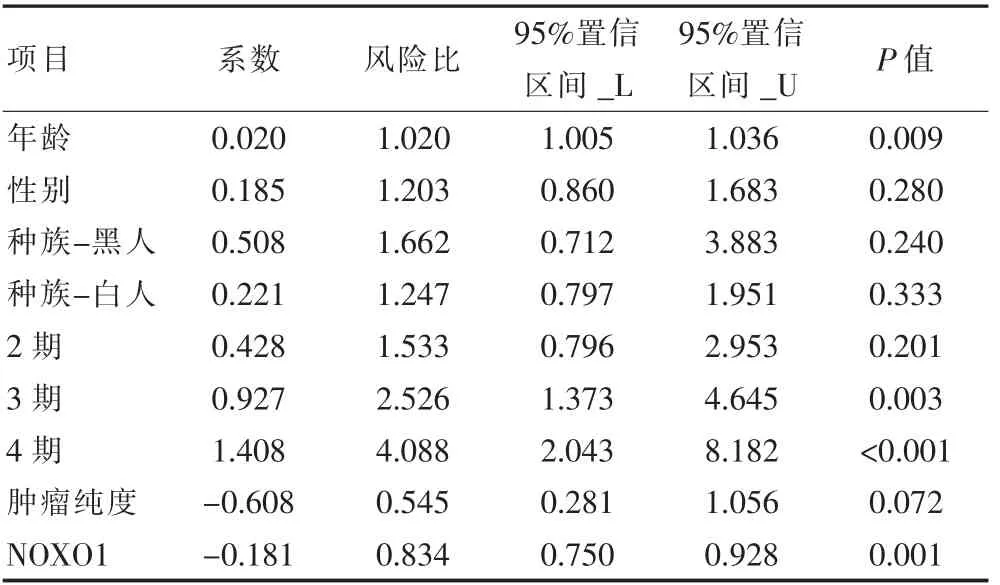
表1 单因素Cox 回归分析结果
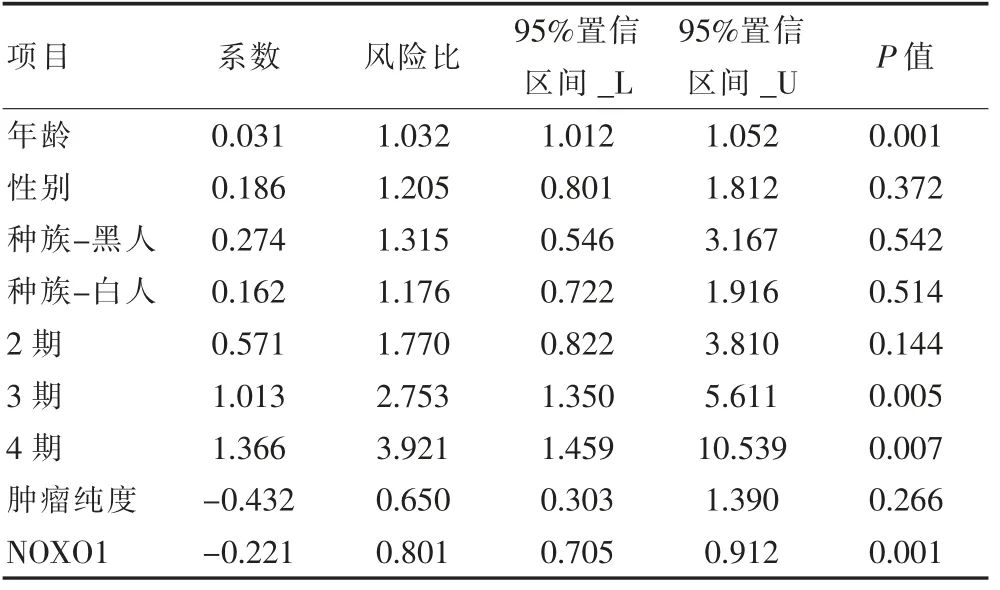
表2 多因素Cox 回归分析结果
2.4 NOXO1 在人体正常器官中的表达情况
NOXO1 在人体组织中表达验证结果显示(见图3), 在人体正常组织中mRNA 层面的表达结果显示,NOXO1 在脑、消化道、男性生殖系统和骨髓淋巴系统等多种器官中表达较高,人体正常组织中蛋白层面的表达结果表明,NOXO1 在消化道和男性生殖系统表达较高,差异有统计学意义(P<0.05)。
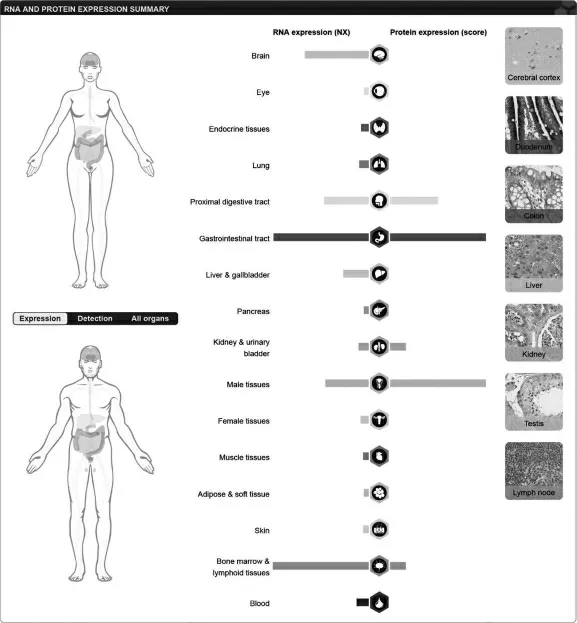
图3 NOXO1 在人体组织中的表达验证
2.5 NOXO1 与VEGFA 的关系
NOXO1 与VEGFA 的相关性分析结果显示:在所有肿瘤中NOXO1 与VEGFA 没有明确的相关性,差异无统计学意义(P>0.05),见图4A。 而在胃癌组织当中,NOXO1 与VEGFA 呈正相关 (r=0.13, P=0.01),见图4B。 NOXO1 在胃癌和其他肿瘤中相关性分布情况见图4C。
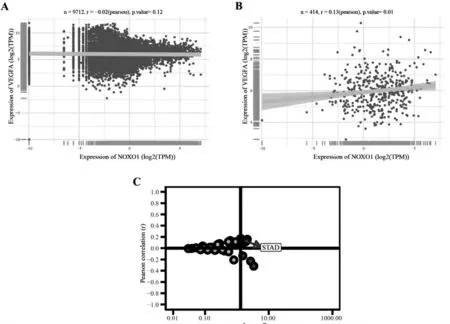
图4 NOXO1 与VEGFA 的相关性
2.6 NOXO1 与免疫的相关性
NOXO1 在胃癌中与肿瘤纯度及免疫细胞的相关性分析结果显示,其与B 细胞(P=0.009),巨噬细胞(P=0.001)关系密切,其中与巨噬细胞最为相关,差异有统计学意义(P<0.05),见图5。 同NOXO1 与巨噬细胞亚型的相关性的结果表明,NOXO1 的表达与巨噬细胞亚型在多数肿瘤中存在相关性,其中在胃癌中,NOXO1 的表达与M0 巨噬细胞和M1 巨噬细胞的浸润呈正相关,而与M2 巨噬细胞的浸润呈负相关,差异有统计学意义(P<0.05),见图6。

图5 NOXO1 与肿瘤纯度及免疫细胞浸润的相关性

图6 NOXO1 与巨噬细胞亚型的相关性及在各大肿瘤中其与VEGFA 的相关性
3 讨论
在正常组织中,NOXO1 可通过促进NOX1 和NOX3 催化氧化还原反应[8]。 NOXO1 可通过促进NOX1的活性和活性氧的生成,从而促进结肠癌的发生[9]。除此之外,NOXO1 可通过促进结肠癌上皮细胞的增殖和抑制凋亡促进结肠癌的增殖和侵袭[10]。 有学者通过动物实验表明,NF-κB 在TNF-α 可直接调控NOXO1促进胃癌细胞的增殖[11]。 NOXO1 也与食管癌的耐药相关[12]。 NOXO1 在多种肿瘤的分子机制中发挥着重要的作用,而关于NOXO1 在胃癌中的具体功能目前尚不清楚。
在该研究中, 我们发现NOXO1 在胃癌中高表达,且为胃癌的独立预后因素,其高表达提示患者预后较好。 NOXO1 在结肠癌中高表达[10],而在胃癌中的表达情况尚不清楚。 NOXO1 与预后的关系是否受表观遗传学的影响,以至NOXO1 的高表达与患者预后较好呈正相关,该研究不能提供可靠的证据。 该研究未涉及蛋白层面的验证,关于具体调控机制,仍需进一步生物实验验证。
VEGFA 的主要功能是促血管扩张和通透性,是多种肿瘤的治疗靶点[13]针对VEGFA 的靶向药物主要有贝伐珠单抗。 VEGFA 主要与胃癌的增殖、侵袭转移和肿瘤血管生成相关, 在实验动物动物体内抑制VEGFA 可以明显抑制肿瘤移植物的生长[14]。 在该研究中,我们发现NOXO1 与VEGFA 的表达呈正相关,其可能与VEGFA 共同作用而在胃癌中发挥作用。 因此对于NOXO1 和VEGFA 具体关系的探究将会为VEGFA 靶向治疗提供指导。
肿瘤微环境因其在肿瘤发生、发展和转移过程中的重要作用而备受关注。 该研究中, 我们通过分析NOXO1 与免疫细胞的关系, 发现NOXO1 与B 细胞和巨噬细胞关系密切。 NOXO1 与巨噬细胞亚型相关性分析结果表明,NOXO1 的表达与M0 巨噬细胞和M1 巨噬细胞的浸润呈正相关, 而与M2 巨噬细胞的浸润呈负相关。相关学者通过免疫组织化和生存分析表明,胃癌中主要浸润的B 细胞是记忆B 细胞和浆细胞,而且CD20+B 细胞与胃癌的生存密切相关[15]。 M2巨噬细胞的高浸润在胃癌中被认为是免疫抑制的特征,可能导致不良的预后[16],趋化因子受体CXCR3 可通过降低M2 巨噬细胞的浸润而与患者预后较好相关[17]。 Wang 等的一项meta 分析表明,M1 巨噬细胞和M0 巨噬细胞的高浸润提示患者预后较差, 而M2 巨噬细胞的浸润提示胃癌患者预后较好[18]。 基于以上研究, 我们大胆推测,NOXO1 虽然在胃癌中高表达,但是与预后较好呈正相关的原因可能与其对M0 巨噬细胞、M1 巨噬细胞和M2 巨噬细胞的调节有关,至于是直接调控还是间接调控,仍需我们进一步证明。 然而目前关于M0 巨噬细胞和M1 巨噬细胞在胃癌中的具体作用目前尚不清楚,对于这方面的进一步研究可深入的了解NOXO1 的免疫调控机制。
综上所述,在该研究中,基于基因测序数据发现NOXO1 可作为胃癌新的治疗靶点。 并发现NOXO1与胃癌治疗靶点VEGFA 呈正相关。 有趣的是,该研究发现NOXO1 可调节B 细胞、M0 巨噬细胞、M1 巨噬细胞和M2 巨噬细胞的浸润,这可能影响胃癌患者恶的预后。这项研究不仅填补了胃癌分子机制研究的空白,而且为胃癌靶向治疗的探究提供新的思路。
