过滤对超速离心法提取外泌体的影响
2021-12-20李传云陈德喜乔跃兵李伟华
李 榕 陈 静 李传云 周 童 陈 欢 陈德喜 乔跃兵* 李伟华*
(1. 承德医学院人体解剖与组织胚胎学教研室,河北承德 067000; 2. 首都医科大学附属北京佑安医院肝病研究所,北京 100069; 3. 首都医科大学附属北京佑安医院外科中心,北京 100069; 4. 中南大学湘雅公共卫生学院,长沙 410078)
外泌体(exosome) 是由细胞分泌的膜性小囊泡,直径30~150 nm[1]。外泌体包含有蛋白质、RNA和DNA等多种成分[2-3],在细胞信号传递、细胞迁移、血管新生、免疫反应和肿瘤细胞生长等方面具有重要的作用[4-7]。由于外泌体是纳米级的颗粒,非常小,目前仍没有特异的分离纯化方法。超速离心法作为外泌体提取的“金标准”是最常用的提取和纯化手段[8]。有研究[9-10]报道在超速离心提取外泌体时,先用0.22 μm滤器过滤,认为这样可以去除标本中的大分子物质,容易获取外泌体。但过滤对外泌体的提取数量有何影响?是否提高了外泌体的纯度?相关报道较少。本实验通过纳米颗粒追踪分析(nanoparticle tracking analysis,NTA)方法和Amnis量化成像流式检测外泌体特异性抗体CD9、CD63的方法,检测过滤前后外泌体的数量及在总颗粒中的百分比,分析经0.22 μm滤膜过滤对超速离心法提取外泌体数量及纯度的影响。
1 材料与方法
1.1 材料
RPMI-1640培养基、胎牛血清(fetal bovine serum, FBS)、0.25%(质量分数)胰蛋白酶(trypsin-EDTA)、5 U/mL 青霉素-链霉素(penicillin-streptomycin solution)和磷酸盐缓冲液(phosphate buffer solution,PBS)均购自美国 Gibco公司;肺癌PC-9/IR细胞 (南京科佰生物科技有限公司);FITC-CD9和PE-CD63抗体购自美国 BD公司;0.22 μm滤器(美国 Millipore公司);Amnis量化成像流式分析仪(法国 Millipore公司);超速离心机和超滤管(美国 Beckman Coulter公司,Optima XPN-100);超敏激光共聚焦显微镜(德国Leica公司,TCS-STED-3X);纳米颗粒跟踪分析仪(德国 Particle Metrix公司,ZetaView);透射电子显微镜(日本Hitachi公司,Hitachi-7650);纳米流式检测仪(厦门福流生物科技有限公司,NanoFCM)。
1.2 方法
1.2.1 血浆标本留取
收集2020年10月至12月首都医科大学附属北京佑安医院健康查体样本6例,每例样本留取全血10 mL。本研究经过首都医科大学附属北京佑安医院伦理委员会批准,批准文号:京佑科伦理[2021]034号。所有志愿者均签署知情同意书。
1.2.2 PC-9/IR细胞培养
PC-9/IR细胞是人肺癌细胞,易培养,可分泌大量外泌体,因此本实验选用此细胞上清的外泌体作为研究对象。含1%(质量分数)青霉素-链霉素和10%(体积分数)FBS的RPMI-1640培养基于37 ℃、5%(体积分数)CO2培养箱中培养PC-9/IR细胞,0.25%(质量分数)胰蛋白酶消化传代。
1.2.3 血浆外泌体的提取
取全血10 mL,300g离心10 min,去除细胞;取上清,1 000g离心10 min,去除死细胞;取上清,4 ℃ 2 000g离心30 min,去除细胞碎片;取上清, 4 ℃ 10 000g离心30 min,去除凋亡小体等较大的囊泡;取上清,置于SW32Ti贝克曼超速离心管中,加入适量PBS,4 ℃ 110 000g离心70 min;重复上一步;弃上清,外泌体(沉淀)重悬于400 μL PBS中备用。
1.2.4 培养上清外泌体的提取
PC-9/IR细胞培养上清外泌体提取方法同血浆外泌体的提取方法。
1.2.5 外泌体过滤
收集好的外泌体,平均分为2组,过滤组(fitration group, GL)使用0.22 μm 滤器将外泌体过滤后进行NTA和Amnis量化成像流式检测,未过滤组(unfiltration group,NC)直接进行NTA和Amnis量化成像流式检测。
1.2.6 纳米颗粒追踪分析(nanoparticle tracking analysis,NTA)
用PBS调节外泌体至1×107粒/mL~1×109粒/mL,纳米颗粒跟踪分析仪采用激光照射外泌体悬浮液,并对外泌体颗粒的散射光进行检测,通过统计散射颗粒的数量来计算纳米颗粒浓度。同时,追踪纳米颗粒布朗运动的轨迹,计算出单位时间纳米颗粒的均方位移(mean squared displacement,MSD),并根据结果得出纳米颗粒粒径分布图。
1.2.7 外泌体抗体染色
将过滤后的外泌体平均分配到2个1.5 mL的EP管中,标记为GL-CD9组和GL-CD63组;未过滤的外泌体平均分配到2个1.5 mL EP管中,标记为NC-CD9 组和NC-CD63组。在两组标记CD9和CD63的管中,分别加入10 μL FITC-CD9、 PE-CD63抗体。置于冰上,避光染色40 min。然后将其分别转移至超离管中,加入PBS,4 ℃ 110 000g离心70 min,洗掉未结合的抗体。使用100 μL PBS重悬沉淀并转至1.5 mL EP管中,避光,备用,实验设计及技术流程见图1。
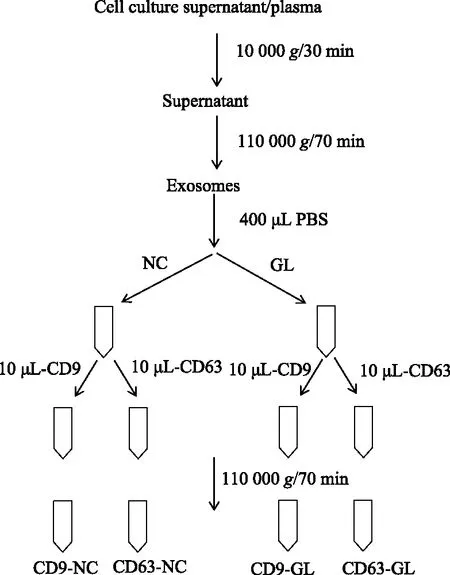
图1 技术流程图Fig.1 Experimental technology programePBS: phosphate buffer solution; NC: unfiltration group; GL: filtration group.
1.2.8 Aminis量化成像流式分析
采用ImageStreamX软件收集100 000个粒子。在量化成像流式分析系统上获取数据,使用IDEAS®软件统计分析CD9+Exo和CD63+Exo的数量及CD9+Exo和CD63+Exo在总粒子中的百分比。
1.3 统计学方法
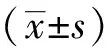
2 结果
2.1 外泌体的鉴定
透射电镜观察到外泌体的形态和结构(图2),超敏激光共聚焦显微镜观察到外泌体特异性标志物CD9-AF647标记的外泌体(图3),纳米流式检测外泌体的平均粒径为62 nm左右(图4)。

图2 外泌体电镜图片Fig.2 Exosomes picture of electron microscope(Scale bar=200 μm)

图3 外泌体超敏激光共聚焦显微镜图片(CD9-AF647)Fig.3 Exosomes picture of ultra-sensitive confocal laser microscope(CD9-AF647)
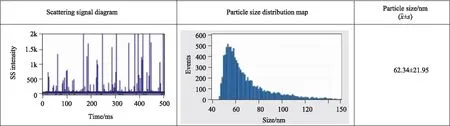
图4 纳米流式检测外泌体Fig.4 Nanometer flow cytometer detection of exosomes
2.2 纳米颗粒跟踪分析检测过滤组与未过滤组外泌体粒径及数量的变化
NTA结果显示,超速离心法提取纳米粒径主峰值集中在67~77 nm(表1,图5A~D),与外泌体体积(30~150 nm)大小相符。过滤前、后血浆外泌体粒径分别为83.31 nm和80.74 nm,培养上清外泌体粒径分别为94.11 nm和88.62 nm。2组外泌体粒径过滤前、后差异无统计学意义(P>0.05)。血浆外泌体未过滤组数量为9.44×1010个/mL,过滤组为2.01×1010个/mL,相差约4.7倍(图5E)。培养上清外泌体未过滤组数量为12.21×1010个/mL,过滤组为4.82×1010个/mL,相差约2.5倍(图5F)。血浆及培养上清过滤组外泌体数量明显下降,与未过滤组比较差异有统计学意义(P<0.01)。过滤对血浆外泌体的减少大于培养上清。
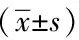
表1 NTA检测血浆和培养上清中过滤组与未过滤组纳米颗粒的粒径及数量
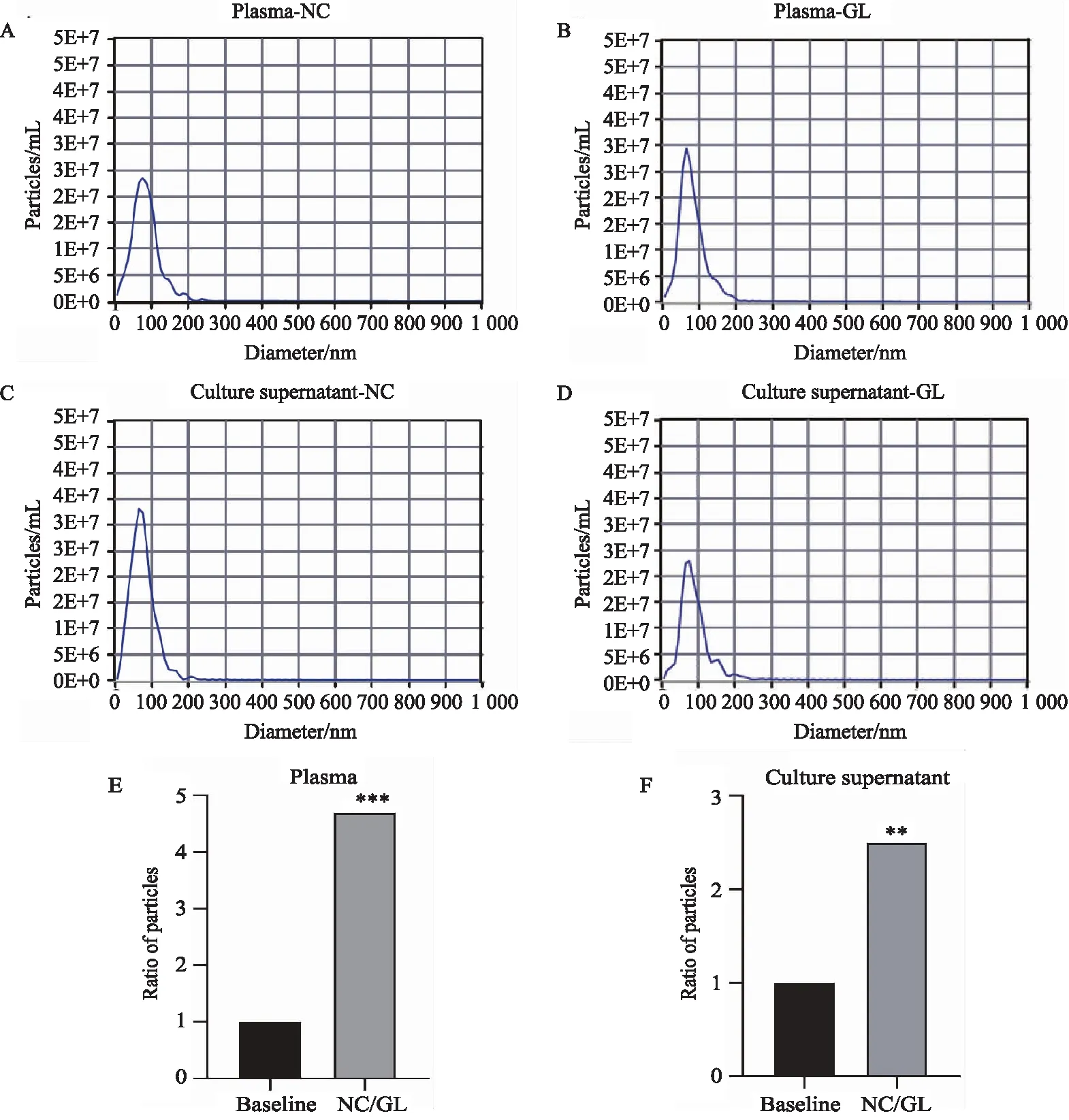
图5 NTA检测过滤前后外泌体数量变化倍数Fig.5 Fold changes of exosomes before and after filtration by NTA detectedA: Exosome size distribution in plasma unfiltered group; B: Exosome size distribution in plasma filtration group; C: Exosome particle size distribution of culture supernatant unfiltered group; D: Exosome particle size distribution of culture supernatant filtration group; E: The ratio of the number of exosomes between the unfiltered group and the filtered group of plasma samples; F: The ratio of the number of exosomes in the culture supernatant between the unfiltration group and the filtration group. **P<0.01, ***P<0.001 vs Baseline; NC: unfiltration group; GL: filtration group; NTA: nanoparticle tracking analysis.
2.3 Amnis量化成像流式检测过滤组与未过滤组外泌体数量及纯度的变化
CD9和CD63是外泌体特异性标志,用FITC-CD9和PE-CD63单抗对外泌体进行标记, Amnis量化成像流式进行检测,IDEAS®软件统计CD9+Exo和CD63+Exo的数量及CD9+Exo和CD63+Exo在总粒子中的百分比(图6)。
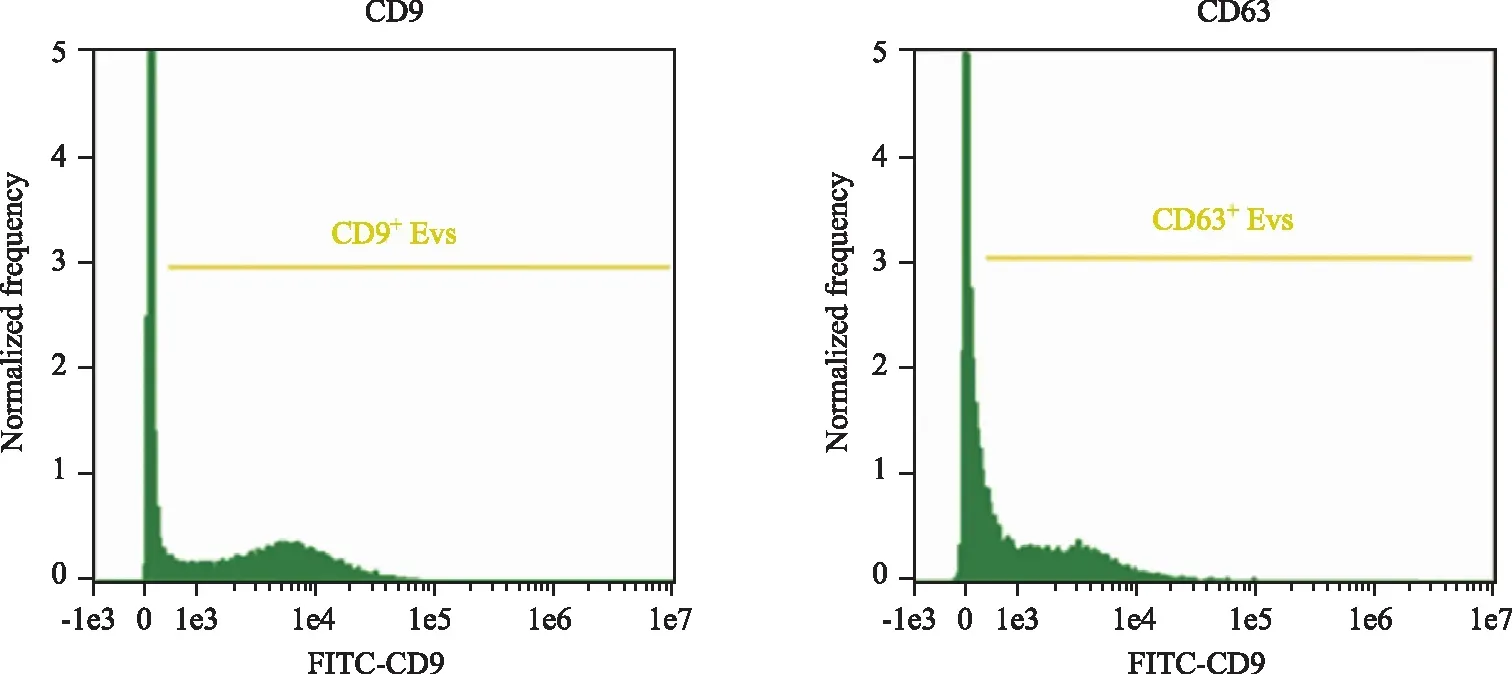
图6 Amnis量化成像流式检测CD9+和CD63+外泌体Fig.6 CD9+ and CD63+ exosomes determined by Amnis flow cytometry
Amnis量化成像流式结果显示,血浆未过滤组CD9+Exo、CD63+Exo和总粒子的数量分别为(8.15±2.13)×106/mL、(3.62±0.71)×106/mL和(32.09±5.80)×106/mL,过滤组为(1.63±0.86)×106/mL、(1.39±0.44)×106/mL和(14.01±2.06)×106/mL,分别下降了5倍、2.6倍和2.3倍。培养上清未过滤组中CD9+Exo、CD63+Exo总粒子的数量分别为(3.23±0.70)×106/mL、(31.33±6.28)×106/mL和(121.10±22.70)×106/mL,过滤组为(1.01±0.21)×106/mL、(13.88±3.00)×106/mL和(60.60±10.86)×106/mL,分别下降了3倍、2.3倍和2倍,详见表2。各过滤组与未过滤组相比差异均统计学意义(P<0.05) (图7A、7B) 。以上数据显示,过滤可以明显降低外泌体提取的数量。
表2 Amnis量化成像检测CD9+Exo和CD63+Exo的数量及百分比
血浆中未过滤组与过滤组CD9+Exo分别占总粒子数的21.23%和8.49%,CD63+Exo分别占总粒子数的14.77%和10.63%。培养上清中未过滤组与过滤组CD9+Exo分别占总粒子数的20.77%和7.99%,CD63+Exo分别占总粒子数的13.36%和13.07%。以上各过滤组与未过滤组相比除CD9+Exo明显下降外(P<0.05),CD63+Exo和总粒子组差异无统计学意义(P>0.05) (图7C、7D)。以上数据显示,过滤后,CD9+Exo和CD63+Exo在粒子中的百分比(外泌体的纯度)并没有提高反而有所下降。
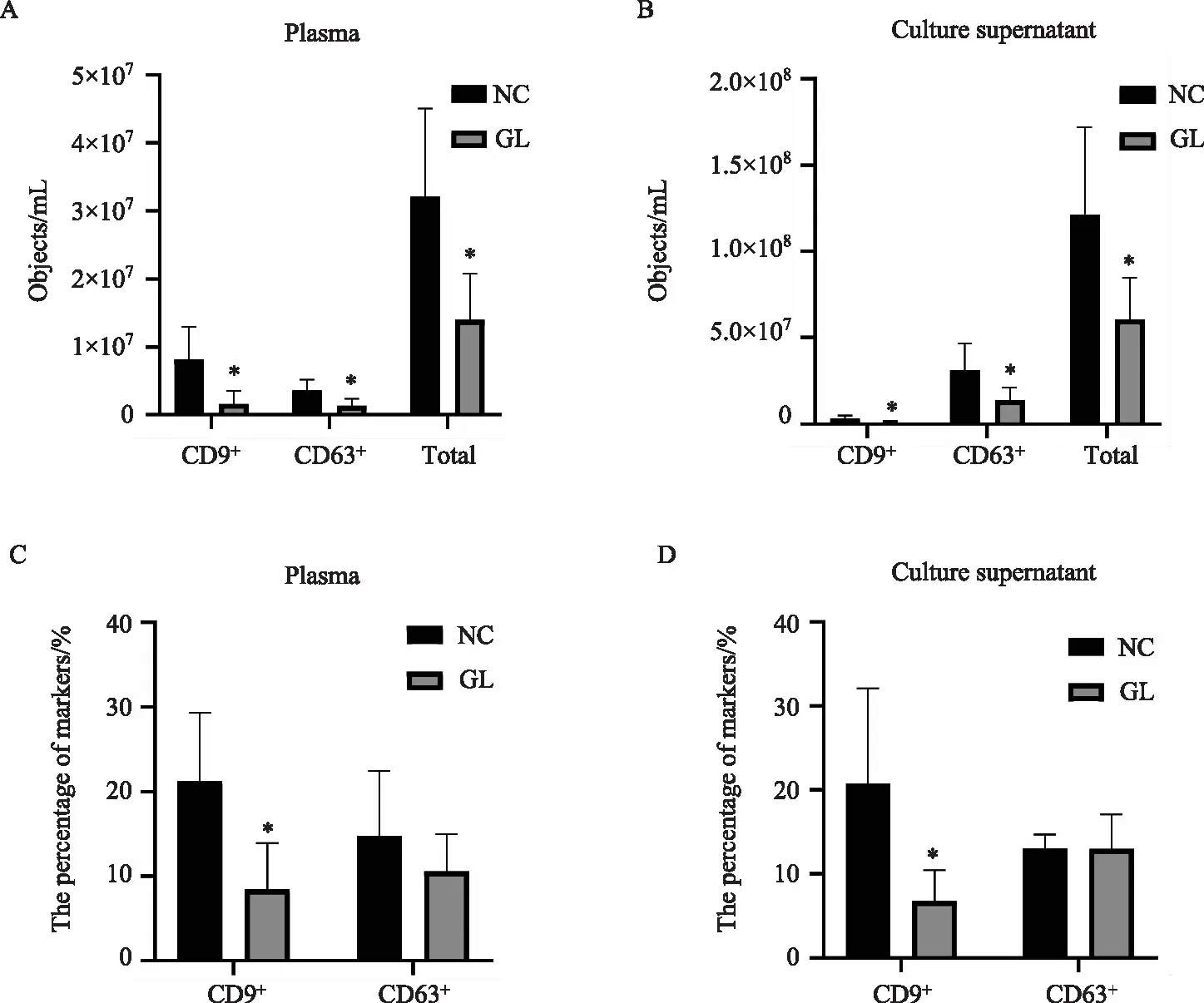
图7 过滤对外泌体数量及纯度的影响Fig.7 Effects of filtration on the quantity and purity of exosomes A: The number of CD9+ Exo, CD63+ Exo and total particles between plasma filtration group and unfiltration group; B: The number of CD9+ Exo, CD63+ Exo and total particles between the filtered group and the unfiltered group; C: The percentage of CD9+ Exo, CD63+ Exo in total particles between plasma filtration group and unfiltration group; D: The percentage of CD9+ Exo, CD63+ Exo in the total particles between the filtered group and the unfiltered group. *P<0.05 vs NC group; NC: unfiltration group; GL: filtration group.
3 讨论
外泌体已成为医学和生命科学领域研究的热点,获得高纯度的外泌体对后续研究至关重要。超速离心法是目前外泌体最常用和有效的提取方法[11],由于外泌体体积极小,其提取的纯度和生物活性很容易受到离心力、离心时间等外界因素的影响[12],因而寻找与其相适应的提取方法是开展外泌体研究的前提。
外泌体体积约30~150 nm,理论上使用0.22 μm滤膜过滤对其数量不会产生明显影响。本实验数据显示,使用0.22 μm过滤膜过滤后明显降低了外泌体纳米提取的数量,过滤组与未过滤组相比,外泌体数量下降了2~5倍。分析原因可能有以下2点:第一,外泌体在血浆和培养上清中可能黏附体积较大的大分子(如蛋白质或细胞碎片),这些大分子在过滤过程中被清除,黏附在上面的外泌体也被清除。第二,文献[13]报道,每毫升血浆中大概有109个外泌体,浓度非常大,在如此大浓度下,外泌体有可能彼此之间黏附聚集成团,这些团块在过滤时被清除,因而降低了外泌体的数量。另外,本实验数据显示,过滤使血浆比培养上清中外泌体下降更多,这一结果从另一方面验证了第二点推测的可能性。
为了明确过滤是否提高了外泌体的纯度,笔者使用外泌体特异性抗体CD9和CD63对外泌体进行标记,使用Amnis量化成像流式[14-15]对标记的抗体进行检测。Amnis量化成像流式MKII的激光功率高,灵敏度高,利用 Amnis 可以检测到直径 20 nm 微珠的荧光信号[16],并可以拍摄到直径为 100 nm 的微珠的图像。 因此,Amnis 量化成像流式的灵敏度和图像分辨率可以检测直径范围在 30~100 nm 的外泌体。结果显示,过滤组CD9+Exo、CD63+Exo以及总颗粒都有明显下降,与NTA结果一致。进一步分析CD9+Exo和CD63+Exo在颗粒中的百分比并没有提高,也就是说过滤并没有提高外泌体的纯度。其原因可能是使用0.22 μm滤器处理样本后,外泌体聚集的团块被过滤,CD9+Exo和CD63+Exo数量下降。CD9+Exo和CD63+Exo百分比也随之下降,因此过滤并未提高外泌体的纯度。
不管是基础实验研究还是临床疾病诊断,获取足够数量、高纯度的外泌体是研究其功能、内容物及作用机制的一个重要前提。虽然过滤会减少外泌体的获取数量,但由于超速离心法在反复离心的过程中会导致外泌体污染,0.22 μm过滤膜可以去除细菌。如提取外泌体后,后继实验需要无菌操作(如用外泌体与细胞共培养等),过滤仍是最好的选择。因此,在外泌体提取过程中,可以根据实验需求决定过滤和不过滤。
