重症患者急性期能量平衡对住院期间死亡的影响
2021-12-20周营利秦君平黄惠斌
高 明 周营利 朱 研 秦君平 黄惠斌 任 昱 谈 莉 周 华 许 媛
(清华大学附属北京清华长庚医院重症医学科 清华大学临床医学院,北京 102218)
危重症患者的代谢状态在不同阶段有着显著的差别。急性期,应激因素导致糖原酵解、糖异生加强、肌肉与脂肪的降解,合成机体所需50%~70%的葡萄糖,即“自噬代谢”。饥饿与持续低喂养可加重患者自噬代谢,导致肌肉蛋白的迅速降解以及器官功能受损;过度喂养又可抑制自噬,使细胞内受损的细胞器及病原体清除能力减弱,应激状态下机体对营养物质的利用与合成均与自噬代谢相关的线粒体功能障碍有关[1-2]。有研究[3]显示能量供给与危重症病死率呈现U型曲线,过度喂养以及持续低喂养均与不良预后相关,2019年ESPEN营养指南(以下简称指南)[4]推荐急性期早期应避免过度喂养,能量供给不超过目标量的70%~80%。因此,通过间接测热法(indirect calorimetry, IC)评估能量消耗(energy expenditure, EE),进行个体化的营养补充策略显得尤为重要。本研究分析重症加强护理病房(intensive care unit, ICU)住院时间≥7 d的患者在ICU期间的营养治疗现况,并观察其对患者住院病死率等临床结局的影响。
1 对象与方法
1.1 研究对象
将2019年4月至2021年4月清华大学附属北京清华长庚医院ICU收治的住ICU≥7 d,且前3 d、后4 d 至少各进行一次实际EE测量的61例重症患者作为研究对象,其中男性46例、女性15例;平均年龄(68.5±18.1)岁,按患者住院期间是否死亡分为死亡组(18例)以及生存组(43例)。排除标准:年龄<18岁;ICU住院时间<7 d;临床资料不全者。本研究符合医学伦理学标准,并通过本院伦理委员会审批(审批号:16124-0110),患者或家属均签署知情同意书。
1.2 资料收集
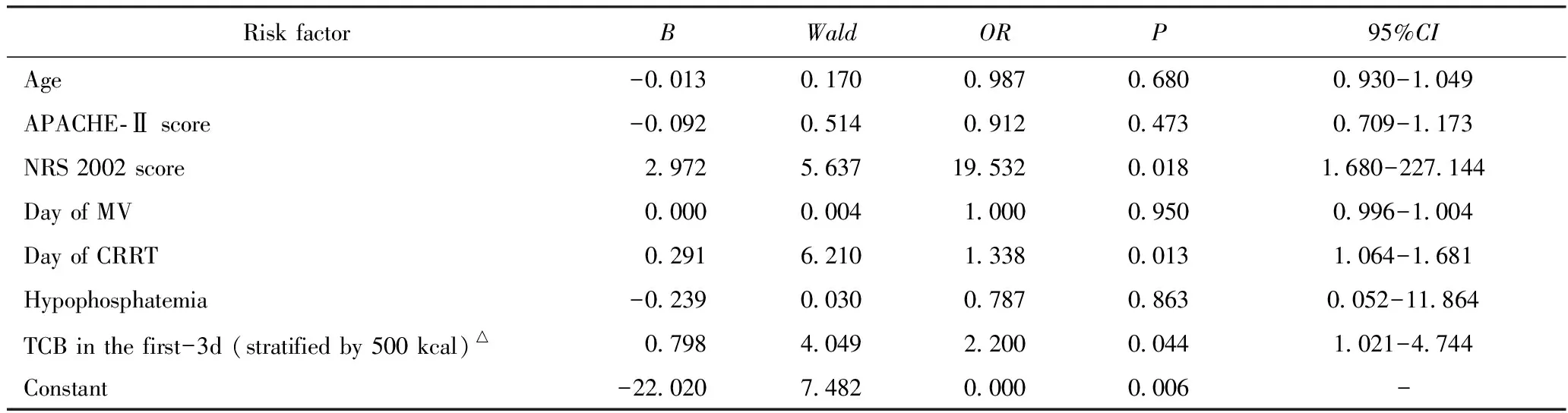
记录患者姓名、年龄、性别、入ICU时间、急性生理与慢性健康(Acute Physiology and Chronic Health Evaluation-Ⅱ,APACHE-Ⅱ)评分、营养风险筛查(Nutritional Risk Screening, NRS) 2002评分、住院期间是否死亡、机械通气时间、连续性肾脏替代治疗(continuous renal replacement therapy,CRRT)时间、ICU住院期间是否出现低磷血症、C反应蛋白(C reactive protein,CRP)浓度、前白蛋白浓度。此外,记录患者每日实际能量供给、蛋白供给、IC法监测的实际能量消耗(EEIC)以及呼吸熵等情况,并计算ICU住院前3 d以及ICU住院后4 d累计能量平衡情况。能量平衡定义为每日实际能量供给与EEIC之间的差值。能量平衡为正值提示实际能量供给>EEIC,能量平衡为负值提示实际能量供给 采用意大利COSMED公司QUARK PFT ERGO代谢车(S/N 2019091309),通过IC法定期监测EE以及呼吸熵(respiratoryquotient,RQ)。营养支持途径可为全肠内营养、全肠外营养或肠内联合肠外营养。 与生存组相比,死亡组患者年龄更大、疾病严重程度更重、营养风险更高、应用CRRT比例更高,接受CRRT治疗时间与机械通气时间以及ICU住院时间更长,组间比较差异有统计学意义(P<0.05),详见表1。 表1 生存组和死亡组患者一般资料比较Tab.1 Comparison of clinical baseline data between the survival and nonsurvival groups[n(%), M(P25, P75)] 在营养治疗方面,两组患者营养支持途径差异无统计学意义。死亡组患者ICU住院前3 d累计能量平衡明显高于生存组,组间比较差异有统计学意义(P<0.05),此外,死亡组低磷血症的发生率更高(P=0.030)。两组ICU住院后4 d累计能量平衡、每日蛋白质供给量、呼吸熵组间比较差异均无统计学意义(P>0.05),详见表2。 表2 生存组和死亡组患者营养相关指标的比较Tab.2 Comparison of nutrition-related indicators between survival and nonsurvival groups[n(%), M(P25,P75)] 以患者是否发生院内死亡为因变量,单因素分析中差异有统计学意义的指标为自变量进行多因素Logistic回归。结果显示,NRS 2002评分、ICU住院前3 d累计能量平衡、CRRT时间是患者住院期间死亡的危险因素(P<0.05),其中NRS 2002评分的关系最为密切(OR=19.53),详见表3。 表3 重症患者院内死亡的多因素Logistic回归分析 将纳入的61名患者按NRS 2002评分分为高营养风险组(NRS 2002≥5)和低营养风险组(NRS 2002<5)。其中,高营养风险组患者共30例,死亡患者16例,而低营养风险组患者31例,死亡2例。高风险组和低风险组,ICU住院前3 d IC法监测所得的EE均低于指南推荐的25 kcal·kg-1·d-1的能量供给[高风险组:(1 335.2±397.6) kcalvs(1 546.3±387.9) kcal,P=0.042;低风险组:(1 510.5±386.7) kcalvs(1 726.4±319.4) kcal,P=0.020)] (1 kcal=4.186 kJ),差异均有统计学意义。高营养风险组中,死亡患者前3 d累计能量平衡明显高于生存患者[(230.2±1 041.0) kcalvs(-944.7±1 099.0) kcal,P=0.006],多因素Logistic回归后ICU住院前3 d累计能量平衡(OR:1.919,95%CI: 1.112~3.312,P=0.019)、CRRT时间(OR:1.236,95%CI: 1.008~1.516,P=0.042)是高营养风险组患者死亡的独立预测因素。而在低营养风险组中,死亡患者与生存患者各项指标差异无明显统计学意义。 疾病与代谢状态基础上合理的能量与营养供给是影响ICU重症患者营养治疗效果与安全性的重要因素,因为不同的疾病状态、不同的个体,能量代谢以及营养需求并不相同[5-6]。本研究回顾性分析了ICU住院时间 7 d以上的重症患者其监测能量消耗与实际能量供给之间的差别,旨在分析重症患者急性期早期(1~3 d)累计能量平衡与预后的相关关系,进一步找寻其与指南[4]推荐供给之间的差异,为急性早期的合理的能量供给提供依据。结果显示:急性期早期累计能量正平衡与死亡风险增加明显相关,在高营养风险重症人群中更为明显,急性早期实际能量消耗量约为指南推荐量(25 kcal·kg-1·d-1)的88%。 在危重症急性早期阶段的氧化应激反应、炎症因子释放、线粒体功能损伤、ATP耗竭会进一步加重细胞代谢紊乱[7]。此时,细胞会启动自噬机制,通过清除炎症因子和受损线粒体起到保护内皮细胞、改善微循环以及减轻组织器官损伤的作用。由此可见,细胞自噬对维持危重症患者细胞生命活动和器官功能十分重要。新近有研究[8]显示,过度喂养以及高糖血症均可抑制机体的自噬过程,进而导致不良预后。因此,有研究[9]指出急性期早期阶段(ICU住院前3 d)最适宜的能量供给在61%~70%左右。本研究发现在死亡的患者中,除了年龄、疾病严重程度、需要机械通气以及CRRT等器官功能支持以外,其ICU住院前3 d累计能量供给处于“正平衡”状态,多因素分析后,ICU住院前3 d累计能量平衡仍是预测患者院内死亡的主要危险因素,而且累计能量平衡每增加500 kcal,患者的院内死亡风险就会增加120%。由此可见,在危重症的早期阶段,营养过度可能比营养不足对患者的危害更大。此外,营养供给超负荷的原因可能与能量需求评估不准确相关[10-11],虽然有许多能量预测或估算公式,但临床最常用的仍然是国际指南推荐的25 kcal·kg-1·d-1。有研究[12]指出,在急性期早期,与允许性低热卡相比,指南[4]推荐的25 kcal·kg-1·d-1的能量供给并不能改善患者预后,因此动态监测患者的实际能量消耗并根据临床情况调整治疗方案才能使患者获益。本研究发现,在急性危重症早期,25 kcal·kg-1·d-1的预测值仍与实测EE之间存在很大差距,本研究显示EEIC约为指南推荐量(25 kcal·kg-1·d-1)的88%。这也再次证实,对于病情危重、高营养风险的患者应用代谢车来评估能量消耗会更为准确可靠。 此外,在整个人群的多因素Logistic回归分析后发现,入ICU时患者的营养风险(NRS 2002评分)也是影响患者预后的主要的危险因素(OR值19.532,95%CI:1.680~227.144)。因此,将NRS 2002评分≥5的这部分高营养风险的人群进行单独分析发现,ICU住院前3 d累计能量正平衡仍是预测这部分患者预后的有效因素,但对于低营养风险的患者,不管是ICU住院前3 d还是后4 d的能量平衡对其预后均无预测价值。该结果提示,对于有营养高风险的患者,早期营养治疗过程中更应该警惕过度喂养对患者造成的不利影响。 蛋白供给对患者预后影响的研究结果不一,多数研究[13-14]以及指南[4]推荐的蛋白质供给量约为1.2~1.5 g·kg-1·d-1。蛋白质摄入不足固然会影响患者预后,但在危重症的早期阶段,分解代谢明显增强可能会削弱蛋白供给的优势,对患者产生不利影响[15]。新近有研究[16]显示,蛋白供给与患者预后存在着时间相关性,早期蛋白供给小于0.8 g·kg-1·d-1(前1~2 d),后逐渐上升至大于1.2 g·kg-1·d-1的这部分患者预后最佳。本研究早期实际蛋白质供给在ICU住院前3 d为0.8~0.9 g·kg-1·d-1,后4 d仅略有增加达到0.9~1.0 g·kg-1·d-1,蛋白质供给与住院期间病死率无明显相关性,其解释可能为:①后一阶段虽然低于推荐目标的1.2 g·kg-1·d-1,但并非是低蛋白供给(<0.5 g·kg-1·d-1);②样本量小且观察时间较短,不能反映出影响。后续还需大样本前瞻性深入分析与探讨。 最后,本研究仍存在一定的局限性。首先,研究仅分析了入ICU 7 d内营养供给情况对预后的影响,对于入ICU一周以后的营养供给以及能量监测并未涉及,希望在以后的研究中可涉及到慢重症阶段营养供给对患者预后的影响。其次,本研究为单中心、回顾性、观察性研究,虽然纳入2年内符合要求的所有患者,但样本数仍然较少,也反映了实际能量代谢监测并未受到应有的重视与规范。但这一回顾性分析结果为本课题组今后将开展前瞻大样本随机对照研究提出了建设性思考,也为进一步探讨及明确能量代谢与供给对危重症患者预后的影响奠定了基础。 综上所述,本研究显示,ICU住院前3 d累计能量平衡、NRS 2002评分以及CRRT时间是影响ICU患者预后的独立危险因素,特别是对高营养风险的患者,积极监测EE水平、调整营养治疗方案、避免过度喂养对于改善患者预后有重要意义。1.3 营养评估
1.4 统计学方法
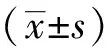
2 结果
2.1 两组患者的基本特征比较
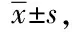
2.2 营养相关指标的比较
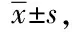
2.3 重症患者院内死亡的多因素分析
2.4 营养风险对预后的影响
3 讨论
