儿童盆腔及泌尿生殖道横纹肌肉瘤的诊断及治疗(附12例分析)
2021-12-18焦瑒瑒蒋莎义黄灿杨静薇廖雪莲
焦瑒瑒,蒋莎义,黄灿,杨静薇,廖雪莲
上海市儿童医院上海交通大学附属儿童医院血液肿瘤科,上海200062
横纹肌肉瘤(Rhabdomyosarcoma,RMS)是一种高度恶性肿瘤,起源于多能间充质细胞,是儿童最常见的软组织肉瘤类型,约占儿童所有软组织肉瘤的50%~60%[1-4],占儿童所有恶性肿瘤的3%~5%[5-6]。RMS可发生于任何部位[1-3],其中泌尿生殖道是最常见的部位,且盆腔、膀胱、前列腺、会阴部及肛周等部位的RMS预后不良[7],疾病早期不易发现,且手术可能会造成主要器官损害。2015年1月—2019年12月,上海市儿童医院收治盆腔及泌尿生殖道RMS患儿12例,现对其临床资料作回顾性分析,以总结儿童盆腔及泌尿生殖道RMS的有效诊断及治疗方法。
1 资料分析
1.1 临床资料 2015年1月—2019年12月上海市儿童医院血液肿瘤科诊治的原发瘤灶位于盆腔及泌尿生殖道的RMS患儿12例,男6例、女6例,原发部位位于阴道2例、附睾1例、肛门1例、膀胱3例、盆腔5例,肿瘤直径≥5 cm者9例、<5 cm者3例,区域淋巴结转移者2例。12例RMS患儿中,临床表现为局部包块者7例、排尿困难者2例、腹痛者2例、便血者1例。详见表1。
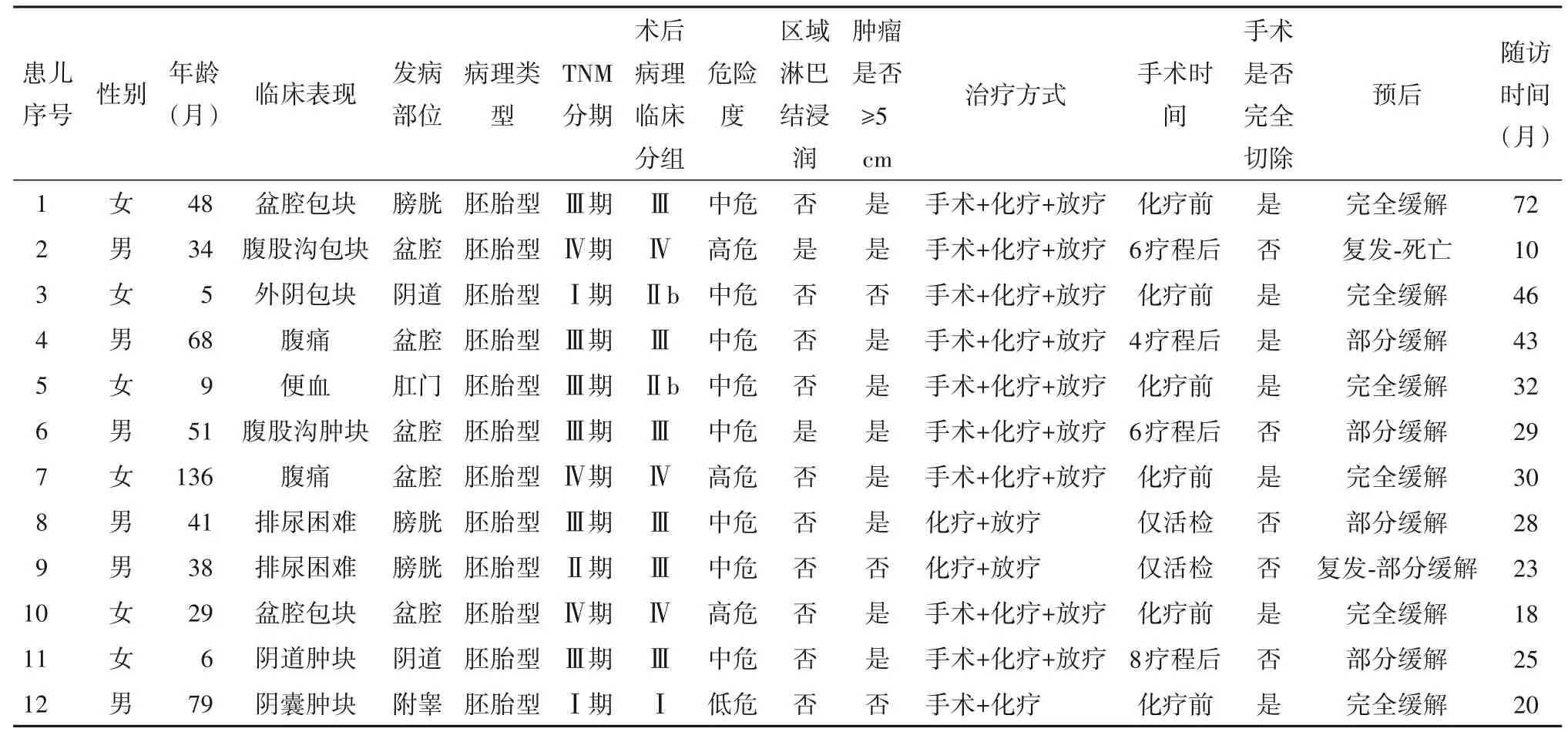
表1 12例RMS患儿的临床资料
1.2 诊断及分期、分组 所有患儿治疗前均行完整的影像学检查评估原发瘤灶及常见转移部位,检查项目包括原发瘤灶的增强MRI或增强CT、头颅MRI、胸部CT、PET/CT、骨髓检查及骨扫描。实验室检查项目包括血常规、尿常规、便常规、血生化、电解质、心电图、心脏彩超及听力监测等,部分病理标本采用荧光素原位杂交(FISH)技术,检测PAXFOX01A基因易位情况[7-9]。本研究中12例患儿均行手术活检或手术切除肿瘤病理检查确诊,病理类型均为胚胎型。2例患儿采用FISH技术检测PAXFOX01A基因异位情况,结果均为阴性。12例患儿中,TNM分期Ⅰ期2例、Ⅱ期1例、Ⅲ期6例、Ⅳ期3例。12例患儿中,术后病理分组系统(IRS)Ⅰ组1例、Ⅱ组2例、Ⅲ组6例、Ⅳ组3例,其中1例为远处骨转移,2例为腹膜种植。12例患儿中,临床危险度分组低危组1例、中危组8例、高危组3例。
1.3 治疗及预后 6例患儿直接手术切除病灶,术后规律化疗及放疗,其中1例因临床危险度分组为低危组未行放疗,随访至2020年12月31日,6例均为完全缓解(CR)。4例患儿病初各种原因无法手术切除,先行化疗,4~8疗程后再行手术切除病灶,后规律化疗及放疗,随访至2020年12月31日,3例部分缓解(PR),1例因复发最终死于原发病。2例病灶位于膀胱部位的患儿仅行活检术,后规律化疗及放疗,随访至2020年12月31日,1例为PR,1例治疗过程中出现复发继续治疗后达PR。12例患儿平均生存时间(66.8±4.9)个月,2年总生存率为91.7%±8.0%,无事件生存时间(61.8±6.6)月,2年无事件生存率为83.3%±10.8%。
2 讨论
RMS是儿童期颅外实体肿瘤中仅次于神经母细胞瘤和肾母细胞瘤的恶性肿瘤[10],发病率6/1 000 000,发病年龄高峰为2~6岁和10~18岁,多发生于盆腔及头颈部,也可发生于无骨骼肌细胞的部位[2-3],确诊后5年总OS超过70%[10-12]。RMS病理类型包括胚胎型、腺泡型和多形性[13],胚胎型是最常见的病理亚型,占75%[1,4,10],多见于小年龄儿童患者,其特征是11p15染色体上的“杂合性缺失”。胚胎型多发生于头颈部及泌尿生殖道[10],多数生殖道RMS病理类型为胚胎型,其中多数为葡萄状[14]。腺泡型是第二常见的病理亚型,多见于大年龄儿童及青少年[3,10],多见于四肢、躯干[1],PAX3或PAX7-FOXO1融合基因易位可见于80%的腺泡型RMS患者,该基因是2号染色体和13号染色体异位形成,且与预后差相关,FOXO1融合基因阴性的腺泡型RMS和胚胎型预后相似[2,15],多形性多见于成人[1,3]。本研究中盆腔及泌尿生殖道RMS患儿均为胚胎型,染色体核型检测未见异常,无腺泡型。胚胎型多见符合既往的研究,但无腺泡型可能与病例总数少有关系。
RMS临床表现多样,取决于肿瘤部位及是否转移[4],通常表现为无痛性肿块[15],通过体格检查诊断困难,可因肿块生长及对临近组织影响产生的症状及体征而就诊[10],泌尿生殖道可分为膀胱/前列腺和非膀胱前列腺位置,常见的表现包括血尿、尿路梗阻表现、阴道黏液分泌、肿块排出、便秘、单侧腹股沟/阴囊肿块[4]。本研究12例患儿中以局部包块起病7例、尿路梗阻表现起病者2例、腹痛2例、便血1例,与相关报道相符合。
影像学检查对于评估原发肿瘤大小、局部和远处扩散、长期患者的随访及早期发现复发至关重要[4],PET/CT检查在儿童RMS中越来越重要[15]。本研究中,所有患儿均进行了影像学检查,包括原发部位的增强MRI或增强CT,部分完善PET/CT。横纹肌肉瘤无特异性血清标志物,最近发现血清循环肌特异性microRNA miR206是诊断、治疗评估、预后预测的特异性标志物[16]。
多数RMS患者需综合治疗才能达到最佳效果,基于两种分期、完整组织病理报告的精确危险度分组是确定治疗方案的基础,评估疾病可切除的完成性,也要把区域淋巴结和转移淋巴结考虑在内[10]。综合治疗归类为以化疗为主的全身治疗和由手术和放疗构成的局部治疗。RMS对化疗敏感,常用化疗药物为异环磷酰胺、长春新碱、放线菌素等,主要目的是全身范围内杀灭肿瘤细胞,消除转移病灶,缩小原发肿瘤,为手术完整切除创造条件。局部治疗是RMS综合治疗的重要部分,关于局部治疗的时机,欧洲对多数RMS患者的治疗方法是评估3个周期诱导化疗的反应,根据情况在第13周开始局部治疗,包括原发肿瘤的延迟手术和/或根治性放疗[10]。对于部分患者,如果化疗能使手术或放射治疗更容易,那么放疗可能会在13周后;但对于转移性疾病的局部治疗不同,建议6周后评估化疗反应,局部治疗在22周左右开始进行[2]。放射治疗作为改善治疗结果的重要因素之一,同时会导致严重并发症,越来越多的新型治疗包括质子、近距离放射治疗和旋转强度调制放射治疗,可减少并发症的发生。手术是治疗RMS的关键,手术切除的目标是在尽量不损伤功能的前提下完全切除肿瘤和保证正常组织的切缘,手术无法切除时行活检。盆腔和泌尿生殖道肿瘤的原发灶位置限制了切除范围和手术完全切除的可行性,膀胱和阴道肿瘤选择内镜活检[1,10],膀胱前列腺部位的RMS目前越来越倾向于不积极手术治疗以保护脏器功能。对于未切除的病变,在所有计划治疗结束时可能存在残留,通常由分化良好的横纹肌细胞组成,不需要手术切除。睾丸、精索及腹股沟内环的病变应行根治性睾丸切除术切除精索,原发部位在外阴、阴道、子宫的患者先行活检术[10],避免行根治性手术,化疗和根治性放疗在这些患者中可取得好的疗效[1]。对于不能手术切除的小年龄儿童(<36个月),根治性的放疗仍是可选择的,腹水或腹膜种植的患者需全腹放疗,对于不能手术切除的肛门和会阴肿瘤,放疗也是必要的。本研究12例患儿中,3例原发于膀胱者,其中2例行膀胱镜活检,并化疗、放疗,因手术损伤大未行手术;2例原发于阴道者,1例化疗前完全切除,1例因手术损伤大,于化疗8疗程后行手术切除,定期阴道镜检查评估;原发于肛门和附睾者,均化疗前行手术切除;5例原发于盆腔者,均行根治性手术切除及放疗、化疗等综合治疗。
RMS远处转移率达14%~28%,肺、骨、骨髓、淋巴结是最常见的转移部位[4,9]。复发通常在确诊后前3年,75%的患儿为原位复发,复发后预后差,与转移性复发、既往接受放疗、诊断至复发的时间小于18月、病灶位置、诊断时淋巴结转移、病理类型为腺泡型、多药化疗等相关。本研究中,3例出现远处转移,1例远处转移部位为骨,于治疗10疗程后原位复发,最终死于原发病,2例为腹膜种植。
综上所述,盆腔及泌尿生殖道是儿童RMS常见的发病部位,主要表现为局部包块,增强MRI或增强CT等影像学检查可用于评估原发瘤灶及转移部位,活检或术后病理检查确诊,病理类型多为胚胎型;RMS患儿的治疗需手术、化疗、放疗等多学科联合诊治。本研究病例数量偏少,仍需进一步收集病例数并继续随访。
