免疫层析技术在检测食品中硝基呋喃类药物的应用
2021-12-17刘秀英汤立军李学鹏励建荣
夏 菲,刘秀英,高 雪,汤立军,李学鹏,励建荣
(渤海大学食品科学与工程学院 辽宁省食品安全重点实验室生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心 辽宁锦州121013)
硝基呋喃类药物属于人工合成的广谱抗生素,价格低廉、抗菌效果好,被广泛的应用于医疗和兽医行业,用于治疗胃肠道感染和预防病变源性微生物感染[1]。由于硝基呋喃类药物具有致突变性和致癌性[2-4],因此,目前包括中国在内的许多国家已禁止将硝基呋喃类药物用于动物性食品的生产中,然而,这类药物的非法使用事件仍有发生。开发高效的检测方法用于监测食品中硝基呋喃类药物的残留,对保障消费者健康及生命安全具有重要意义。
硝基呋喃类药物的检测方法多种多样,最为常用的方法是仪器分析法,如液相色谱质谱法[5]、液相色谱-串联质谱法[6-7]、超高效液相色谱串联质谱法[8-10]、四极串联质谱法[11]等。这些方法虽然准确性和灵敏度高,但是仪器价格昂贵,需要专业的技术人员操作,不适用于现场检测。以酶作为生物标记物,利用抗体和抗原间的特异性为基础的酶联免疫分析法(Enzyme-linked immunosorbent assay,ELISA)也是检测硝基呋喃类药物的一种重要手段,其具有高通量筛选能力、检测速度快等优点,被广泛地应用于食品中硝基呋喃类药物残留的检测[12-13],然而存在检测稳定性不理想,易出现假阳性结果等问题[14-15],这些不足限制了其发展。目前迫切需要一种快速、简便、低成本、高效率的现场检测方法用于硝基呋喃类药物残留的大规模筛查。
免疫层析技术(Immunochromatography assay,ICA)的出现在很大程度上促进了硝基呋喃类药物残留现场快速检测技术的发展。该技术不仅操作过程简单、检测迅速,还具有灵敏度和稳定性高、特异性强、成本低等优点。近年来,免疫层析技术成为研究热点,被广泛地应用于硝基呋喃类药物母体及其代谢物的测定。本文综述免疫层析技术的基本原理与优点,重点介绍利用不同的信号标记物构建的免疫层析技术在食品中硝基呋喃类药物残留的快速检测,并展望未来的发展趋势。
1 硝基呋喃类药物及其代谢衍生物
硝基呋喃类药物是以五元呋喃环为基础骨架,在环的五位上都连有一个硝基而得到的一类化合物。该类药物为黄色粉末状晶体,几乎不溶于水,在N,N-二甲基甲酰胺(DMF)中溶解性极高,味微苦或无味。目前应用最广泛的硝基呋喃类药物主要包括呋喃唑酮(Furazolidone,FZD)、呋喃它酮(Furaltadone,FTD)、呋喃妥因(Nitrofurantoin,NFT)和呋喃西林(Nitrofurazone,NFZ)。然而,硝基呋喃类母体药物在体内代谢迅速,半衰期短,高度不稳定[16-17]。动物摄入体内后快速将母体药物分解为代谢衍生物[18],有研究表明单一测量硝基呋喃类母体药物残留情况并不准确[19]。3-氨基-2-恶唑烷酮(3-Amino-2-oxazolidone,AOZ)、3-氨基-5-吗啉甲基-2-恶唑烷酮(3-Amino-5-morp-holino-methyl-1,3-oxazolidinone,AMOZ)、1-氨基乙内酰脲(1-Aminohydantoin,AHD)和氨基脲(Semicarbazide,SEM)分别是呋喃唑酮、呋喃它酮、呋喃妥英和呋喃西林的代谢物。这些代谢物及其母体结构式见图一。硝基呋喃类代谢物的稳定性高,与动物体内肌肉组织中的蛋白结合形成的代谢结合物长达数月之久,因此,检测硝基呋喃类母体药物的代谢衍生物是监测硝基呋喃类药物残留情况的一种重要手段[20-21]。
2 免疫层析技术
2.1 免疫层析技术的检测原理
免疫层析技术是一种将色谱法与免疫学反应相结合的快速检测技术。基于该技术开发的试纸条通常由样品垫、共轭垫、硝化纤维素膜和吸收垫4 个部分组成,这些部分被依次层压于一片塑料衬垫上[22-23]。图2 为免疫层析试纸条的组成与结构示意图。通常情况下,免疫层析试纸条以固定有检测线(包被抗体或抗原)和质控线(抗抗体或A 蛋白)的硝化纤维素膜为固定相,以样品溶液为流动相,通过毛细管作用使待测物在试纸条上移动。在试纸条构建过程中,利用不同的信号标记物标记抗体(抗原),并将其固定于共轭垫作为检测信号的来源。对于具有多个抗原位点的大型分析物的检测,通常使用“三明治”形式的双抗夹层免疫层析分析技术,即首先将标记抗体固定于共轭垫,当含有目标分析物的样品溶液加入样品垫中时,目标分析物在共轭垫与标记抗体形成复合物,并迁移到吸收垫中。在迁移过程中,上述复合物中的目标分析物与检测线上的检测抗体发生免疫反应,形成夹层。而检测线上过量的游离复合物则被质控线上其相应的抗体所捕获,形成可视化的质控线。若检测线和质控线都显现,检测结果为阳性;若样品溶液中不存在目标分析物,标记抗体上行至质控线,检测线不显现,检测结果为阴性。对于具有较低分子质量和单一抗原决定因子的小分析物的检测,如硝基呋喃类母体药物及其代谢物等,由于不能同时与两种抗体相结合,大多采用竞争性的免疫层析技术,其检测形式又通常分为两种。其一,目标分析物被信号材料标记并附着在共轭垫上,对于阴性样品,标记的目标分析物会穿过条带,依次结合检测线和质控线上相应的抗体,检测线和质控线都会显现。对于阳性样品,样品中未标记的分析物与标记的分析物发生竞争,未标记的分析物结合在检测线上,标记分析物与质控线上抗体结合。此时只会有质控线显现。其二,当使用信号标记物标记的抗体固定于共轭垫,其检测线和质控线分别固定有包被抗原和能与标记抗体反应的抗体时,若样品溶液中不存在目标分析物,则检测线和质控线都会显现。若样品溶液中存在目标分析物,目标分析物与检测线上固定的包被抗原竞争结合有限的标记抗体,检测线的显现程度与样品溶液中目标分析物的含量成反比[24-27]。
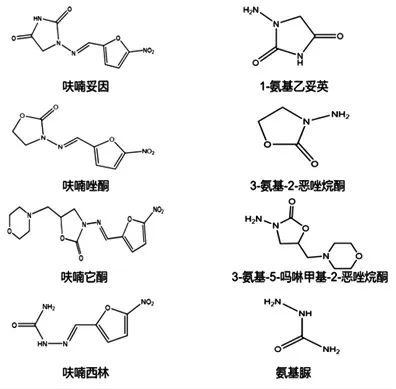
图1 4 种硝基呋喃类母体化合物及其代谢物的化学结构Fig.1 The chemical structures of four nitrofuran parent compounds and their metabolites

图2 免疫层析试纸条的组成与结构示意图Fig.2 Schematic diagram of composition and structure of immunochromatographic strip
2.2 免疫层析技术的优点
近年来,免疫层析技术因具有诸多优点而在食品中硝基呋喃类药物的检测方面成为研究热点。首先,该技术不需要昂贵的仪器设备,检测成本较低,适用于现场检测;其次,该技术不需要繁琐的样品前处理过程,整个检测过程可在几分钟内完成,操作简单,检测速度快[28-29]。第三,该技术可以将标记材料与多种硝基呋喃类药物抗体结合,最终在试纸条上同时产生相应的检测信号,说明该技术可对硝基呋喃类药物进行多残留分析,进而实现高通量筛查[30]。最后,该技术不仅可以在基于抗原抗体的免疫反应下确保检测的特异性,而且还可以通过选择各种新型免疫标记物,放大抗原抗体之间的反应结果,提高检测的灵敏度[31-32]。
3 免疫层析技术在食品中硝基呋喃药物残留检测中的应用
在免疫层析分析技术中,标记材料的选择至关重要。标记材料的性能和信号强度决定了检测结果的读取模式及灵敏度。目前,用于分析食品中硝基呋喃类药物的免疫层析技术所用标记材料主要包括荧光材料、胶体金、磁珠等。本文重点围绕这几种类型展开综述。
3.1 荧光物质标记的免疫层析技术
3.1.1 量子点标记的免疫层析技术 量子点(Quantum dots,QDs),又称无机半导体晶体,是一类由元素周期表中II-VI 或III-V 族元素组成的荧光纳米颗粒。与传统的荧光团相比,量子点具有荧光发射光谱窄、量子产率高、稳定性和生物相容性好、抗光漂白性强和荧光寿命长等优点[33-36],因此成为了免疫层析技术中一种理想的荧光标记物质。利用QDs 构建免疫层析技术检测硝基呋喃类药物的相关报道较多,所用QDs 主要包括CdSe和CdTe 两种类型。
2017年,Le 等[37]利用表面羧基功能化的CdSe/ZnS QDs 作为荧光信号,通过1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐/N-羟基琥珀酰亚胺【1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide/N-Hydroxy succinimide,EDC/NHS】与抗1-氨基乙内酰脲-4 硝苯基肟(1-Aminohydantoin-4-nitrophenyl oxime,NPAHD)抗体结合,建立了一种一步荧光免疫层析法。该方法无需对硝基呋喃类药物进行衍生化处理,可应用于鱼、蟹、虾动物组织中AHD 的快速检测。线性检测范围为0.1~100 ng/mL,NPAHD 的目测检测限为3 ng/mL,实际动物组织中的检测限(Limit of detection,LOD)为0.14 ng/g。作者还通过液相色谱串联质谱法(Liquid chromatography-tandem mass spectrometry,LC-MS/MS)证实了该方法的可靠性。2017年,Sun 等[38]合成了发射波长为605 nm 的CdTe/CdSe 核/壳纳米结构QDs,通过EDC 活化酯法将QDs 与NPAHD 抗体偶联,构建了一种检测鲶鱼、鲤鱼和虾中AHD 的荧光连接免疫吸附法。线性范围为0.1~3.0 ng/mL,LOD 为0.06 mg/kg。
2019年,Xie 等[39]采用表面羧基功能化的CdSe/ZnS QDs 荧光标记材料建立一种可快速检测肌肉及肝脏组织中AMOZ 的荧光免疫层析试纸法,并将该方法应用于鸡、猪、鲶鱼、鲟鱼、虾和鲤鱼等实际样品中。免疫条带的目视检测限为10 ng/mL,线性范围为1~30 ng/mL,定量限为0.45 ng/mL,检测时间为10 min。样品中AMOZ 的回收率在78.6%~108.9%之间,变异系数(Coefficient of variation,CV)在12%以下,说明该试纸对于动物组织中AMOZ 残留有较好的检测能力。
3.1.2 镧系螯合物标记的免疫层析技术 镧系螯合物是指一类以稀土离子与高吸光系数配体结合形成的一种能发出高强度特征荧光的螯合物[40]。这类化合物的斯托克斯(Stoke)位移大,一般在200 nm 以上,可以避免激发光的干扰以及荧光自猝灭的发生,进而提高测定结果的灵敏度。此外,镧系螯合物的荧光寿命(100~1 000 μs)和背景荧光寿命(1~10 ns)相差很大,能有效降低本底信号的干扰[41-42]。不同镧系荧光螯合物的发射波长不同,利用镧系螯合物标记的免疫层析技术可实现对多种目标分析物的同时检测[43]。最近几年,以稀土离子及其螯合物作为荧光标记物的免疫分析法技术在食品中硝基呋喃类药物残留检测中的应用也有报道,其中应用最多的为铕(Eu)。
2018年,赵义良等[44]采用粒径为190 nm,表面羧基功能化的铕荧光微球(Eu 螯合物键合到聚苯乙烯微球表面)作为抗体标记物,通过EDC 有机偶联剂将铕荧光微球与AOZ 单克隆抗体结合,开发出一种快速检测鱼、虾等可食用肌肉组织中AOZ 的试剂卡。该试剂卡可在5 min 内完成检测,LOD 为0.5 μg/kg,与AMOZ、SEM、AHD 的交叉反应率低于1%,LC-MS/MS 的检测结果与该试剂卡的结果完全一致,说明该试剂卡检测快速,准确性和灵敏度高。
2019年,Dong 等[45]为了避免抗体在Fab 区域潜在的结构变化,提高检测灵敏度,选择掺杂聚苯乙烯并经羧酸盐改性的Eu(III)螯合物纳米颗粒,采用羊抗鼠免疫球蛋白次级抗体作为连接Eu(III)螯合物纳米颗粒和AHD、AOZ、AMOZ、SEM4 种抗体的中间物质,建立了一种可同时检测草鱼中4 种硝基呋喃类药物的多重铕(Eu)纳米颗粒免疫层析方法。该试纸条对AHD、AOZ、AMOZ、SEM 的LOD 分别为0.05,0.1,0.1,0.2 ng/g,检测时间为10 min。该方法与商业ELISA 试剂盒的检测结果具有良好的线性关系,说明该方法可用于草鱼中多种硝基呋喃类药物代谢物的检测。
3.2 胶体金标记的免疫层析技术
胶体金是金盐被还原成金单质后形成的稳定、均匀、呈单一分散状态并悬浮在液体中的金颗粒悬浮液。胶体金合成方法简单,有肉眼可见的显著红色,确保现场检测的方便性;而且信号在产生过程中无需繁琐的孵育、洗涤、酶促反应等繁琐操作过程,能明显缩短检测时间。此外,胶体金颗粒提供的纳米级表面能充分加速抗体抗原反应,为免疫检测提供放大信号[46-48]。目前,以胶体金为标记物的免疫层析技术报道最多。
2017年Ding 等[49]制备了一种针对3-[(4-硝基苯基)-亚甲基]-氨基]-2-恶唑烷酮【3-[(4-Nitrophenyl)methylene]amino]-2 -oxazolidinone,NPAOZ】的超灵敏特异性单克隆抗体(5G12),其半抑制浓度(Half-inhibitory concentration,IC50)为0.2 ng/mL,CV 极低。将胶体金标记于5G12 抗体作为检测探针,建立快速检测鲶鱼中AOZ 的免疫层析法。该方法实际加标样品的回收率为86.2%~118.5%,CV 为4.3%~9.4%,制备的5G12抗体具有良好的重复性。实际样品中的目测检测限与磷酸缓冲盐溶液(Phosphate buffer saline,PBS)中的结果一致,检测时间为10 min。说明该方法可作为检测鲶鱼样品中AOZ 的一种快速现场筛选工具。
2017年,Xie 等[50]利用胶体金作为抗体标记物,以3-[(4-羧基苯基)-亚甲基]-氨基]-2-恶唑烷酮【3-[(4-Carboxyphenyl)monomethyl]amino-2-oxazolidinone,CPAOZ】 包被抗原作为检测线,羊抗鼠免疫球蛋白作为质控线,构建免疫层析试纸条,用于检测鸡肉、猪肉、鲤鱼和虾中AOZ。该试纸条的目测检测限为10 μg/L。当用试纸条阅读器读数时,实际动物组织样品中的LOD 和定量限(Limit of quantitation,LOQ)分别达0.15 μg/kg和0.31 μg/kg。此外,作者还通过LC-MS/MS 证实该方法在实际动物中的适用性。
2018年,Dou 等[51]研制出检测奶粉、虾、鸡、鱼、猪肉中AOZ 的新型信号增强免疫层析试纸,利用金纳米粒子分别偶联抗CPAOZ 抗体(一抗)和羊抗鼠免疫球蛋白(二抗)形成两种探针,并固定于共轭垫的不同位置,当有目标溶液流过时,一抗和二抗通过特异性识别自组装形成一种能聚集大量金纳米颗粒的网络结构复合物,最终在检测线实现信号放大的作用,该方法通过降低抗体用量提高方法的灵敏度。该法对PBS 中CPAOZ 的LOD 和LOQ 分别为0.13 ng/mL 和0.42 ng/mL,其灵敏度比传统的金免疫层析提高5 倍;实际样品中AOZ 的灵敏度为0.44 ng/mL,回收率为87%~120%,证实该方法在真实样品中的实用性。
3.3 磁珠标记的免疫层析技术
磁珠标记物主要由磁性元素(如Fe,Ni,Co)及其氧化物组成。通常情况下,研究人员主要借助磁珠标记物的磁性开发样品前处理技术,在外加磁铁的作用下,可快速将复合体系中被磁珠标记的物质分离出来。然而,磁珠标记物自身具有较强的颜色属性,若将其应用于免疫层析技术中,磁珠标记物的聚集可在试纸条上呈现一条可视化条带[52-53]。近年来,有研究者将磁珠标记物的显色属性引入免疫层析技术中。

图3 基于信号增强型金纳米颗粒的免疫层析示意图[51]Fig.3 Schematic diagram of immunochromatography based on signal-enhanced gold nanoparticles[51]
2016年,Lu 等[54]建立了可单一或同时检测多种硝基呋喃类药物的多重免疫层析技术,采用羧基化的磁珠与抗硝基呋喃类药物代谢物的衍生化抗体共价偶联作为检测探针,通过羧基苯甲醛修饰的莱克多巴胺与硝基呋喃类药物代谢物反应,形成具有两种功能结构的的混合物(莱克多巴胺部分和硝基呋喃类药物代谢物部分),并将抗多巴胺单克隆抗体和羊抗鼠免疫球蛋白(IgG)分别喷涂于硝酸纤维素膜形成检测线与质控线,当存有目标分析物的样品溶液流过时,硝基呋喃代谢物部分被免疫磁珠捕获,莱克多巴胺部分被检测线上的相应抗体捕获,最终在检测线上形成可视化的检测结果。将该技术应用于AOZ、AMOZ、SEM、AHD 的检测,当对4 种硝基呋喃代谢物进行单一检测时,LOD 均为0.1 μg/L;而用等量混合的4 种磁珠-抗体结合物进行样品的磁性分离后对多种硝基呋喃同时检测时,LOD 低至0.05 μg/L,证明,该方法不仅检出限低、灵敏度高,而且可用于多种硝基呋喃代谢物的检测。
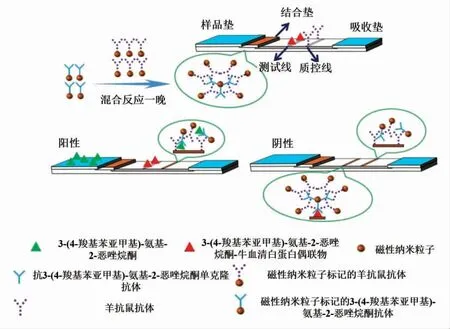
图4 基于MNPs 的信号增强竞争形免疫层析法示意图[55]Fig.4 Schematic diagram of signal-enhanced competitive immunochromatography based on magnetic nanoparticles[55]
2018年Yan 等[55]为快速测定牛奶中的AOZ残留物,建立了以四氧化三铁磁性纳米颗粒(Magnetic nanoparticles,MNPs)为标记物的双探针免疫层析法,通过EDC/NHS 反应将MNPs 分别标记于抗CPAOZ 单克隆抗体和羊抗鼠IgG 形成两种探针,并固定于共轭垫,当含有目标分析物的溶液经过时,两种预先混合的探针会与目标分析物结合,产生一个聚集大量MNPs 的网络结构复合物,以实现检测信号的放大,从而达到通过减少抗体的使用量提高免疫层析检测技术的灵敏度。该法对PBS 中AOZ 的LOD 为0.044 ng/mL,半定量分析能力(阈值)为0.88 ng/mL,远低于基于传统的胶体金免疫层析方法。在实际样品奶粉中AOZ 的LOD 和阈值与PBS 中的数值基本一致,说明该方法可用于实际样品中AOZ 的检测。
3.4 其它标记物
随着技术的发展与进步,有研究者将结晶紫染料、乳胶珠、Co3O4纳米颗粒、聚多巴胺纳米球等标记材料引入免疫层析技术中,对食品中的硝基呋喃类药物进行检测。
2019年,Dou 等[56]首次将非纳米材料结晶紫(Crystal violet,CV)染料通过非共价结合作用染色于抗体,开发出定量检测虾、鱼、肉中AOZ 的结晶紫免疫层析法。该方法检测迅速,在不同的样品基质中的LOD 几乎一致。同年,Wang 等[57]以颜色多样的彩色乳胶珠(Latex bead,LB)作为光学信号,通过链霉素-亲和素的方法形成4 种颜色的LB-抗体探针,建立高通量乳胶珠免疫层析方法,并应用于鸡、鱼、虾中AOZ、AMOZ、AHD、SEM 残留的快速检测。该方法灵敏度高,检测快速,可实现对动物源食品中多种分析物的高通量现场筛选。
2020年,Su 等[58]发现Co3O4纳米颗粒(Nanoparticles,NPs)自身的棕色属性可以实现免疫条带中信号标记材料的要求,合成了二巯基丁二酸修饰的Co3O4NPs,通过静电作用与抗CPAOZ 抗体连接,构建定量检测蜂蜜、鸡肉、猪肉、奶粉中AOZ的Co3O4纳米粒子侧流免疫层析法。该方法精确度高,其LOD 是传统胶体金免疫层析的3 倍。此外,基于聚多巴胺纳米球(Polydopamine nanospheres,PDA NPs)自身较强的颜色属性,Liu 等[59]创新性地以PDA NPs 为抗体标记物,通过简单的混合方式将PDA NPs 修饰到抗CPAOZ 抗体上,构建用于虾、猪肉、奶粉中AOZ 定量或半定量检测的免疫层析法。该方法避免了传统抗体有机交联剂导致抗体活性降低甚至变性的可能,提高了检测的灵敏度。
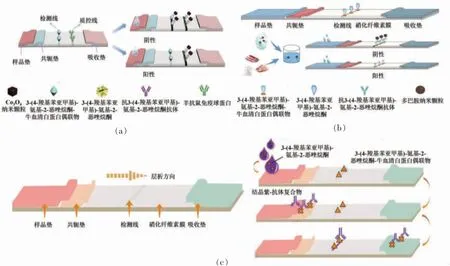
图5 基于Co3O4 NPs(a)[58]、PDA NPs(b)[59]、结晶紫[56](c)检测CPAOZ 的免疫层析结构图与过程图Fig.5 The immunochromatography structure and detection process diagram based on Co3O4 NPs[58](a),PDA NPs[59](b),rystal violet [56](c)
除上述举例外,本文对近10年来基于免疫层析技术检测动物性食品中硝基呋喃类药物的相关报道进行总结,详见表1。
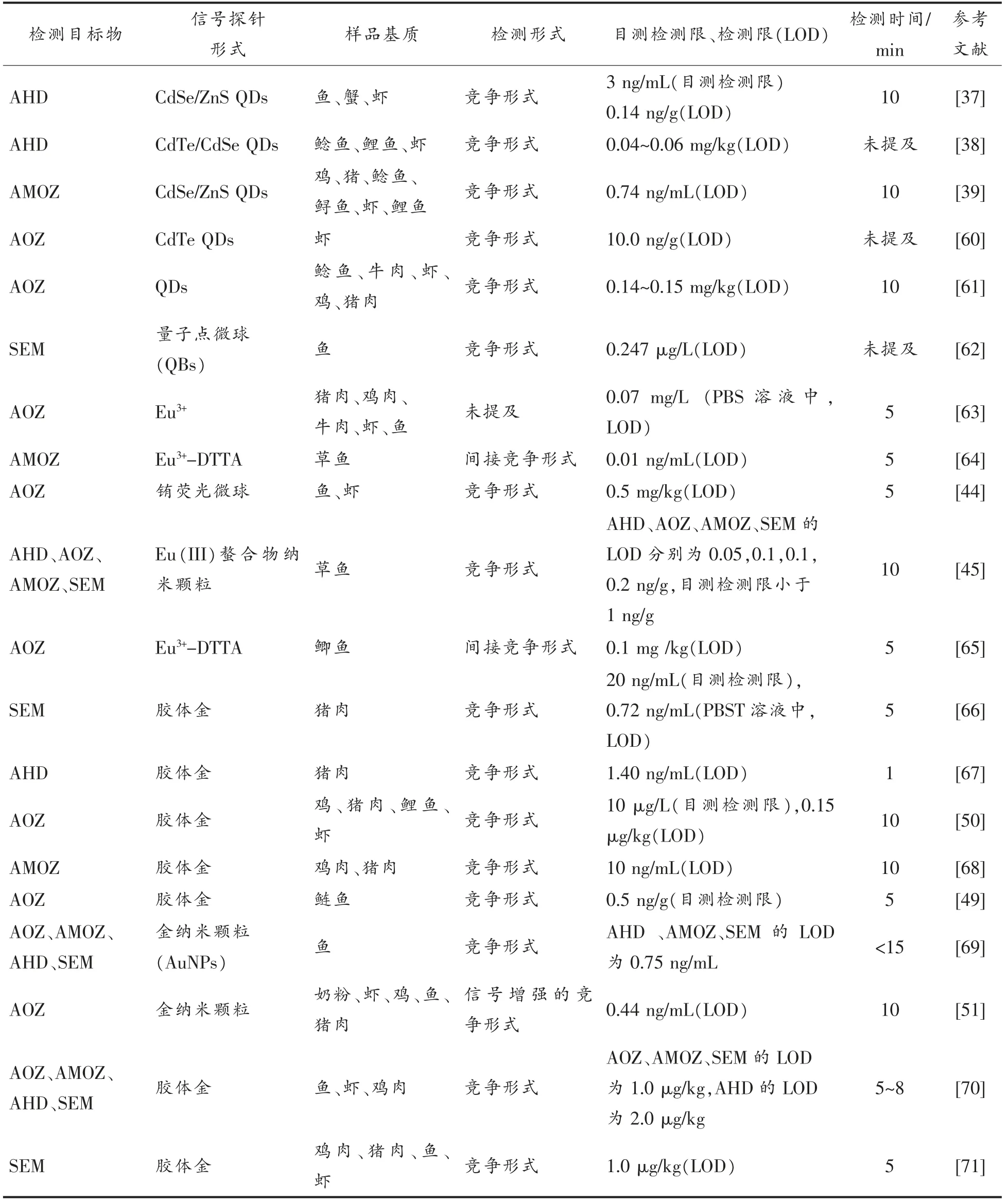
表1 近10年基于免疫层析技术检测动物性食品中硝基呋喃类药物的文献报道Table 1 The reports on the detection of nitrofuran drugs in animal food based on immunochromatography in recent ten years
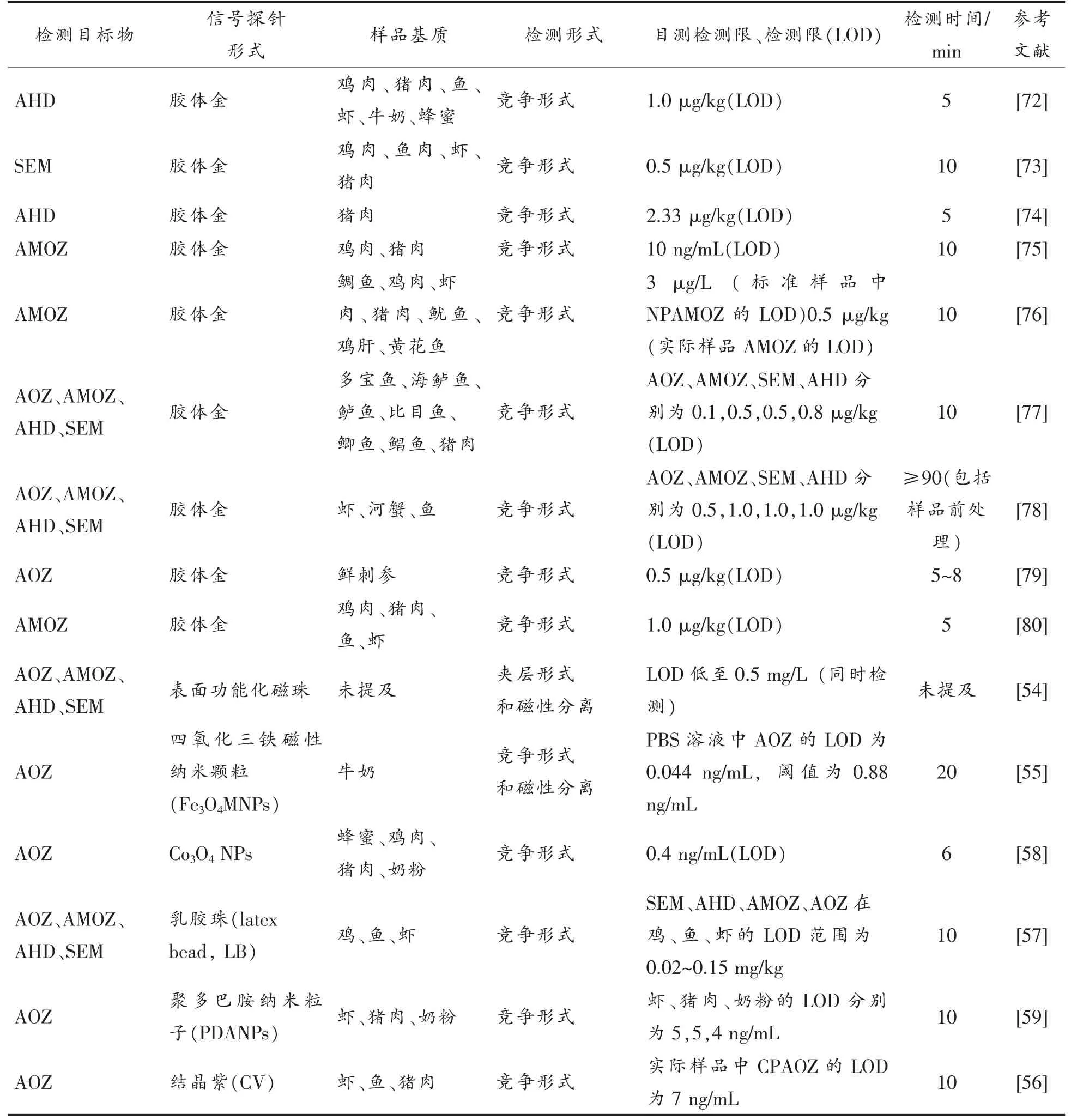
(续表1)
4 结语
硝基呋喃类药物具有致突变性和致癌性,可危及消费者健康及生命安全。目前,免疫层析技术被广泛应用于检测食品中的硝基呋喃药物及其代谢物,其中的一些方法能够满足欧盟和中国设定的最大残留限,然而,大多数研究集中在检测单一硝基呋喃类药物的代谢物上,很少涉及硝基呋喃类药物的多重免疫层析分析。尝试结合多种标记材料,开发出一种可同时检测食品中多种硝基呋喃类药物残留的高通量筛查免疫层析技术是未来的发展趋势。
此外,近年由于胶体金易于制备和表面功能化,因此有关胶体金的免疫层析技术在食品中硝基呋喃药物及其代谢物的检测报道很多。实际情况是:该方法容易受到背景信号影响,存在灵敏度低的缺陷,且仅适合目标分析物的定性与半定量检测。随着免疫层析技术中标记材料的不断发展,开发新型的标记材料(如富勒烯与石墨烯)应用于免疫层析技术的构建,对于提高检测的信号强度与灵敏度很关键。为获得更准确的定量结果,构建的免疫层析试纸条应与带式阅读器相结合。
研究表明,以体外SELEX(指数富集的配体系统进化技术)过程产生的核酸适配体(Aptamer)作为一种具有高特异性识别特点的人工寡核苷酸片段,其具有标记过程和结构修饰简单,稳定性、重复性好,灵敏度高等特点,优于抗体,近年来成为试纸条生物传感器中一种特殊的生物识别因子。然而,在利用免疫层析技术检测食品中硝基呋喃类药物及代谢物的众多研究中,都是寻找最合适的特异性抗体作为目标分析物的生物认知分子,而使用硝基呋喃类药物代谢物的适配体作为目标分析物的特异性识别分子未见报道。开发硝基呋喃类药物的适配体,将其应用于构建其分子识别元件,具有较好的发展前景。免疫层析技术可高通量快速分析食品中硝基呋喃类药物,对保障食品安全发挥了重要作用。
