CRISPR-Cas系统在食源性致病菌中的结构与功能研究进展
2021-12-17卓启云吴瑜凡刘阳泰李红梅董庆利
王 翔,卓启云,吴瑜凡,刘阳泰,李红梅,董庆利
(1 上海理工大学医疗器械与食品学院 上海200093 2 张家港海关综合技术中心 江苏苏州215600 3 华东理工大学化学与分子工程学院分析测试中心 上海200237)
食源性疾病是我国突出的公共卫生问题,致病来源的范围大,导致人体患病的几率高[1]。世界卫生组织的统计数据显示,在全球每年感染食源性疾病的15 亿人口中,由食源性致病微生物引起的占70%[2]。食源性致病微生物包括细菌、真菌和病毒,其影响最大,涉及面最广,引起疾病最多。常见的食源性致病菌有单核细胞增生李斯特氏菌、沙门氏菌、金黄色葡萄球菌、大肠埃希氏菌、空肠弯曲菌、副溶血弧菌、志贺氏菌等。食源性致病菌感染人体后会导致多种疾病,如胃肠炎、脑膜炎和败血症等或者直接引起人体中毒,甚至死亡[3-4]。致病菌的致病能力与其生物学功能息息相关,如毒性大小决定细菌致病能力高、低;生物膜会提高细菌对不利环境条件的抗性;耐药性降低抗生素对细菌的作用,从而提高细菌的存活能力。这些功能特性都给食源性致病菌的控制带来极大的挑战。食源性致病菌的生物学功能发挥作用主要由其基因决定,包括遗传性基因序列和获得性基因序列,如规律成簇间隔短回文重复序列(Clustered regularly interspaced short palindromic repeats,CRISPR)。
CRISPR 是细菌免疫防御系统的组成部分[5],存在于45%的细菌基因组和87%的古细菌基因组[6],在发挥作用时,通常有相关Cas 蛋白(CRISPR -associated proteins,Cas)的协助,CRISPR 和Cas 蛋白共同组成CRISPR-Cas系统,能有效抵御外源移动原件的入侵,以维持自身遗传信息的稳定性和完整性[7]。CRISPR-Cas系统的作用机制可分为3 个阶段:细菌整合外源移动遗传元件的适应阶段(adaption),crRNA(CRISPR RNA)形成的表达阶段(biogenesis),破坏再次入侵的外源移动元件的干扰阶段(interference)[8]。CRISPR-Cas系统新近的研究表明:其在细菌中具有基因表达调节的功能[8-9]。本文总结常见食源性致病菌中CRISPR-Cas系统的结构与功能研究,为进一步探索该系统携带的生物信息提供帮助,为深层次阐明该系统与食源性致病菌耐药性、毒性等生物功能之间的关系提供参考。
1 CRISPR-Cas系统的结构与分类
CRISPR-Cas系统是目前发现的唯一一种原核生物的适应性免疫系统[10],同时也是原核生物基因组中分布最广的重复序列家族[11]。CRISPR 基因座于1987年首次在大肠杆菌中以重复序列的形式被观察到[12],2002年才正式命名为CRISPR[13],由CRISPR 基因座和cas基因两大部分组成。如图1所示,CRISPR 基因座包括前导序列(Leader)、间隔序列(Spacers)、重复序列(Direct repeats,DR),间隔序列和重复序列交替排列形成R-S 结构,是CRISPR 系统的重要作用部分;前导序列的长度在300~500 bp 范围,是一段富含碱基A 和T 的序列,位于R-S 的上游,与第1 个重复序列相连,当宿主整合外源移动遗传元件时,间隔序列插入第1 个重复序列和前导序列之间,前导序列种内保守,种间差异;重复序列长度在21~37 bp 范围,具有保守性,通常在序列两端有碱基变化,重复序列即使在同种微生物,不同菌株间的数量也是不同的;发挥免疫作用的主要序列片段是间隔序列,与重复序列的长度相似,来源是外源核酸,以噬菌体和外源质粒为主[13-14]。细菌有时为限制CRISPR 基因座的大小,会有删除间隔序列的行为[15]。删除的大多是位于CRISPR 的3' 端较保守的间隔序列[16]。Cas 蛋白是CRISPR-Cas系统发挥免疫作用不可或缺的一部分,主要发挥解旋酶、核酸酶等的作用,常见的Cas 蛋白有Cas1、Cas2、Cas3、Cas6、Cas9、Cas10、Csn1、Csn2,其中Cas1 和Cas2 均为核酸酶,在间隔序列整合阶段发挥作用,存在于所有CRISPR-Cas系统中[15]。有研究者提出,Cas1 和Cas2 有可能在细菌感染噬菌体后通过引起细胞休眠来抵御噬菌体[17]。
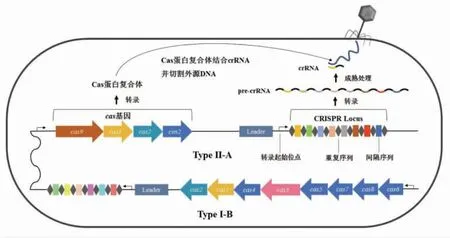
图1 CRISPR-Cas系统的类型及其基本结构(以单核细胞增生李斯特氏菌为例)Fig.1 The types and basic structure of CRISPR-Cas system(Listeria monocytogenes as an example)

表1 常见食源性致病菌CRISPR-Cas系统特征Table 1 CRISPR-Cas system characteristics of common foodborne pathogens
2 CRISPR-Cas系统的功能
近年来,CRISPR-Cas 技术在高效基因编辑中的作用受到关注,其中以II 型系统CRISPR-Cas9在基因编辑技术应用最广泛。而CRISPR-Cas系统最初发现为原核细菌的适应性免疫系统[15],具有抵御外源质粒、噬菌体侵袭的功能;除此之外,新近研究发现,CRISPR-Cas系统在细菌中还具备基因表达调节的功能[8-9],包括调节细菌耐药能力,控制细菌毒力,涉及生物膜形成等[35]。
2.1 CRISPR-Cas系统和细菌耐药性之间的关系
CRISPR-Cas系统占细菌基因组序列的1%,表明此系统在细菌的生存进化中起重要作用[14],其中关于CRISPR-Cas系统和细菌耐药性之间的关系已有广泛研究。多数研究表明,当细菌基因组中CRISPR 系统具有活性时,其毒性和耐药性都相对较低,并在获取毒性、耐药性的过程中,丢失和主动删除CRISPR 结构或使CRISPR 结构失活(表2)。
Bikard 等[36]研究肺炎链球菌时发现,肺炎链球菌在面对抗生素的强选择性应力时,会丢失基因组中的CRISPR 基因座以获得抗生素抗性,若CRISPR-Cas系统的目标核酸序列包含可以赋予菌株一些特征的基因序列,菌株则会自动删除CRISPR 基因座或使其失活以获得相关特性。研究表明,沙门氏菌在获取氟代喹诺酮类耐药性时,CRISPR-Cas系统基因序列发生20 个碱基片段的插入和缺失,以及273 个单碱基位点的突变[37],这一行为导致沙门氏菌CRISPR-Cas系统免疫功能的缺失。间隔序列和目标物之间只要有一个碱基不匹配,便可使CRISPR-Cas系统对外源移动遗传元件的抗性消失[5]。另外,前间隔序列(Protospacer)和前间隔序列邻近序列(Protospacer adjacent motifs,PAMs)的保守性对该系统的抗性至关重要,单一核苷酸的改变能使噬菌体躲避CRISPR 免疫机制的作用[38]。相反地,有研究者指出间隔序列和目标核酸的互补性很低[39],碱基突变不能影响间隔序列和其目标物匹配。cas基因对致病菌的免疫作用也是不可或缺的,CRISPR-Cas系统失活的方法中包括向cas基因中引入转座子、使cas基因功能丧失等[8]。Palmer 等[40]研究表明粪肠球菌对氨苄西林的抗性增加,是由于基因序列中的CRISPR 基因座丢失。研究也发现粪肠球菌只有CRISPR 基因座,无Cas 蛋白,其基因组中抗生素耐药基因仍十分丰富。此研究者还指出,9株肠球菌在缺失CRISPR-Cas系统的同时,也缺乏对抗生素的抗性,其中6 株肠球菌因无全基因组序列的详细信息,故在它们的基因组中发现不同于现有3 种CRISPR-Cas系统的CRISPR 结构的可能性,此结果与空肠弯曲菌的研究结果相同[40-41]。
刘兴雨[42]在研究临床分离的铜绿假单胞菌时,发现CRISPR 阳性菌株对β-内酰胺类抗生素亚胺培南的耐药率低于CRISPR 阴性菌株。此现象并非绝对,对大肠杆菌CRISPR-Cas系统与耐药性的关系研究发现:基因组含有CRISPR 基因座的菌株多重耐药率明显高于不含CRISPR 基因座的菌株,同时多重耐药菌株和标准株cas基因的表达量差异并不显著。研究表明大肠杆菌CRISPR 结构和多重耐药呈现出罕见的正相关[43],其原因可能是因所选取菌株的差异性。某些大肠杆菌中发现的CRISPR 阵列比较小,也较稳定,因此CRISPR 结构在近万年的生存进化中没有显著变化[44]。然而,在噬菌体的快速进化过程中,大肠杆菌的CRISPR 阵列未发生明显变化便无法阻止外源核酸的侵袭,携带耐药基因的外源核酸直接整合到细菌基因组,这便解释了CRISPR 结构和多重耐药同时存在的现象。
CRISPR-Cas系统的耐药性还能从其使细菌免于被噬菌体裂解方面来理解。噬菌体侵入宿主后,利用宿主内的营养物质新陈代谢,并用氨基酸和碱基合成自身所需蛋白质与核酸,将蛋白质与核酸组装在一起,从而使细菌裂解死亡,释放出大量新的噬菌体。将噬菌体的遗传物质整合到自身基因组序列的细菌称为溶原菌,其对同源噬菌体的侵入有免疫作用,且噬菌体的核酸可以随着宿主细菌的分裂同步复制[45],其分裂产生的细菌均对该种噬菌体免疫。CRISPR-Cas系统有明显的弊端,即它具有攻击宿主细菌的可能性。CRISPR 系统无法区分核酸分子是来自于自身还是外部,因为间隔序列不仅可与外源质粒及噬菌体的前间隔序列配对,也可与宿主细菌的染色体配对,极有可能形成“自身免疫”,杀死宿主细菌,而前间隔序列邻近序列是区分自身序列与外源序列的重要信号,在现有研究报道中,I 型和II 型CRISPR-Cas系统均是通过该序列识别外源核酸的,III 型系统中暂未发现前间隔序列邻近序列的相关信息[46-47]。
从现有研究结果可以得出,为获得耐药性,不同细菌对CRISPR-Cas系统的处理方式不同,耐药能力与CRISPR 的关系也是不同的,这是因为细菌之间存在差异,所携带的CRISPR 亚型在进化过程中也发生变化,从而作用方式不同,最终结果也不同。
2.2 CRISPR-Cas系统与细菌毒性的关系
CRISPR-Cas系统和毒性的关系是研究热点之一,对不同致病菌的研究结果是不同的(表2)。链球菌毒素和毒力因子是通过整合噬菌体基因获取的,在缺少CRISPR-Cas系统的菌株中存在大量原噬菌体[48],表明CRISPR-Cas 结构能阻碍链球菌对噬菌体的整合,从而减少链球菌获得毒力因子的来源。对于空肠弯曲菌,同样是小的或缺失CRISPR 阵列的菌株会增强致病能力;导致严重胃肠炎的空肠弯曲菌,其基因组中就是短的CRISPR结构[49]。志贺氏菌致病的主要原因是其毒力基因编码产物对宿主的侵袭和毒性作用,致病能力取决于细菌是否存在毒力基因。Bikard 等[36]研究表明CRISPR-Cas系统可以干扰、阻止毒力基因的转移。然而,郭向娇等[50]发现,志贺氏菌毒力基因ipaBCD检出率与CRISPR-Cas系统是否存在无明显关系。在另一项志贺氏菌的研究中也得出CRISPR-Cas系统与毒力基因不相关的结论[32],其原因是该研究中使用的菌株均为临床分离,携带毒力基因的几率高,毒力强,且选择观察的毒力基因种类少,因此无法发现毒力基因和CRISPR 系统之间的联系。

表2 食源性致病菌中毒性和耐药性与CRISPR Locus 状态的关系Table 2 The relationship between the status of CRISPR Locus and toxicity or drug resistance in foodborne pathogens
肠球菌CRISPR-Cas系统可从两个方面调节细菌致病能力:一是当携带毒力基因的外源DNA侵入肠球菌时,CRISPR 系统发挥免疫作用抵御侵袭,降低细菌的毒性;二是CRISPR 系统调节毒力基因的表达,增强细菌的毒力,且促进细菌在宿主体内的定植能力[51]。在小鼠模型试验中,将肠球菌接种到小鼠体内,含有CRISPR 的菌株比不含CRISPR 的菌株表现出更强、更快的致死率[52]。单核细胞增生李斯特氏菌中存在独特的RliB CRISPR 系统,这是一个严重退化的系统。分析单增李斯特菌不同遗传谱系的CRISPR 系统,发现主要致病谱系具有结构组成高度一致的RliB CRISPR 系统,这表明该系统参与单增李斯特菌的毒力调节,表现为它可以通过转录形成一类特殊的crRNA,从而产生特殊的茎环结构,参与毒力调节[53-54]。含有退化CRISPR 系统的菌株展现出强毒力[55]的原因在于退化的CRISPR 系统无法发挥完整CRISPR 结构的作用,不能切割外源核酸,外源毒力基因整合到细菌基因组中,增强了菌株的毒力。
2.3 CRISPR-Cas系统与细菌生物膜的形成
CRISPR 系统还影响细菌生物膜的形成,从而影响致病菌的传播、毒性和控制。如携带CRISPRCas系统的粪肠球菌具有更强的生物膜形成能力,能更好地抵御外界因素对细菌的破坏,同时有效提高细菌在宿主内的定植效率[52]。铜绿假单胞菌的噬菌体DMS3 中的DMS3-42基因是抑制生物膜形成的关键,当细菌拥有完整的CRISPR-Cas系统,且CRISPR 结构的间隔序列不能和DMS3-42 完全匹配时,噬菌体发生溶原作用后能够抑制铜绿假单胞菌生物膜的形成[56-57]。生物膜是细菌生存的重要因素,目前对CRISPR 和生物膜的关系研究尚浅,CRISPR-Cas系统抑制生物膜形成的机理尚不明确,因此探究二者的关系对致病菌的防控至关重要。
2.4 CRISPR-Cas系统在细菌分型上的应用
CRISPR-Cas系统在细菌进化过程中是动态且复杂的。CRISPR 阵列中的间隔序列表明细菌曾经遭遇何种噬菌体、外源质粒的侵袭,且整合到基因组中的间隔序列会随细菌的分裂复制被遗传到下一代。基于此,CRISPR-Cas系统在细菌分型和溯源方面具有巨大的应用潜力。
2003年,Schouls 等[58]首次使用CRISPR-Cas系统对空肠弯曲菌进行分型,揭示种群生物和流行病学研究中菌株间的系统发育关系。在研究CRISPR 分型方法过程中,发现基因多态性较低的细菌CRISPR 分型分辨率高,而多态性高的细菌CRISPR 分型分辨率较低,由此表明可将CRISPR分型和其它分型方法结合对基因多态性高的细菌进行分型[7]。大肠杆菌的CRISPR 分型常和多位点序列分型(Multilocus sequence typing,MLST)相结合[44]。对沙门氏菌进行CRISPR 分型,结果表明其与ST 型、血清型紧密相关[59]。将CRISPR 分型与多毒力位点序列分型(Multi-virulence-locus sequence typing,MVLST)结合的CRISPR-MVLST技术具有追踪肠炎沙门氏菌主要生态起源的潜力[60]。CRISPR 分型在区分不同血清型的菌株、同一血清型的亚型菌株中具有明显的优势,可开发为追踪沙门氏菌病来源并鉴定强毒菌株血清型的有效工具[61]。利用CRISPR-Cas 技术进行细菌分型存在的问题有:1)CRISPR 结构中间隔序列具有高度多态性;2)分型、溯源的关键是间隔序列,而细菌存在精确删除间隔序列的行为[6],无法知晓删除部分的细菌遗传信息,给细菌分型和溯源带来一定的困难;3)CRISPR-Cas系统仅存在于45%的细菌和87%的古细菌基因组中[6],并非所有细菌都能进行CRISPR 分型。
3 结语
对致病菌毒性的研究已从毒力表型深入到毒力基因,对致病菌防控的研究从使用抗生素控制致病菌到研究致病菌的耐药基因。细菌中,一部分耐药基因、毒力基因从外源移动遗传元件获取,且外源质粒、噬菌体与CRISPR-Cas系统密切相关。在细菌的生存进化过程中,质粒和噬菌体携带的抗性、毒性基因整合到细菌基因组中,使细菌获得抗性或毒性。而CRISPR 结构阻止了外源核酸的整合,阻断了细菌获得特征性基因的来源,因此,CRISPR-Cas系统也被认为是基因水平转移(Horizontal gene gransfer,HGT)的阻碍[8,36,62]。
研究CRISPR-Cas系统的目的在于掌握其所携带的生物信息,判断此系统可否为控制食源性致病菌提供指导作用。如今,研究人员针对细菌的耐药性创建了一个双噬菌体系统,用噬菌体向细菌中引入CRISPR-Cas系统,细菌会删除相应的抗性质粒,从而使耐药细菌变得敏感,这为处理细菌的耐药性提供了有效的解决办法。鉴于CRISPR-Cas系统对细菌耐药性的有效处理,同样也可以从CRISPR 入手,研究其与细菌毒性、生物膜形成等其它特征的相关性。在研究食源性致病菌CRISPR-Cas系统的过程中,仍有亟待解决的问题,如细菌选择整合的间隔序列的标准;不同菌株中CRISPR 位点的数量不同,多个CRISPR 位点之间发挥作用是独立、叠加的,还是抑制的;如何将CRISPR 分型和致病菌暴发的地理来源结合起来等。本文从多角度综述CRISPR-Cas 结构及功能信息,为进一步挖掘CRISPR-Cas 携带的信息、阐明其功能以及研究其对细菌生物学特征的影响提供参考依据。
