氨基酸介导的多糖降血糖机制
2021-12-17张瑞芳吴清平谢意珍陈雪峰邵威铭
张瑞芳,肖 春,吴清平*,谢意珍,陈雪峰,邵威铭
(1 陕西科技大学食品与生物工程学院 西安710021 2 广东省科学院微生物研究所 华南应用微生物国家重点实验室 广东省微生物安全与健康重点实验室 广州510070 3 蕉岭铁汉大健康产业投资有限公司 广东蕉岭514100)
近些年来,多糖的降血糖功能受到广泛关注,对于其机制的探索也与日俱增。目前对于多糖降血糖机制的研究多聚焦在改善胰岛素抵抗或糖代谢的相关蛋白靶点及路径等4 个方面:1)抑制α-糖苷酶的活性[7],使葡萄糖生成及吸收减慢,降低餐后血糖;2)改善胰岛素抵抗,如抑制蛋白酪氨酸磷酸酶1B(PTP1B)的活性[8-9],增强胰岛素受体(IR)作用[9-11],调节葡萄糖转运体4(GLUT4)的功能[12],加快葡萄糖转运和代谢;3)通过改善氧化应激,抑制核转录因子κB(Nuclear factor kappa B)活性[13],或调节免疫[14],保护胰岛β 细胞;4)抑制糖异生关键酶,减少糖原分解,降低2 型糖尿病小鼠空腹血糖,如降低磷酸烯醇式丙酮酸羧激酶(PEPCK)、葡萄糖-6-磷酸酶(G6Pase)和肝糖原磷酸化酶(GP)[12,15-16]的表达等。
随着代谢组学的发展,人们逐渐意识到小分子代谢物在人体中或也扮演着重要角色,它们分布广泛,种类繁多,不仅参与糖代谢、脂质代谢、氨基酸代谢等生物体必要的生理过程,为人体提供能量,还与激素等相关信号调节密切相关[17]。近年研究发现,部分氨基酸或可作为糖尿病病理特征标志物[18]。值得关注的是,基于代谢组学分析时发现,经多糖干预后的差异代谢物多会富集在氨基酸代谢通路上[19-21],而氨基酸代谢与糖代谢紧密相关[18]。本篇从氨基酸类代谢物及其参与的代谢途径角度阐释多糖降血糖机制。
1 氨基酸水平异常与2 型糖尿病的病理关系
1.1 氨基酸类2 型糖尿病潜在生物标志物
大量的研究表明,氨基酸含量在糖尿病病人体内异常,代谢发生紊乱,或可作为一种潜在的生物标志物辅助糖尿病的诊断[22]。
支链氨基酸(BCAAs,亮氨酸、缬氨酸和异亮氨酸)浓度在肥胖人群血液中显著升高[23],研究发现BCAAs 水平升高是2 型糖尿病和胰岛素抵抗风险的良好预测指标[24]。Adeva 等[25]发现血浆中BCAAs 水平的升高可能发生在糖尿病确诊前,有研究提示至少可追溯到12年前[26]。苯丙氨酸、酪氨酸浓度在肥胖人群血液中显著升高[23]。研究表明,血浆中芳香族氨基酸(AAAs,苯丙氨酸、酪氨酸、色氨酸)水平较高的研究人群5年新发糖尿病的风险明显较高[27]。甘氨酸水平较高的研究人群5年新发糖尿病的风险明显较低[27],这与meta 分析中甘氨酸与2 型糖尿病风险呈负相关结果一致[28]。除此之外,血清中天冬酰胺水平被证明与糖尿病风险高低呈正相关[29]。
1.2 氨基酸参与的胰岛素抵抗机制
1.2.1 通过哺乳动物雷帕霉素复合物 1(mTORC1)通路引发胰岛素抵抗 mTORC1 是细胞信号转导的控制中心,通过影响生长因子、营养、能量供应从而控制体内蛋白质、脂质、核苷酸等的合成和分解代谢[30]。氨基酸在mTORC1 的激活中发挥着重要作用,尤其是亮氨酸、谷氨酰胺和精氨酸[31]。BCAAs、精氨酸、赖氨酸、谷氨酰胺含量过高会引发肝细胞及脂肪细胞内胰岛素抵抗[32],可能与其持续地激活mTORC1 通路相关,通过核糖体蛋白S6 激酶1(S6K1)的作用使胰岛素受体底物(IRS-1)磷酸化而使其活性受到抑制,从而导致胰岛素抵抗[32-34],影响糖代谢。研究表明,mTORC1 过度活化会对胰岛素信号进行负反馈调节[31]。此外,部分氨基酸的代谢产物也会引发胰岛素抵抗,如组氨酸经肠道菌群作用产生的咪唑丙酸可通过激活mTORC1 抑制胰岛素受体底物(IRS)发挥作用[35],损坏葡萄糖耐受和胰岛素信号传导,进而导致胰岛素抵抗。
1.2.2 氨基酸中间代谢产物积聚引发胰岛素抵抗2 型糖尿病患者骨骼肌内调节BCAAs 代谢的基因表达量和蛋白含量降低,造成BCAAs 和支链酮酸类代谢产物水平升高[36],氨基酸代谢中间产物在骨骼肌中积累,引发胰岛素抵抗[37],如骨骼肌中缬氨酸的代谢产物3-羟基异丁酸酯过多可使不完全氧化的脂质在骨骼肌积累而造成胰岛素抵抗[38]。过多支链酮酸转运进入肝脏,产生代谢毒素酰基肉碱,影响TCA 循环,增加糖异生,造成肝脏胰岛素抵抗[37]。色氨酸可经5-羟色胺途径生成褪黑素[39],研究证明褪黑素与胰岛素抵抗相关[40]。色氨酸还可通过犬尿氨酸途径生成吡啶甲酸和硫酸吲哚酚[41],此路径失调也与胰岛素抵抗相关[42]。
从上述分析可看出,氨基酸含量异常可直接影响mTORC1 途径或通过其代谢物间接调控脂质转运、TCA 循环、糖异生等途径引发胰岛素抵抗,进而影响糖代谢。通过多糖干预改善体内氨基酸及其代谢物的含量,或可减缓胰岛素抵抗,进而改善糖尿病。
2 氨基酸介导的多糖降血糖机制
糖尿病是一种全身性系统疾病,多糖对于糖尿病的调节靶点和途径广泛[6]。代谢组学是研究代谢物与生理病理变化的重要手段。目前,基于代谢组学对多糖降血糖机制的研究仍在初步阶段,虽然研究者所选取的样本不同、分析手段也略有差异,但仍然发现经多糖干预后的氨基酸代谢谱变化(见表1),为降血糖机制的阐明提供了新的分析角度和方式。

表1 多糖干预2 型糖尿病对氨基酸代谢谱的影响Table 1 Effects of polysaccharide on amino acid metabolism in type 2 diabetes mellitus
氨基酸代谢与糖代谢密不可分[18]:一方面,部分氨基酸可通过促进胰岛素或者胰高血糖素分泌调节血糖;另一方面,生糖氨基酸可通过糖异生影响血糖水平。
当然有,最大的伤害就是——饿。“饿”当然是我们最直观的感受,但不吃晚餐具体还有什么伤害呢?一起来看看!晚餐究竟有多重要?不吃晚餐危害大。
2.1 多糖干预对促胰岛素分泌的氨基酸的调节
胰岛素是体内唯一可以降低血糖的激素,可促进全身组织对葡萄糖的摄取和利用,抑制肝糖原的分解和其它物质转换成葡萄糖,从而维持体内的血糖平衡[43]。亮氨酸、精氨酸、异亮氨酸、苯丙氨酸、赖氨酸是目前发现的可促进胰岛素分泌的氨基酸[32]。亮氨酸、精氨酸促进胰岛素释放,其机制与mTOR-S6K1 信号途径相关。研究表明,限制饮食中的亮氨酸含量可通过降低此信号途径增强胰岛素敏感性[44]。亮氨酸、异亮氨酸可促进胰高血糖素样肽-1(GLP-1)的释放,进而刺激胰岛素的分泌,改善小鼠的胰岛素应答,控制2 型糖尿病小鼠的餐后血糖[45]。一般性调控阻遏蛋白激酶(GCN2)是一种氨基酸缺乏感受器,短期亮氨酸缺乏能够激活细胞的胰岛素信号通路,增强全身的胰岛素敏感性[46]。多糖对于此些氨基酸含量的调节,意味着其可间接促进胰岛素的分泌,降低血糖。
常晋霞等[20]对2 型糖尿病KM 小鼠进行为期6 d、剂量100 mg/kg 的刺五加多糖灌胃干预,随后进行血清代谢组学分析。结果发现,模型组苯丙氨酸、酪氨酸、丝氨酸水平显著上调,亮氨酸、缬氨酸、丙氨酸、谷氨酰胺显著下调,刺五加多糖可以使失调的氨基酸(亮氨酸、苯丙氨酸、谷氨酰胺、缬氨酸)水平不同程度地回归正常,代谢通路富集分析得到4 条与糖尿病相关的氨基酸代谢通路,分别为苯丙氨酸-酪氨酸-色氨酸合成路径、缬氨酸-(异)亮氨酸合成路径、苯丙氨酸代谢路径和丙氨酸-天冬氨酸-谷氨酸代谢路径。罗游[47]和Shang等[48]给2 型糖尿病KM 小鼠灌胃蛹虫草多糖(CBPS-II)3 周,取血清进行代谢组学分析。结果显示,亮氨酸和异亮氨酸、谷氨酰胺、缬氨酸在模型组中水平升高,推测肝功能失调,导致氨基酸代谢水平异常。高剂量CBPS-II(100 mg/kg)可有效改善这些氨基酸的浓度,研究认为该多糖具有一定程度的肝脏保护功能。季涛等[49]对2 型糖尿病ICR 小鼠灌胃桑叶多糖(200 mg/kg)5 d,随后进行血浆代谢组学研究中发现亮氨酸、苯丙氨酸、缬氨酸、酪氨酸在糖尿病小鼠体内含量降低,灌胃后氨基酸代谢改善,预测桑叶多糖发挥作用与氨基酸代谢密切相关。Nie 等[50]基于尿液代谢组学研究发现,2 型糖尿病Wistar 大鼠亮氨酸、赖氨酸、组氨酸、半胱氨酸、色氨酸含量异常,或可作为潜在生物标志物。经阿拉伯糖基木聚糖(100,200,400 mg/kg)干预4 周后,含量异常的氨基酸水平得到改善,提示此多糖可通过调节氨基酸代谢来调节血糖。Jiang[41]等以胡芦巴半乳甘露聚糖(500 mg/kg)灌胃2 型糖尿病SD 大鼠28 d 后,通过尿液代谢组学得到与氨基酸相关的生物标志物:咪唑丙酸、吡啶甲酸、马尿酸,这些代谢物在糖尿病大鼠体内升高。其中,咪唑丙烯酸与组氨酸代谢相关,其通过激活mTORC1 抑制IRS 发挥作用[35],导致胰岛素抵抗;吡啶甲酸和硫酸吲哚酚与色氨酸代谢相关;马尿酸与苯丙氨酸代谢相关[41]。经半乳甘露聚糖灌胃后,这些代谢物含量降低,说明该多糖可通过调节组氨酸、苯丙氨酸及色氨酸代谢发挥降糖作用。
BCAAs 含量异常会引发胰岛素抵抗,而多糖干预后能改善BCAAs 的水平。研究表明,靶向调节BCAAs 代谢可有效减缓糖尿病病人体内脂质和葡萄糖代谢紊乱[51]。多糖通过调节BCAAs 代谢改善糖代谢的潜在路径可能是:多糖可能通过激活BCAAs 的关键代谢酶——支链α 酮酸脱氢酶(BCKD),使BCAAs 的中间有毒代谢产物彻底氧化供能[52];也可能通过抑制相关蛋白质的分解,缓解了胰岛素抵抗,从而降低血糖,然而其具体机制仍不清楚。
2.2 多糖干预对促胰高血糖素分泌的氨基酸的调节
胰高血糖素与胰岛素之间互为拮抗作用,其通过促进糖异生、增加肝糖原分解维持血糖[53]。促进胰高血糖素分泌的氨基酸包括甘氨酸、丙氨酸、天冬氨酸、丝氨酸[32]。在胰岛素抵抗条件下,胰高血糖素分泌增多,进一步导致血糖升高[54];低血糖时,胰高血糖素分泌减少[55],重则引发生命危险。由于近些年研究发现胰高血糖素分泌异常也可参与2 型糖尿病发病[53,56],因此多糖通过调节氨基酸含量从而调控胰高血糖素分泌可能成为研究降血糖机理的新方向,同时亦可避免现有糖尿病药物所引发的低血糖副作用,具有良好的应用前景。
苏氨酸、异亮氨酸、缬氨酸水平在2 型糖尿病SD 大鼠血清样本中升高,丙氨酸、甘氨酸、赖氨酸水平降低,唐华丽等[57]灌胃枸杞多糖(200 mg/kg)1个月后,发现丙氨酸水平回调。Xia 等[19]将枸杞多糖(200 mg/kg)灌胃糖尿病SD 大鼠30 d 后,发现该多糖可通过调节丙氨酸、天冬氨酸和谷氨酸、精氨酸和脯氨酸代谢,进而降低血糖。2 型糖尿病ICR 小鼠经牡蛎多糖(800 mg/kg)处理21 d 后,发现氨基酸代谢产物3-羟基邻氨基苯甲酸、2-羟基苯乙酸、丙酰甘氨酸和苯乙酰甘氨酸在糖尿病小鼠模型体内浓度异常,这与甘氨酸代谢紊乱相关[58],牡蛎多糖干预后可使这些氨基酸代谢物的浓度趋于正常。
2.3 多糖干预对糖异生氨基酸的调节
生糖氨基酸可通过糖异生作用生成内源性葡萄糖,在正常生理条件下维持体内血糖水平[59]。季涛等[49]基于血浆代谢组学分析发现,桑叶多糖可对糖异生氨基酸如缬氨酸、亮氨酸、苯丙氨酸、异亮氨酸进行调节,提示其可通过抑制糖异生,改善血糖。
综上所述,同一种氨基酸在不同的2 型糖尿病动物中会显示不同的结果,含量有的升高有的降低,而多糖对于它们的调节趋势也会有所差异。这些不同的结果可能是由于不同的干预措施所造成的[60],如饲料成分不同、研究样本的差异、所选动物种类和疾病进程的不统一等。另外,糖尿病本身也是由胰岛素分泌不足或者胰岛素抵抗所引起[1],2 型糖尿病动物体内过多的促胰岛素分泌的氨基酸会引发胰岛素抵抗,过少的促胰岛素分泌的氨基酸却会导致胰岛素分泌不足。动物样本量的扩大以及各种影响因素的统一对于可信结果的获得是必要的。另外,因为同一种氨基酸既可以发挥促胰岛素或促胰高血糖素分泌功能,同时也属于糖异生底物,所以氨基酸在2 型糖尿病动物体内到底是发挥着怎样的作用,经多糖干预之后又通过什么途径改善血糖仍然需要进一步验证。Wang 等[26]提出单一生物标志物对于疾病的预测作用有限,用多种标志物组合对于疾病的预测更具说服性。因此,将某些氨基酸的比例作为多糖调节的指标可能更为准确,这需要进一步探索。
综上所述,多糖通过调节氨基酸代谢谱进而改善糖代谢的可能途径有3 条(图1):1)调节胰岛素分泌,改善胰岛素抵抗;2)调节胰高血糖素分泌;3)调节糖异生。由此可见,通过调节氨基酸改善糖代谢或可成为2 型糖尿病治疗新策略。
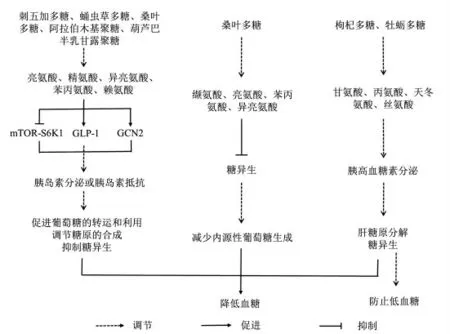
图1 多糖调节氨基酸代谢谱的潜在机制Fig.1 Potential mechanism of polysaccharides regulating amino acids metabolism profile
3 结语
基于代谢组学研究多糖降血糖机制还处于初步阶段。大量研究表明氨基酸作为一种潜在生物标志物或可用于糖尿病的前期诊断。多糖干预后,氨基酸及其代谢物水平得到调节,体内代谢物指标趋向正常,提示多糖可降低糖尿病的发病风险。目前,探究多糖降血糖机制多基于传统的分子生物学手段,此种方法较为单一,无法对生物体代谢进行系统阐述,而代谢组学可以实现高通量检测,省时而全面,有利于对代谢物的系统挖掘。当然,仅通过代谢组学技术来研究确切的降血糖机制仍然有限,若能将多组学联合,同时通过分子生物学验证,或可大大推进其机制的阐释。本团队已经开展了灵芝多糖F31 的肝脏代谢组学研究,发掘了其调控2 型糖尿病小鼠代谢的多条氨基酸相关路径:精氨酸和脯氨酸代谢、酪氨酸代谢、精氨酸生物合成等,后续拟结合多组学技术及分子生物学手段,对F31 降血糖机制进行深入挖掘。
糖尿病是一种全身性、系统性疾病,除本综述重点关注的氨基酸代谢外,多糖干预2 型糖尿病后的差异代谢物也会富集在脂肪酸代谢、糖代谢等路径上,可将这些代谢物与糖尿病生理病理指标(血糖、胰岛素、血脂等)建立相关性网络,寻找与调节这些指标密切关联的代谢物及相关靶点路径。多种组学的发展以及多组学联合手段的应用为糖尿病发病机制和多糖降血糖路径的研究提供了契机,活性多糖降血糖机制的阐明指日可待。
