蒸煮前、后小米中醇溶蛋白的结构和功能性质
2021-12-17付永霞刘振宇
付永霞,刘振宇,张 凡,沈 群
(中国农业大学食品科学与营养工程学院 植物蛋白与谷物加工北京市重点实验室国家果蔬加工工程技术研究中心 北京100083)
小米(拉丁名:Setaria italica)隶属于禾本科,一年生草本,主要种植在亚洲地区。在中国,小米的种植主要分布在河北、山西、内蒙古等[1]。小米营养丰富,含有多种维生素、矿物质、必需氨基酸、不饱和脂肪酸等人体必需的营养物质。近年来小米的营养价值广受关注。小米蛋白平均含量约为11%,高于其它禾谷类作物[2]。谷蛋白、球蛋白、清蛋白和醇溶蛋白是小米蛋白质中主要的组分蛋白,其中醇溶蛋白占46%,是小米中的贮藏蛋白,也是小米中含量最多的一种蛋白[3]。目前,小米醇溶蛋白被用于制备脂肪酶抑制肽、抗炎多肽及抗氧化多肽等[4-5]。通常人们食用蒸煮过的小米,蒸煮后的小米淀粉被糊化,利于消化吸收。有关蒸煮对小米蛋白性质的影响鲜有报道。有研究证明,醇溶蛋白含量会影响黄米面食的蒸煮品质、消化率及感官品质[6]。此外,小米中醇溶蛋白被证实消化率较低,可能对小米的品质产生影响[7]。
本文选取小米醇溶蛋白为试验对象,研究蒸煮前、后小米中的醇溶蛋白的结构和功能性质,为今后开发小米蛋白产品提供试验依据。
1 材料与方法
1.1 材料与试剂
小米品种为东方亮,山西东方亮生命科技股份有限公司;无水乙醇、正己烷,上海麦克林生化科技有限公司;磷酸钠缓冲液、醋酸钠溶液、BCA蛋白浓度试剂盒,北京索莱宝科技有限公司;乙腈,赛默飞世尔生物化学制品(北京)有限公司。
1.2 仪器与设备
ACCULAB ALC-110.4 分析天平,德国Sartorius 公司;SU8020 扫描电镜(Scanning electron microscope,SEM)、CR21GIII 离心机,日本日立公司;U3000 高效液相色谱,美国赛默飞世尔;Q2000差示量热扫描仪(Differential scanning calorimetry,DSC),美国TA 仪器公司;傅里叶变换红外光谱仪,美国PkinElmer 公司;SHZ-B 水浴恒温振荡器,上海龙跃有限公司;FD-1A-50 冷冻干燥,北京博医康有限公司;SP132665 透析袋,上海源叶生物科技有限公司;BD(E2)型热风循环箱,德国Binder 仪器公司。
1.3 试验方法
试验前采用磨粉机将小米碾磨成粉,过60 目筛,用正己烷对小米粉进行脱脂处理并烘干,将得到的小米粉储存在-20 ℃,备用。
1.3.1 蒸煮前、后小米的扫描电镜及糊化度测定
将脱脂小米粉与水以1∶5 的比例混合,置100℃沸水浴中煮沸10 min,离心得到小米粉,置热风干燥箱中烘干24 h,研磨成粉,过60 目筛,即蒸煮后小米粉。采用SU8020 扫描电镜于500~3 000倍数下观察蒸煮前、后小米粉的形貌变化,初步判断小米粉是否熟化。使用DSC 测定蒸煮前、后小米粉的糊化度,判断小米粉的熟化程度。将2 mg脱脂小米粉样品置于铝盘内,加入7 μL 蒸馏水使粉、水完全混合,将铝盘用铝盖密封后静置24 h。在升温速率为10 ℃/min 的条件下,从25 ℃升温到100 ℃,与此同时使用干燥氮气以50.0 mL/min的速率恒温吹扫,以密封的空铝盘作为空白对照。采用TA Universal analysis 软件分析DSC 结果。
1.3.2 小米中醇溶蛋白的提取 将脱脂小米粉与70%乙醇以料液比1∶7 的比例混合,在37 ℃条件下反应2 h,离心、收集上清液,透析,总时长为24 h,中间至少换水4 次。醇溶蛋白在透析过程中逐渐析出,透析结束后离心、收集醇溶蛋白沉淀,冻干。采用凯氏定氮法测得其醇溶蛋白纯度在85%以上。
1.3.3 蒸煮前、后小米中醇溶蛋白的扫描电镜观察 取少量蛋白质固体样品直接粘贴到样品台上,然后喷金镀膜处理,使用SU8020 扫描电镜观察小米醇溶蛋白的微观形态。在加速电压3 kV 的条件下,于5 000~10 000 放大倍数下观察样品,使用内置软件捕获图像。
1.3.4 蒸煮前、后小米中醇溶蛋白的热特性测定
将3 mg 蛋白质样品置铝盘内,铝盘用铝盖密封,然后以10 ℃/min 速度在0~200 ℃条件下用氮气(流速50.0 mL/min)恒温吹扫,以密封空铝盘作为参考,所得数据采用TA Universal analysis 软件分析[8]。
1.3.5 蒸煮前、后小米中醇溶蛋白的氨基酸组成
配制不同待测氨基酸的标准品溶液,氨基酸测定采用的流动相分别为流动相A【V醋酸钠溶液(0.1mol/L,pH6.5)∶V乙腈=93∶7】和流动相B【V水∶V乙腈=1∶4】,然后将A、B 两种流动相稀释5 倍。精密量取上述标准品溶液200 μL,首先加入50 μL 正亮氨酸和50 μL 羟脯氨酸标准溶液,其次加入稀释后的A 溶液和B 溶液各100 μL,摇匀,室温反应60 min。加入400 μL 正己烷溶液振荡5~10 s,待静置分层后,量取下层溶液200 μL,与800 μL 水混合均匀。取200 μL 上述混合溶液,加入800 μL 水继续混合,过滤后待分析。
配制待测醇溶蛋白溶液的步骤参考Mohapatra 等[9]的方法。氨基酸采用C18 色谱柱(4.6 mm×250 mm,5 μm),在流速1.0 mL/min,柱温40 ℃,波长254 nm,进样量10 μL 条件下进行测定。
1.3.6 蒸煮前、后小米中醇溶蛋白的二级结构室温条件下采用光谱纯的溴化钾压片作空白对照,按照1∶200 的质量比将蛋白样品和溴化钾加入研钵中研磨至均匀,压片,置于傅里叶红外光谱仪(FTIR)中测定,在波数4 000~400 cm-1范围内对蒸煮前、后小米粉中的醇溶蛋白进行扫描,扫描条件:分辨率4 cm-1,扫描次数256。使用PeakFit v4.12 软件分析得到的蛋白二级结构图谱。
1.3.7 蒸煮前、后小米中醇溶蛋白的溶解度 称取50 mg 醇溶蛋白溶于5 mL 去离子水中,同时选取1 mol/L HCl 和1 mol/L NaOH 将溶液pH 值调至2~9,在室温条件下混合振荡1 h,8 000×g离心10 min,收集上清液,采用BCA 蛋白浓度试剂盒测定上清液中蛋白浓度[10]。
1.4 数据分析
每组试验重复3 次,作为平行试验,采用美国IBM 公司的SPSS 22.0 软件对数据进行显著性分析。当P<0.05,差异显著。
2 结果与分析
2.1 蒸煮前、后小米的形貌变化
如下图所示,图1a 为未蒸煮小米粉的电镜图,图1b 为蒸煮后小米粉的电镜图。从图1a(左)可以看出,在放大倍数3 000 倍下观察到未蒸煮小米中淀粉颗粒的形状为多边形,彼此黏结在一起,形成复合淀粉颗粒,嵌套在小米蛋白基质中。图1a(右)中,未蒸煮小米中淀粉颗粒呈圆形,彼此依附在一起,部分蛋白体与淀粉颗粒相黏连。刘丹等[11]研究发现在常规谷子品种中含有两类淀粉粒:一类成多边形,属于B 型淀粉粒,另一类C 型淀粉粒为球形,体积较小,蛋白体填充在淀粉粒间隙。本研究中未蒸煮小米淀粉也包括B 型和C 型(图1a)两类淀粉粒。此外,赵学伟等[3]报道小米中蛋白大多以蛋白体结构存在,少部分为基质蛋白形式,这与本研究结果一致。蒸煮处理后,小米粉中淀粉颗粒遭到破坏(图1b,左)。进一步放大可以看到视野内大部分小米淀粉呈不规则形状,彼此黏连,少部分淀粉呈融化状交联(图1b,右)。蒸煮后小米中淀粉颗的结构变化是由糊化引起的[12]。本研究中,小米淀粉糊化后呈现不同形态,这可能是因为制备小米熟粉过程中粉碎处理破坏了绝大部分淀粉糊化后形成的交联形态。此外,蒸煮后小米蛋白被糊化淀粉所包围(图1b,右),不易观察。总的来说,通过蒸煮可以实现小米粉的熟化。

图1 蒸煮前、后小米粉的扫描电镜图Fig.1 Scanning electron micrograph of foxtail millet before and after cooking
2.2 蒸煮前、后小米的热特性变化
为了进一步判断小米是否完全糊化,采用DSC 测定蒸煮前、后小米的热特性。如图2a所示,未蒸煮小米粉的糊化起始温度(T0)为68.01℃,峰值温度(Td)为72.21 ℃,糊化过程中热焓值(ΔH)为1.03 J/g。而蒸煮后小米粉的DSC 曲线十分平滑,表明小米中淀粉完全糊化,在DSC 的升温过程中不再糊化、吸热放能(图2b)。
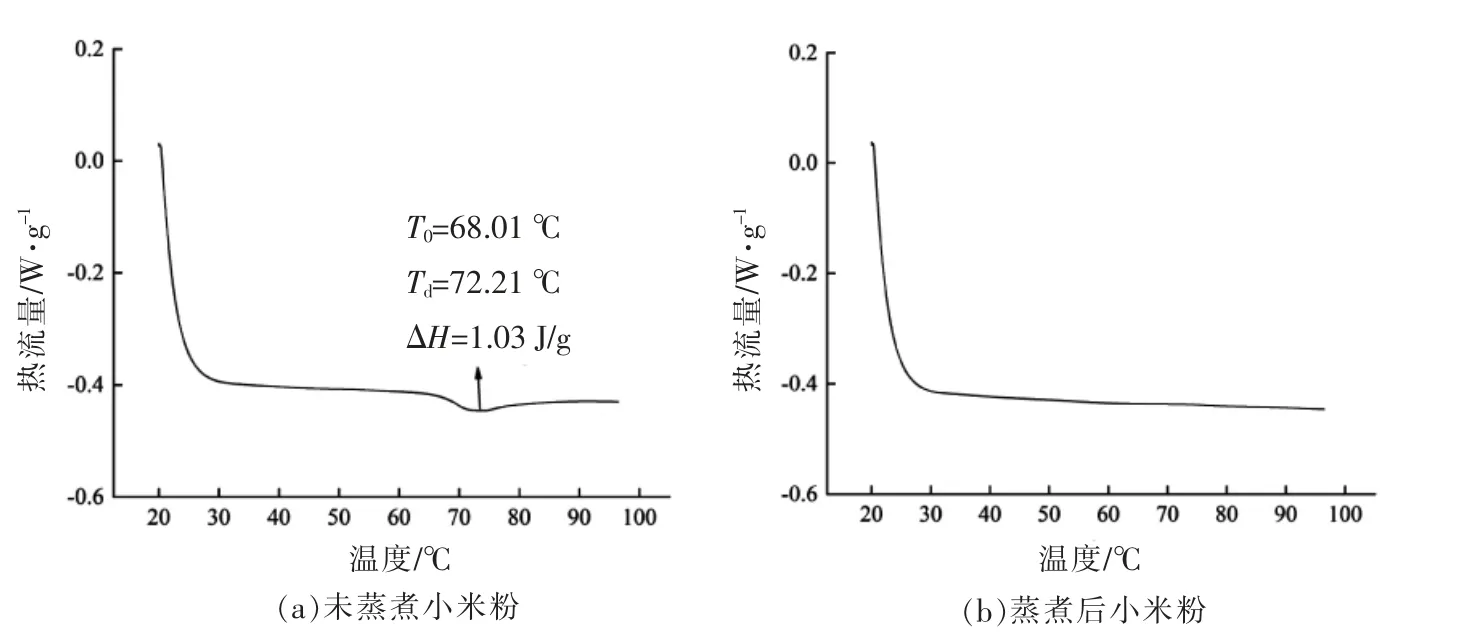
图2 蒸煮前、后小米的DSC 曲线图Fig.2 DSC curves of foxtail millet before and after cooking
2.3 蒸煮前、后小米中醇溶蛋白的微观结构变化
如下图所示,图3a 和b 为未蒸煮小米中醇溶蛋白的电镜图,图3c 和d 为蒸煮后小米中醇溶蛋白的电镜图。如图3a所示,未蒸煮小米中的醇溶蛋白为大小不一的球形,进一步放大可以看到醇溶蛋白彼此间有序排列,少部分彼此黏连在一起(图3b,红色圆圈)。郭莲东等[13]报道小米中醇溶蛋白以颗粒形状存在。对小米进行蒸煮处理后,小米中醇溶蛋白发生聚集(图3c,红色圆圈)。在放大倍数10 000 倍下,部分醇溶蛋白形状发生变化,趋于无规则,并且许多蛋白体粘连在一起形成大的蛋白聚合物(图3d,红色圆圈)。这种聚合可能是由二硫键或者疏水聚合物的形成所致,会引起蒸煮后小米中醇溶蛋白消化率降低。有研究表明小米中蛋白蒸煮后体外蛋白质消化率降低[14]。Duodu 等[15]认为蒸煮后谷物蛋白消化率的降低是由蛋白质间二硫键发生交联引起的,而Gulati等[16]证实引起黍米蛋白质消化率降低的原因是蛋白体间疏水聚合物的形成。在本研究中,引起醇溶蛋白聚合的作用力有待于进一步探讨。

图3 蒸煮前、后小米中醇溶蛋白的扫描电镜图Fig.3 Scanning electron micrograph of prolamin in foxtail millet flour before and after cooking
2.4 蒸煮前、后小米中醇溶蛋白的热特性变化
加热处理会破坏蛋白质分子间的相互作用力,引起共价和非共价以及疏水相互作用的分子聚集,进而诱导蛋白质变性[17]。DSC 可用于确定蒸煮前、后小米中的醇溶蛋白的热特性。如图4所示,未蒸煮小米中醇溶蛋白的起始变性温度(T0)为81.75 ℃,峰值变性温度(Td)为116.02 ℃,焓变(ΔH)为34.56 J/g。蒸煮后小米中醇溶蛋白的起始变性温度(T0)为84.14 ℃,峰值变性温度(Td)为119.7 ℃,焓变(ΔH)为31.87 J/g。相比未蒸煮小米中醇溶蛋白,蒸煮后小米中醇溶蛋白的起始和峰值变性温度增加,焓变值降低。变性温度增加表明蒸煮后小米中醇溶蛋白结构趋于稳定,不易发生变性。此外,焓变值依赖于蛋白质变性过程中的放热过程,包括蛋白质聚集和二硫键断裂[18]。如2.3节中蒸煮前、后小米中醇溶蛋白电镜图所示,蒸煮后小米中醇溶蛋白体间发生交联,结构趋于无序紧密,而这种交联表明蛋白中有疏水聚集体和二硫键的形成。在DSC 的升温过程中难以继续形成蛋白质聚集体或发生二硫键断裂,这也是其变性过程中焓变值较低的原因。
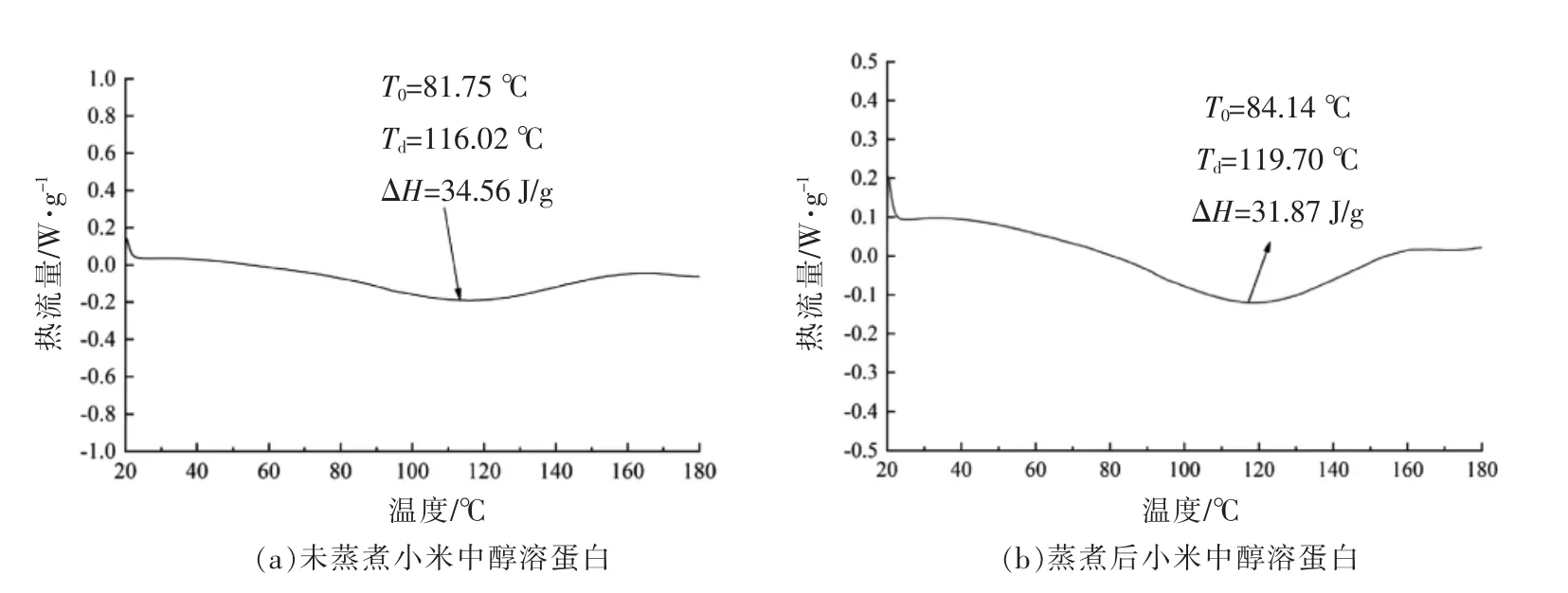
图4 蒸煮前、后小米中醇溶蛋白的DSC 曲线图Fig.4 DSC curves of prolamin in foxtail millet before and after cooking
2.5 蒸煮前、后小米中醇溶蛋白的氨基酸组成变化
小米蛋白富含谷氨酸、亮氨酸、丙氨酸、天冬氨酸和赖氨酸[19]。如表1所示,蒸煮后小米中醇溶蛋白的氨基酸含量较未蒸煮小米中醇溶蛋白均明显增加。Mohapatra 等[9]报道沸腾处理显著增加了高粱的氨基酸含量,降低了赖氨酸含量。这是因为赖氨酸被证明不能抵抗高温[20]。赖氨酸是许多谷物蛋白的限制性氨基酸,小米蛋白质中赖氨酸含量较其它谷物较高,可能有较好的营养价值[21-22]。本研究中,蒸煮后小米中醇溶蛋白赖氨酸含量极显著高于未蒸煮小米的(P<0.001)。造成上述差异的原因可能是本研究采用的蒸煮时间为10 min,而上述研究中高粱的加热时间为35 min,加热时间的不同对氨基酸含量造成不同的影响。Msarah等[23]发现,与生的鸡蛋蛋白相比,半熟的鸡蛋蛋白中氨基酸含量增加,而当鸡蛋蛋白达到全熟时,氨基酸含量较生的鸡蛋蛋白降低,这也表明适当的加工时间可最大程度地保留食品的营养价值。上述研究选取高粱为研究对象测定高粱中蛋白的氨基酸含量变化,沸腾处理过程中赖氨酸与高粱中的还原糖发生美拉德反应导致含量下降[24]。若选取蒸煮后小米为研究对象测定赖氨酸含量变化可能也得到下降的结果。本研究直接选取从蒸煮前、后小米中提取得到的醇溶蛋白为研究对象。在蒸煮小米过程中,其蛋白质中分子作用力被破坏,疏水基团暴露和疏水聚合体数量增加引起蛋白质溶解度下降,使得提取醇溶蛋白过程中因蛋白部分溶于水而使蛋白损失减少,得到的醇溶蛋白含量可能高于未蒸煮小米中醇溶蛋白,因此蒸煮后小米中醇溶蛋白在氨基酸测定的前处理步骤即酸水解步骤中,可能释放出更多游离氨基酸,包括赖氨酸。此外,蒸煮后小米醇溶蛋白中的蛋氨酸含量也极显著增加(P<0.01)。蛋氨酸已被证实有许多生理功能。蛋氨酸属含硫氨基酸的一种,L-半胱氨酸和L-蛋氨酸可以抑制星状细胞的活化并抑制肝纤维化的恶化[25]。蛋氨酸和半胱氨酸的抗氧化特性可能有助于抑制肝损伤小鼠或大鼠的脂质氧化[26]。
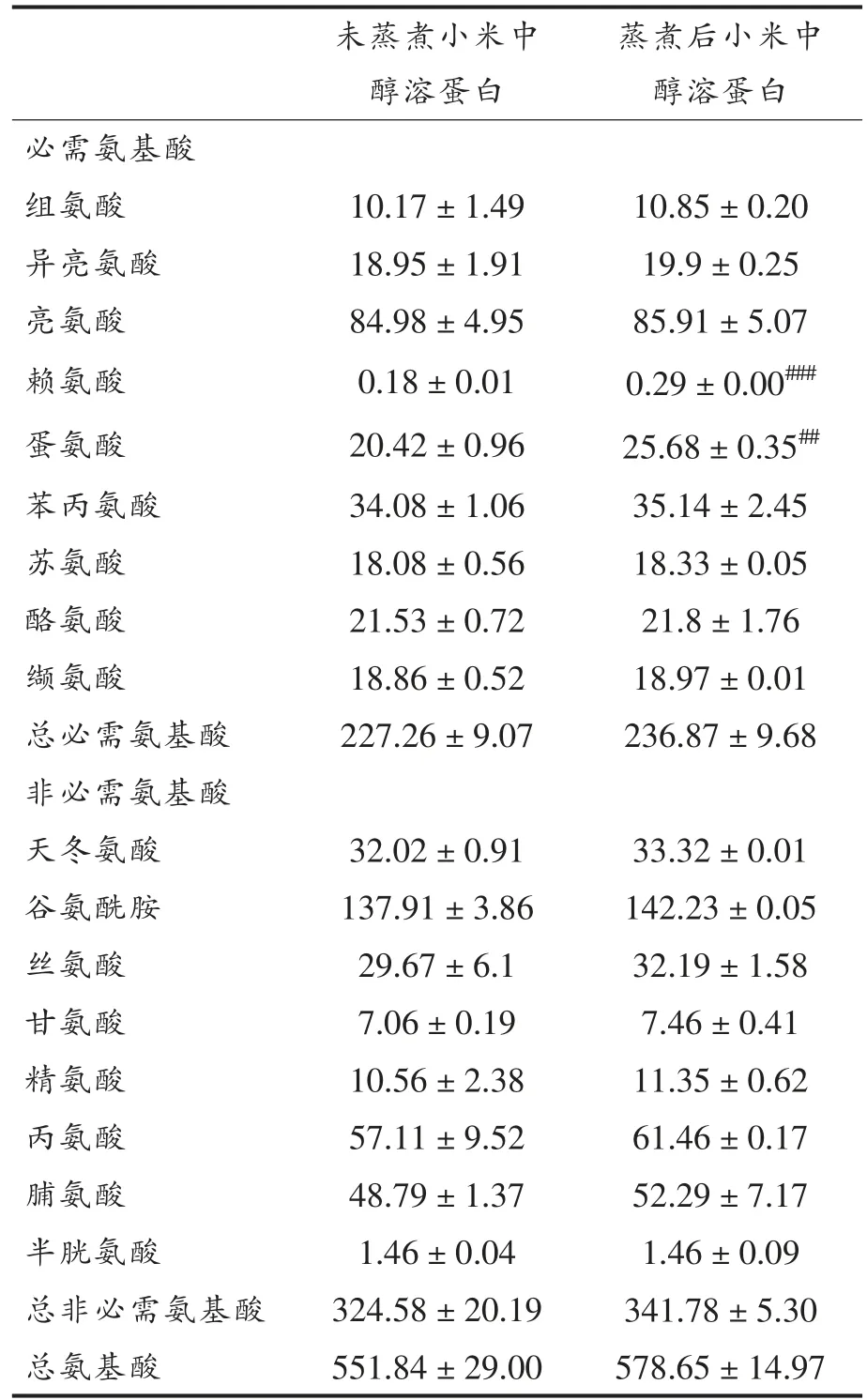
表1 蒸煮前、后小米中醇溶蛋白的氨基酸组成(mg/g 蛋白)Table 1 Amino acid composition of prolamin in foxtail millet before and after cooking(mg/g protein)
2.6 蒸煮前、后小米中醇溶蛋白的二级结构
利用FTIR 分析蒸煮前、后小米中醇溶蛋白的二级结构。通过对FTIR 获得的二级结构图谱去卷积、二阶求导、曲线拟合等,可获得蛋白质酰胺Ⅰ带(1 700~1 600 cm-1)中的信息,包括蛋白质的α螺旋(1 658~1 650 cm-1)、β 折叠(1 640~1 610 cm-1)、β转角(1 700~1 660 cm-1)、无规卷曲(1 650~1 640 cm-1)结构[27]。两种醇溶蛋白的FTIR 图谱见图5,可以看到二者的红外图谱有明显区别。进一步分析未蒸煮小米中醇溶蛋白中酰胺Ⅰ带发现,二级结构中以β 螺旋和转角为主,高达70%左右,其次为α 螺旋和无规卷曲,占比为13%~14%。郭莲东等[13]研究发现小米醇溶蛋白中主要二级结构为β-折叠,β-转角以及β-反平行折叠,没有无规卷曲。这与本研究结果不同,这种差异可能是由于试验用的小米品种不同。蒸煮后,小米中醇溶蛋白二级结构发生变化,与未蒸煮小米中醇溶蛋白相比,α螺旋比例显著上升,β 折叠比例显著下降,也就是说β 折叠部分转变为α 螺旋。二级结构中,α 螺旋结构较为紧密[28],且Jin 等[29]认为β 折叠的增加会使得蛋白结构变得疏松。由此可以判断蒸煮后小米醇溶蛋白的结构趋于紧密。此外,Wang 等[30]研究发现加热处理会使大豆分离蛋白的β 折叠减少,α 螺旋结构增加。这是因为加热后大豆亚基蛋白展开,同时疏水基团暴露在极性环境中相互作用形成蛋白聚合体。由于β 折叠位于蛋白质内部,因此其比例因蛋白质的聚集而降低[31]。本研究中β折叠向α 螺旋转化,表明可能有疏水基团暴露进而引起蛋白聚合体的形成,这与Gulati 等[16]报道中加热引起粟米蛋白中形成疏水聚合物的结果相一致。
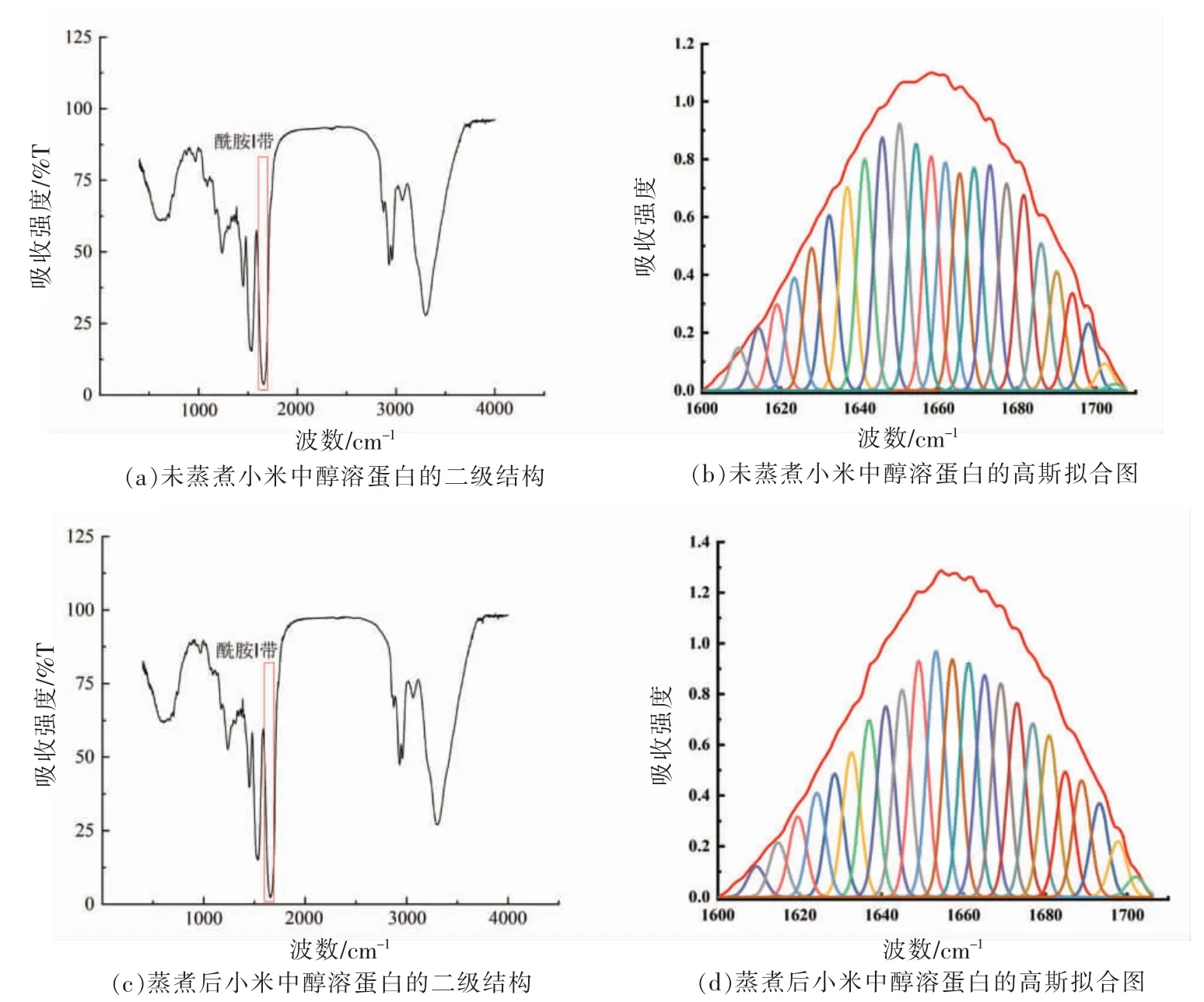
图5 蒸煮前、后小米中醇溶蛋白的二级结构和高斯拟合图Fig.5 Secondary structure and gauss fit diagrams of prolamin in foxtail millet before and after cooking

表2 蒸煮前、后小米中醇溶蛋白的二级结构组成(%)Table 2 The secondary structure composition of prolamin in foxtail millet before and after cooking(%)
2.7 蒸煮前、后小米中醇溶蛋白溶解度的变化
如图6所示,醇溶蛋白的溶解度随着pH 值的增加先下降后上升,在pH=6 时,蛋白溶解度最低,表明pH=6 为醇溶蛋白的等电点。进一步分析蒸煮前、后小米中醇溶蛋白的溶解度可知,在pH 2~7 范围,蒸煮后小米中醇溶蛋白溶解度始终显著低于未蒸煮小米中醇溶蛋白的(P<0.05),然而在pH=8 时,蒸煮后小米中醇溶蛋白溶解度高于未蒸煮小米中醇溶蛋白的。pH 增至9 时,二者间的溶解度没有区别。这可能是因为未蒸煮小米中醇溶蛋白结构较为松散,对强碱的敏感性高于蒸煮后小米中的醇溶蛋白,蛋白质中有较多被破坏的疏水基团,使其溶解度显著下降,甚至低于蒸煮后小米中醇溶蛋白。pH=9 时,二者结构均被彻底破坏,疏水基团完全暴露,因此溶解度无明显差异。整体而言,蒸煮后小米中醇溶蛋白溶解度下降。溶解度的变化也进一步证实2.5 节中蒸煮后小米中氨基酸含量的增加与蛋白溶解度下降的关系,而2.6 节中对蛋白质二级结构的研究表明蒸煮后小米醇溶蛋白的结构变化可能是由疏水聚合体形成所致,这与其溶解度因疏水基团增加而下降的结果一致。

图6 蒸煮前、后小米中醇溶蛋白的溶解度Fig.6 The solubility of prolamin in foxtail millet before and after cooking
3 结论
通过扫描电镜、DSC、氨基酸组成、FTIR 及溶解度对蒸煮前、后小米中醇溶蛋白进行结构分析。从扫描电镜观察小米中醇溶蛋白为球形,蒸煮后小米中醇溶蛋白彼此间交联,形状发生变化。DSC分析发现蒸煮后小米中醇溶蛋白的变性温度增加,热焓值下降,表明蛋白结构可能变得致密,较难变性。此外,对比二者氨基酸组成发现蒸煮后小米醇溶蛋白中氨基酸含量均增加,这可能是由其较低的溶解度所致。蒸煮后小米中醇溶蛋白的二级结构中部分β 折叠转化为α 螺旋。醇溶蛋白作为小米中的贮藏蛋白,对小米的品质产生较大的影响。考虑到小米蒸煮后醇溶蛋白性质的改变可能影响其营养价值,在今后的研究中采用改性蛋白控制蒸煮后小米中醇溶蛋白的品质。
