原儿茶醛对福氏志贺菌的抑制作用
2021-12-17宋璐忆李佳辉郭嘉璐邓海潮
宋璐忆,李佳辉,王 硕,郭嘉璐,邓海潮,石 超
(西北农林科技大学食品科学与工程学院 陕西杨凌712100)
福氏志贺菌是一种棒状、无荚膜、非运动、兼性厌氧的食源性致病菌,具有多种流行病学和病理学特征[1]。它是一类具有高度危害性的微生物,人体感染试验表明,仅10 个福氏志贺菌即可引起成年人发病,食物和饮用水可以作为其传播媒介[2]。它可以引起细菌性痢疾,感染的症状通常是腹部绞痛、腹泻和发烧,有时伴随其它症状,如呕吐和头痛[3]。它是在全球范围引起腹泻的主要原因,每年导致约8 000 万~1.65 亿病例[4]。福氏志贺菌通常可从即食食品中分离,如蔬菜沙拉、冷切肉类、熏鱼、生牡蛎和海鲜等[5],其往往会通过受污染的食物、个人、人群、学校和餐馆快速传播[6]。
传统的食品杀菌技术虽然能保证食品微生物方面的安全,但是可能会影响食品的质构、色泽、风味和营养成分等。如热力杀菌可能会引起食品褐变、营养物质破坏、风味变化等热化学反应[7]。物理杀菌通常对设备要求较高,投入成本较大。而化学合成防腐剂的过量使用往往具有致癌性、致畸性以及残留毒性[8-9]。寻找高效、安全、天然的食品保鲜方法,抑制或清除食源性致病菌,延长食品的货架期,已成为食品工业的当务之急。一些植物源抑菌物质被证明具有良好的抑菌效果,且因具有绿色安全的优点而备受研究者的关注[10]。
原儿茶醛(Protocatechuicaldehyde,PC,C7H6O3)是一种从活血化瘀中药丹参、鼠尾草和四季青叶等中提取出的酚酸类化合物,结构式如图1所示[11]。原儿茶醛具有抗菌消炎、增强冠状动脉血流量、降血脂、抑制血小板聚集和清除自由基等生物活性[12-14]。有研究表明,原儿茶醛对食源性致病菌阪崎克罗诺肠杆菌具有良好的抑制作用[15],而对于植物病原菌青枯雷尔氏菌,原儿茶醛也表现出一定的抑菌活性,100 μg/mL 的原儿茶醛处理后,青枯雷尔氏菌菌体数量降低99.40%[16]。

图1 原儿茶醛的结构式Fig.1 Structural formula of protocatechualdehyde
原儿茶醛被证明对一些微生物具有抑制效果,然而,目前原儿茶醛对福氏志贺菌的抑制作用及机理鲜有研究。本文探究原儿茶醛对福氏志贺菌的最小抑菌浓度(Minimal inhibitory concentration,MIC)、最小杀菌浓度(Minimum bactericidal concentration,MBC)以及其对福氏志贺菌细胞形态、胞内ATP、膜电位、蛋白合成和破坏及生长曲线的影响,旨在探究原儿茶醛对福氏志贺菌的抑制作用。
1 材料与方法
1.1 菌株与试剂
原儿茶醛(HPLC≥98%)购于成都曼斯特生物科技有限公司,本研究使用的福氏志贺菌ATCC 12022 购自美国模式培养物集存库(American Type Culture Collection,ATCC)。该菌株混合于含有体积分数25%甘油的LB 肉汤中置于-80 ℃保存。LB 琼脂、LB 肉汤购于北京陆桥技术股份有限公司;细菌蛋白提取试剂盒购于上海贝博生物科技有限公司;试验所用其它试剂均为国产分析纯级。
1.2 仪器与设备
SPX-160B 细菌培养箱,上海南荣实验室设备有限公司;SmartSpecTMPlus 分光光度计,美国Bio-Rad 公司;微生物全自动生长曲线分析仪,芬兰Bioscreen 公司;S-4800 场发射扫描电子显微镜,日本Hitachi 公司;SCIENTZ-IID 超声波裂解仪,宁波新芝生物科技股份有限公司;ChemiDoc MP蛋白凝胶成像仪,美国Bio-Rad 公司;Victor X3多功能酶标仪,珀金埃尔默企业管理(上海)有限公司。
1.3 方法
1.3.1 菌种活化 将冻存于-80 ℃冰箱的福氏志贺菌ATCC 12022 菌株采用平板划线法于LB 琼脂培养基上活化培养18 h,然后挑取单菌落于LB肉汤中,37 ℃摇床培养18 h(130 r/min)。用磷酸盐缓冲盐溶液(Phosphate-buffered saline,PBS,pH 7.0)离心清洗菌株两次(8 000×g、4 ℃、5 min),随后用LB 肉汤调整菌悬液浓度使得菌悬液在600 nm 处的光密度(Optical density,OD)即OD600nm=0.5(约3×108CFU/mL),得到备用菌悬液。
1.3.2 最小抑菌浓度和最小杀菌浓度的测定 最小抑菌浓度和最小杀菌浓度的测定具体方法参照美国临床和实验室标准协会采用的肉汤微量稀释法[17],具体方法如下:菌液制备同1.3.1 节,首先使用PBS 洗涤菌体两次,用LB 肉汤重悬浮后调整菌悬液的OD600nm=0.5,将上述菌液用LB 肉汤稀释600 倍(使菌液浓度为5×105CFU/mL)。在96 孔酶标板中接种福氏志贺菌ATCC 12022 悬浮液,每孔100 μL。配制原儿茶醛溶液,将原儿茶醛溶解于体积分数1%的DMSO 水溶液中,利用等倍稀释法使原儿茶醛的质量浓度分别为4.0,2.0,1.0,0.5,0.25,0.125,0.0625 mg/mL,每孔100 μL 加入96 孔酶标板中,将原儿茶醛溶液与菌悬液吹打均匀于37 ℃培养24 h。以不含有原儿茶醛的菌悬液作为阴性对照,含有体积分数0.5% DMSO 的LB肉汤为阳性对照。测定培养前、后样品的OD600nm,若测定值相差小于0.05,则认为测试浓度能够抑制菌体生长,抑制菌体生长的原儿茶醛的最小浓度即为MIC。然后从能够抑制细菌生长的不同质量浓度的原儿茶醛孔中吸取100 μL 涂布于LB 琼脂平板上,置于37 ℃培养箱培养48 h 后观测培养皿中菌的生长状况,在LB 平板上无菌落生长的最小浓度定义为MBC。
1.3.3 原儿茶醛对福氏志贺菌ATCC 12022 生长曲线的影响 生长曲线的测定按照Guo 等[18]描述的方法。菌液制备同1.3.1 节,调整菌悬液的浓度为106CFU/mL。在百孔板中每孔接种125 μL 福氏志贺菌ATCC 12022 菌悬液,然后每孔加入等量的原儿茶醛溶液(溶解于含体积分数1% DMSO的LB 肉汤中),使最终原儿茶醛质量浓度为2×MIC、MIC、1/2×MIC、1/4×MIC、1/8×MIC 和0。以不添加原儿茶醛的菌悬液为对照组,并设置含有体积分数0.5% DMSO 的LB 肉汤作为背景空白对照组。样品放置在微生物全自动生长曲线分析仪中于37 ℃恒温培养24 h,每隔1 h 检测记录
OD600nm,用培养时间和OD600nm绘制生长曲线。
1.3.4 原儿茶醛对福氏志贺菌ATCC 12022 细胞形态的影响 场发射扫描电子显微镜对福氏志贺菌细胞形态的观测参照Lü 等[19]的方法,具体过程如下:首先按照1.3.1 节所述方法制备菌悬液,配制原儿茶醛溶液质量浓度为(0、2×MIC、4×MIC),菌悬液与原儿茶醛溶液混合后置于37 ℃培养箱中培养,分别在3 h 和6 h 取出样品。将菌液进行离心(5 000×g、4 ℃、5 min),用PBS 清洗菌体2次。随后用PBS 重悬浮,离心去上清液(5 000×g、4℃、5 min),加入体积分数2.5%戊二醛于4 ℃初步固定12 h。用PBS 和无菌水先后清洗菌体一次,置于体积分数1%锇酸中再次固定8 h。使用30%,50%,70%,80%,90%和100%体积分数的乙醇梯度洗脱菌体,10 min/次。最后吸取5 μL 样品于洁净的玻片上并晾干,玻片在真空状态下进行镀金处理,在场发射扫描电子显微镜下观测细菌细胞形态并拍照。
1.3.5 原儿茶醛对福氏志贺菌ATCC 12022 胞内ATP 浓度的影响 菌液制备同1.3.1 节,用LB 肉汤调整菌悬液浓度使OD600nm=0.5,用不同质量浓度(0、2×MIC、4×MIC)的原儿茶醛处理菌体,空白对照组与菌悬液等体积的PBS 溶液,所有样品于37 ℃恒温培养30 min。随后在冰上用超声波破碎细菌样品以提取胞内ATP,超声时每个样品超声7 min,工作3 s,间隔6 s,探头位于样品液面下0.7 cm。每轮超声结束后立即将样品置于100 ℃下处理2 min 灭活样品中的ATP 酶,处理后将样品立即置于冰上。随后离心取上清液(8 000×g、4 ℃、5 min),使用ATP 检测试剂盒测定胞内ATP,分别添加125 μL ATP 检测工作液及样品上清液于96孔白色酶标板中,使用多功能酶标仪检测样品荧光强度。将ATP 标准溶液稀释为0.01,0.10,1.00,10.00 μmol/L,用ATP 标准溶液浓度和对应的荧光强度值构建标准曲线并计算细胞内ATP 浓度。
1.3.6 原儿茶醛对福氏志贺菌ATCC 12022 膜电位的影响 原儿茶醛对福氏志贺菌膜电位的影响参照Shi 等[20]的方法测定,菌液制备同1.3.1 节,使用PBS 清洗菌体两次并用PBS 重悬浮使OD600nm=0.5。向96 孔黑色酶标板中加入125 μL 菌悬液,所有样品于37 ℃恒温培养40 min。随后向每孔中加入1 μL 浓度为1 μmol/L 细胞膜电位荧光探针DiBAC4(3),37 ℃孵育30 min。加入不同质量浓度的原儿茶醛【0(对照组)、2×MIC、4×MIC】处理5 min,随后使用多功能酶标仪检测激发波长/发射波长为492 m/515 nm 下的荧光强度。其中背景对照组为不含有菌悬液的原儿茶醛(0、2×MIC 和4×MIC)溶液,通过计算处理组检测所得荧光强度与背景对照组检测所得荧光强度的差值,得到原儿茶醛作用组的相对荧光强度,细菌膜电位以相对荧光强度表示。
1.3.7 原儿茶醛对福氏志贺菌ATCC 12022 菌体蛋白的影响 原儿茶醛对福氏志贺菌胞内可溶性蛋白的影响按照Wang 等[21]的方法测定,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate -polyacrylamide gel electrophoresis,SDS-PAGE)分析。按照1.3.1 节所述方法制备菌悬液,用原儿茶醛溶液【0(对照组)、2×MIC 和4×MIC】处理福氏志贺菌,将样品置于37 ℃培养箱中培养12 h,用PBS(8 000×g、4 ℃、5 min)进行离心清洗,收集上清液。随后制备裂解液(2 mL 蛋白提取液,8 μL 蛋白酶抑制剂,20 μL 蛋白稳定剂)与样品充分混匀后置于冰上振荡30 min,再将样品于室温持续振荡至澄清。利用BCA 试剂盒测定蛋白样品浓度,并调整所有样品的蛋白浓度为一致,加入上样缓冲液 【25 μL 100 mmol/L pH 6.8 的Tris-HCl,体积分数10%十二烷基硫酸钠(Sodium dodecyl sulfate,SDS),体积分数0.5%溴酚蓝,体积分数50%甘油,200 mmol/L 二硫苏糖醇(Dithiothreitol,DTT)】,100 ℃加热5 min 后冰封,进行SDS-PAGE 分析。电泳后,用考马斯亮蓝R-250 对蛋白条带进行染色,最后脱色得到分离的蛋白条带。
1.4 数据处理分析
所有数据均以平均值±标准差的形式表示(n=3),利用IBM SPSS 软件(version 19.0;SPSS,Inc.,Chicago,IL)处理数据,采用t检验进行分析。若P<0.05 认为样本存在显著差异,P<0.01 则认为样本存在极显著差异。所有试验均独立进行,重复3 次。
2 结果与分析
2.1 原儿茶醛对福氏志贺菌的MIC 和MBC
本文通过测定MIC 和MBC 反映原儿茶醛对福氏志贺菌的抑菌和杀菌活性。由表1 可知,当原儿茶醛质量浓度为0.25 mg/mL 及以下时,样品培养前后的OD600nm数值变化大于0.05,当原儿茶醛质量浓度为0.5 mg/mL 及以上时,培养前后样品的OD600nm测定值相差小于0.05。由于样品培养前与培养24 h 后的OD600nm测定值相差小于0.05 则可认为该测试浓度能够抑制菌体生长,因此原儿茶醛对福氏志贺菌ATCC 12022 的MIC 为0.5 mg/mL。

表1 不同质量浓度原儿茶醛处理前、后的福氏志贺菌ATCC 12022 菌悬液的OD600nm 数值变化Table 1 Changes of OD600nm values in bacterium suspension with different mass concentrations of protocatechualdehyde before and after against Shigella flexneri ATCC 12022
图2 为不同质量浓度的原儿茶醛处理后的福氏志贺菌菌落生长情况,当原儿茶醛质量浓度为8.0 mg/mL 和4.0 mg/mL 时,LB 培养基上无菌落生长(图2a 和b),表现出原儿茶醛的杀菌作用。当原儿茶醛质量浓度为2.0 mg/mL 时,LB 培养基上出现菌落生长(图2c),且随着原儿茶醛质量浓度的减小,菌落数量逐渐增加。根据MBC 的判定原则(1.3.2 节中的描述),原儿茶醛对福氏志贺菌ATCC 12022 的MBC 为4.0 mg/mL。
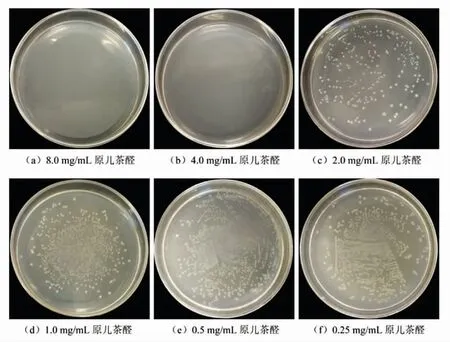
图2 不同质量浓度原儿茶醛处理后福氏志贺菌ATCC 12022 的菌落分布Fig.2 Colony distribution of Shigella flexneri ATCC 12022 after treatment with different mass concentrations of protocatechualdehyde
2.2 原儿茶醛对福氏志贺菌生长曲线的影响
试验测定了质量浓度2×MIC~1/8×MIC 的原儿茶醛对福氏志贺菌生长曲线的影响。从图3 可以看出,质量浓度为2×MIC 和MIC 的原儿茶醛完全抑制了福氏志贺菌的生长。此外,与对照组相比,当原儿茶醛质量浓度为1/2×MIC、1/4×MIC 和1/8×MIC 时,福氏志贺菌的最大生长量有所下降。并且随着原儿茶醛质量浓度的减小,细菌生长延滞期减小。
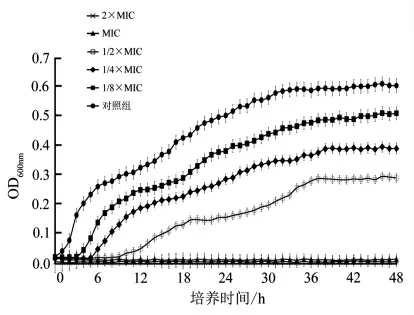
图3 原儿茶醛对福氏志贺菌ATCC 12022生长曲线的影响Fig.3 Effects of protocatechualdehyde on growth curve of Shigella flexneri ATCC 12022
2.3 原儿茶醛对福氏志贺菌细胞形态的影响
原儿茶醛对福氏志贺菌细胞形态的影响如图4所示,未经原儿茶醛处理的福氏志贺菌细胞完整,菌体呈短杆状,形态饱满,表面光滑(图4a 和d),经原儿茶醛处理后(图4b、4c、4e、4f),福氏志贺菌表面粗糙,细胞皱缩。随着原儿茶醛质量浓度和孵育时间的增加,细胞受损程度增大。经4×MIC的原儿茶醛处理6 h 后(图4f),福氏志贺菌菌体出现大面积塌陷,丧失了其固有形态。
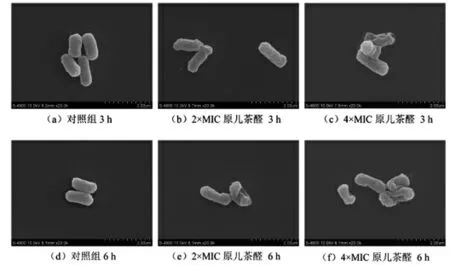
图4 场发射扫描电子显微镜观测原儿茶醛对福氏志贺菌ATCC 12022 细胞形态的影响(20 000×)Fig.4 Effects of protocatechuic aldehyde on the morphology of Shigella flexneri ATCC 12022 cells observed by field emission scanning electron microscope(20 000×)
2.4 原儿茶醛对福氏志贺菌胞内ATP 的影响
试验利用萤火虫荧光素酶检测原儿茶醛对福氏志贺菌胞内ATP 的影响。试验结果表明,ATP标准溶液浓度(x)与相对荧光强度(y)具有良好的线性关系(y=91376x+7171.4,R2=0.9999),因此,可以根据ATP 的标准曲线计算各组样品中胞内ATP 的浓度。如图5所示,不经原儿茶醛处理的对照组胞内ATP 浓度为(1.66±0.02)μmol/L,经2×MIC 质量浓度的原儿茶醛处理的细菌胞内ATP浓度为(0.25±0.02)μmol/L,而经4×MIC 质量浓度的原儿茶醛处理的细菌胞内ATP 浓度为(0.13±0.01)μmol/L。数据分析可知,原儿茶醛对福氏志贺菌胞内ATP 浓度具有极显著的降低作用(P<0.01)。而对比2×MIC 和4×MIC 浓度的原儿茶醛处理,细菌胞内ATP 浓度之间无显著差异(P≥0.05)。
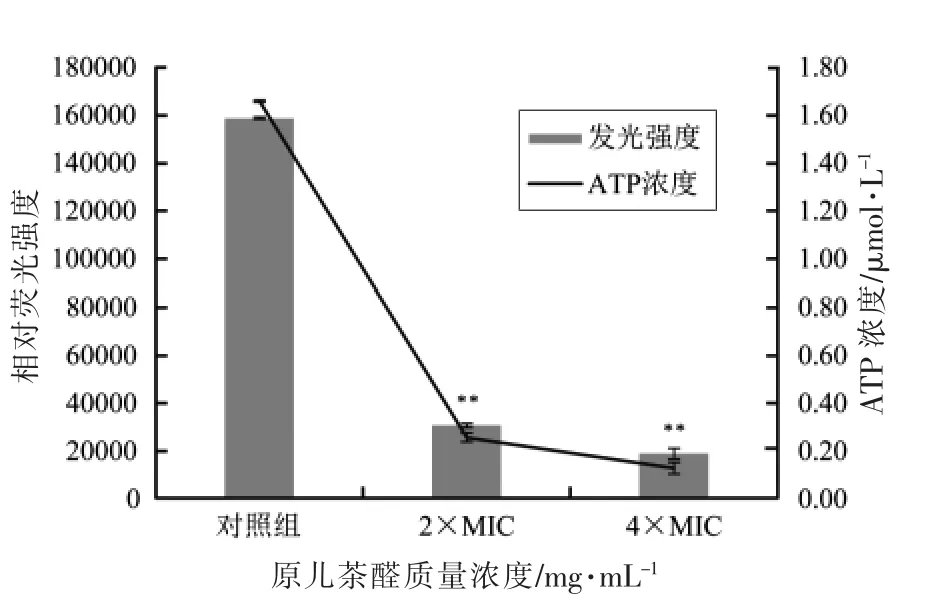
图5 原儿茶醛对福氏志贺菌ATCC 12022胞内ATP 的影响Fig.5 Effects of protocatechualdehyde on intracellular ATP production by Shigella flexneri ATCC 12022
2.5 原儿茶醛对福氏志贺菌膜电位的影响
试验通过检测DiBAC4(3)荧光染料与细菌胞浆内蛋白结合后发出的荧光强度,来指示细胞膜电位的变化。试验结果表明,原儿茶醛处理后,福氏志贺菌细菌膜电位相比于对照组有极显著的差异(P<0.01)。如图6所示,与对照组相比,经过原儿茶醛处理的福氏志贺菌细胞显示出荧光强度降低,表示细菌细胞膜电位出现超极化现象,且经质量浓度为4×MIC 原儿茶醛处理比质量浓度为2×MIC 原儿茶醛处理后的变化现象更加明显。
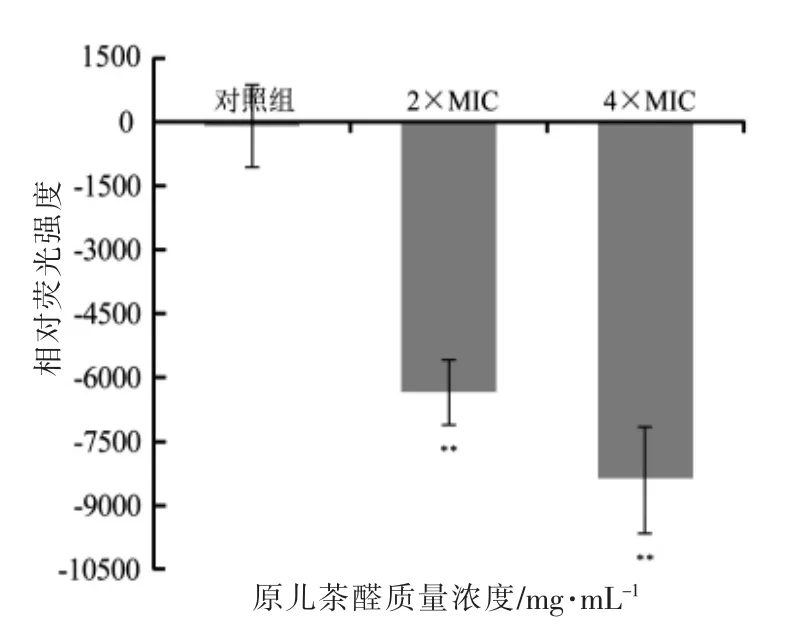
图6 原儿茶醛对福氏志贺菌ATCC 12022细胞膜电位的影响Fig.6 Effects of protocatechualdehyde on the membrane potentials of Shigella flexneri ATCC 12022
2.6 原儿茶醛对福氏志贺菌菌体蛋白的影响
原儿茶醛对福氏志贺菌菌体蛋白的影响如图7所示。未经处理的福氏志贺菌细胞有清晰度较高的蛋白条带。与对照组相比,2×MIC 和4×MIC质量浓度的原儿茶醛处理后的细菌细胞的蛋白条带清晰度明显减弱,且质量浓度为4×MIC 原儿茶醛处理后的变化现象比2×MIC 明显。

图7 SDS-PAGE 分析原儿茶醛对福氏志贺菌ATCC 12022 菌体蛋白的影响Fig.7 SDS-PAGE analysis of the effect of protocatechualdehyde on intracellular proteins of Shigella flexneri ATCC 12022
3 讨论
植物源活性物质是从植物中提取的有效活性成分。近年来,一些食源性致病菌已被证明可利用植物源活性物质进行抑制和杀灭,如沙门氏菌、金黄色葡萄球菌、李斯特菌、副溶血性弧菌和铜绿假单胞菌等[22-23],这为食源性致病菌的控制提供了新的方法。福氏志贺菌作为一种重要的食源性致病菌,是引起人类腹泻的重要原因之一,具有高度传染性并且严重危害人类的健康和生命安全[24]。目前,天然植物源活性物质对福氏志贺菌的抑杀作用及机理研究报道较少。本文旨在探究原儿茶醛对福氏志贺菌的抑制作用及可能的机理。
本试验结果表明原儿茶醛对福氏志贺菌ATCC 12022 有良好的抑杀作用,其MIC 为0.5 mg/mL,MBC 为4.0 mg/mL。前期一些研究也探究了部分天然化合物对福氏志贺菌的抑杀作用,Kang 等[25]通过肉汤稀释法测定了没食子酸对福氏志贺菌的MIC 为2.0 mg/mL,MBC 为8.0 mg/mL。Chan 等[26]证明了巴丹桂皮、中国肉桂和牛至提取物对福氏志贺菌具有一定的抑菌效果,且MIC 都大于2.5 mg/mL。Oh 等[27]发现绿茶提取物对福氏志贺菌有抗菌作用,其MIC 为10.0 mg/mL。对比于以上已报道的对福氏志贺菌有抑菌效果的物质,原儿茶醛对福氏志贺菌具有良好的抑杀效果。
本研究利用场发射扫描电镜观测了原儿茶醛对福氏志贺菌细胞形态的影响,发现原儿茶醛可使福氏志贺菌表面干瘪皱缩,但没有造成细胞表面出现孔洞以及细胞破碎(图4)。Shi 等[15]发现质量浓度为4×MIC 原儿茶醛作用于阪崎克罗诺杆菌后,菌体表面粗糙凹陷,且受损程度和数量随原儿茶醛质量浓度的增加而增大。Becerril 等[28]观测发现月桂酰精氨酸乙酯处理5 min 时大肠杆菌细胞外观发生不规则改变,表面有明显的孔隙形成,菌体严重皱缩并出现破裂的细菌。本研究未发现福氏志贺菌表面破裂,推测细胞形态改变是由于原儿茶醛处理后菌体细胞膜透性增强,从而使内容物流出,使细胞形态发生变化。
原儿茶醛可以极显著降低(P<0.01)福氏志贺氏菌ATCC 12022 细胞内ATP 的浓度,且呈质量浓度依赖性(图5)。Peng 等[29]发现与对照组相比,经质量浓度为MIC 和2×MIC 橄榄油多酚提取物处理细菌2 h 后,细菌胞内ATP 浓度显著降低(P<0.05),推测可能是细菌细胞膜完整性受到破坏以及驱动ATP 合成的质子动力势的消耗导致胞内ATP 丢失。Burt 等[30]报道了香芹酚作用于蜡样芽孢杆菌细胞后,细菌胞内ATP 浓度下降,而细胞外ATP 浓度没有相应增加,认为可能是由于ATP水解速率增加造成的。同样的,Paul 等[31]研究了MIC 质量浓度的沙棘果精油处理枯草芽孢杆菌ATCC 6633 30 min 后,细胞外ATP 浓度显著增加(P<0.05),并观察到细菌的膜结构被精油破坏,表明这种现象是由于精油引起的细胞膜损伤或者细胞膜通透性增加所致。在本研究中,胞内ATP 浓度的降低可能是由于原儿茶醛增加了福氏志贺菌自身ATP 水解的速度,另一方面可能是由于原儿茶醛使细胞膜的通透性增强,使得细胞内ATP 流出,此原因与场发射扫描电镜试验中推测原因相同。
膜电位在细胞对抗生素的吸收和杀菌过程中起着重要的作用,膜电位的变化与细胞的通透性有关[32]。本研究发现,与对照组相比,经原儿茶醛处理后的细菌细胞膜电位降低,即引起细胞膜超极化。Zhang 等[33]用罗丹明123 荧光染料测定膜电位的变化,发现与对照相比,经0.5×MIC~2×MIC质量浓度的香附香精油处理的金黄色葡萄球菌细胞荧光强度显著降低(P<0.05),即精油作用后的金黄色葡萄球菌细胞膜呈现超极化。Cho 等[34]研究表明野山药中提取的薯蓣皂苷对白色念珠菌膜电位呈现去极化作用,推测荧光强度的增加可能是由于细胞膜受损,导致膜电位发生去极化所致。Bot 等[32]发现细胞膜电位发生超极化或去极化是由于抑菌物质影响了细菌细胞膜上离子的运动,特别是K+,从而影响胞体的自动调节,使得菌体细胞膜电位出现极化现象。
蛋白质是生物合成的基础,在细菌细胞的生命活动中起着至关重要的作用。Wang 等[21]利用SDS-PAGE 研究了乳酸对沙门氏菌、大肠杆菌、单核增生李斯特菌等可溶性蛋白的影响,发现乳酸能够通过破坏或抑制细菌蛋白质合成导致细菌死亡。Chen 等[35]报道称金黄色葡萄球菌、单核增生李斯特菌、大肠杆菌和鼠伤寒沙门氏菌经甜菜糖蜜多酚处理后蛋白质含量明显降低。本试验利用SDS-PAGE 分析发现原儿茶醛能够破坏福氏志贺菌的蛋白质或抑制蛋白质的合成,进而干扰细菌的能量代谢。
4 结论
综上所述,本研究结果表明原儿茶醛对福氏志贺菌具有较好的抑制作用,其通过降低细菌胞内ATP 浓度,作用于细胞膜改变细胞膜电位使其出现超极化现象,影响菌体形态使细胞表面干瘪皱缩,破坏蛋白质或抑制蛋白质合成,导致细菌正常的生理功能紊乱从而达到抑菌效果。研究结果为原儿茶醛作为一种有潜力的、天然安全的抑菌物质提供了理论依据。然而,原儿茶醛对福氏志贺菌的其它抑菌作用机制以及其在食品生产加工中的应用方式需要在实际应用前进一步探讨。
