水溶性壳聚糖对3种微生物的抑制作用差异
2021-12-17王向阳卢进彬
王向阳,卢进彬,潘 炎,顾 双
(浙江工商大学食品与生物工程学院 杭州310018)
壳聚糖作为天然防腐剂,能够有效抑制多种细菌、真菌的生长和繁殖,被广泛用于食品抑菌、果蔬防腐保鲜等方面。Qiu 等[1]报道2.5 mg/L 高分子壳聚糖和5.0 mg/L 低分子壳聚糖处理绿芦笋后可延长绿芦笋采后保鲜期。Sun 等[2]的研究表明水溶性壳聚糖和磺基壳聚糖抑制大肠杆菌的作用较强,抑制金黄葡萄球菌的作用较弱,抑制灰葡萄孢的作用较强,抑制甘蔗节菱孢的作用较弱。Jia 等[3]的研究表明纳米银粒子壳聚糖对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、霍乱沙门氏菌、葡萄球菌和灰葡萄孢有很强的抑制作用。Sun 等[2]发现水溶性壳聚糖和磺基壳聚糖对甘蔗节菱孢菌丝的结构有破坏作用。Jia 等[4]发现吡啶壳聚糖对灰葡萄孢菌丝结构有损伤和变形作用,从而抑制菌株的生长。李小芳等[5]研究发现壳聚糖处理后,金黄色葡萄球菌的细胞壁、细胞膜发生渗漏,带有荧光的壳聚糖前期没有进入菌体细胞,后期细菌细胞出现破裂。Tsai 等[6]发现壳聚糖使大肠杆菌体内的葡萄糖脱氢酶和乳酸脱氢酶外漏,认为壳聚糖和细菌表面的负电荷组分结合,增加菌体细胞膜通透性。Sebti 等[7]认为壳聚糖能进入细胞,与胞内带负电组分(蛋白质和核酸)结合,抑制细菌的生长。谢勇等[8]在透射电镜下观察经壳聚糖处理的幽门螺杆菌,发现幽门螺杆菌的细胞壁变薄和不完整,其胞质内容物稀松等现象,认为壳聚糖能破坏细菌外膜结构、功能和通透性,扰乱菌体代谢。郑连英等[9]认为对革兰氏阴性菌而言,壳聚糖分子质量越小,抑菌效果越好;而对革兰氏阳性菌而言,壳聚糖分子质量越大,抗菌效果越明显。壳聚糖是否进入微生物细胞,目前还没有一个统一的研究结论。这可能与壳聚糖分子质量、衍生物基团、微生物种类的不同有关。壳聚糖处理会引起细胞壁、细胞膜渗漏,然而渗漏程度与生长抑制或死亡的关系还不清楚。本文选用革兰氏阳性菌(G+)植物乳杆菌和革兰氏阴性菌(G-)大肠杆菌以及真菌葡萄酒酵母作为试验菌种,考察水溶性壳聚糖对它们的抑菌效果,并通过测定电导率和OD260nm考察其变化与菌体抑制或死亡的关系。测定膜上的脱氢酶和细胞质的β-半乳糖苷酶,考察壳聚糖是否进入细胞,从而分析不同菌的抑菌机理。
1 材料与方法
1.1 材料及仪器
1)材料 乳酸菌(Lactobacillus plantarum),大肠杆菌(Escherichia coli)均为实验室保藏菌种。葡萄酒酵母(Saccharomyces ellipsoideus),购于安琪酵母股份有限公司。
2)培养基 乳酸菌采用MRS 肉汤培养基和MRS 琼脂培养基,大肠杆菌采用营养肉汤培养基(NB)和营养琼脂培养基(NA),酵母菌采用麦芽汁培养基和马铃薯葡萄糖琼脂培养基(PDA),培养基购于杭州百思生物技术公司。
3)试剂 水溶性壳聚糖(壳聚糖盐酸盐,脱乙酰度96.1%,黏度20 mPa·s),购自青岛弘海生物技术有限公司;葡萄糖、NaCl、氯化三苯基四氮唑(TTC)、Tris-HCl、Na2S、甲醛、丙酮、石油醚、磷酸氢二钠、磷酸二氢钠,购自杭州禾德化工有限公司(分析纯级)。
4)主要仪器 TGL-16M 高速冷冻离心机,湘仪离心机仪器有限公司;DDS-11A 电导仪,上海精科公司;UV-2550 紫外-可见分光光度计,岛津公司。
1.2 菌的制备
采用MRS 琼脂培养基和营养琼脂培养基于37 ℃、湿度20%条件下分别培养乳酸菌和大肠杆菌24 h。连续活化2 代。1 g 酵母于30 ℃、4%葡萄糖溶液中活化30 min 后用麦芽汁培养基于30℃、150 r/min 条件下恒温培养18 h,然后用PDA培养基于30 ℃、湿度20%条件下培养48 h。
将活化后的菌,用稀释平板计数法计数(见GB 4789 3-2010 《食品安全国家标准 食品微生物学检验大肠菌群计数》),制成含菌数106CFU/mL 左右的菌悬液[10]。
1.3 最小抑菌浓度(MIC)的测定[11]
采用菌落平板计数法测定最小抑菌浓度(MIC)。MRS 琼脂培养基包含0.05,0.1,0.2,0.4,0.8 mg/L 壳聚糖;营养琼脂培养基包含0.25,0.5,1,2,4 mg/L 壳聚糖;PDA 培养基包含0.05,0.1,0.2,0.4,0.8 mg/L 壳聚糖。各培养基于121 ℃灭菌后20 min 与紫外灭菌30 min 后的壳聚糖溶液混合,加入0.1 mL 菌悬液,于37 ℃恒温(细菌)或30℃(酵母菌)湿度20%条件下培养24 h(细菌)或48 h(酵母菌),不长菌的最低浓度为MIC,试验重复3 次。
1.4 最小杀菌浓度(MBC)的测定[12]
向0.2 mL 菌悬液中加入2 mL 壳聚糖溶液,使乳酸菌菌悬液中壳聚糖的质量浓度为0.2,0.4,0.8,1.6,3.2 mg/L,使酵母菌菌悬液中壳聚糖的质量浓度为0.4,0.8,1.6,3.2,6.4 mg/L,使大肠杆菌菌悬液中壳聚糖的质量浓度为2,4,8,16,32 mg/L,并于37 ℃(细菌)和30 ℃(酵母菌)培养24 h,取0.1 mL 加入10 mL 各自液体培养基,125 r/min震荡培养24 h,以不长菌的最低浓度为MBC,重复3 次。
1.5 电导率测定
参考冯小强等[13]的方法,进行修改。菌培养18 h 后,于4 ℃、5 000 r/min 离心15 min,洗涤3次,用灭菌水制成菌悬液,调节OD600nm=0.8。取5 mL 菌悬液和5 mL 壳聚糖溶液混合,使壳聚糖终质量浓度为各种菌的MIC 和4MIC,灭菌水代替壳聚糖为对照。37 ℃(细菌)或30 ℃(酵母)培养0.5,5 h 和9 h(缺少能量,限制增殖)后于4 ℃、5 000 r/min 条件下离心15 min。取上清测定电导率为L2;取5 mL 所加质量浓度壳聚糖溶液和5 mL 灭菌水混合,测定电导率为L1;取对照煮沸10 min,同样离心后,取上清测定电导率为L0,试验重复3 次。相对电导率按式(1)计算:
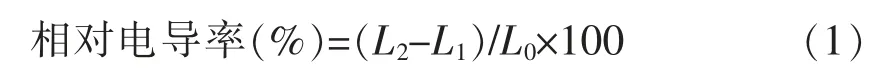
1.6 渗出OD260nm 测定
参考李大鹏等[14]的方法。采用MIC、4MIC 壳聚糖处理菌悬液,以灭菌水代替壳聚糖为对照,37℃(细菌)或30 ℃(酵母)培养0.5,5 h 和9 h 后4℃、5 000 r/min 离心15 min,取上清液,以相同质量浓度壳聚糖溶液为参比,测定波长260 nm 处的吸光度(DNA、RNA 等大分子物质渗漏),重复3次。
1.7 脱氢酶活性的测定
TTC 法是一种通过测定呼吸链脱氢酶活性来表征细胞代谢活力的有效方法,代谢产物三苯基甲腙(TF)呈现红色,红色越深,表示菌活力越强。通过492 nm 比色测定还原产生的红色TF 物质的量可以定量判断菌体内脱氢酶活性的大小[15]。TTC在细胞呼吸过程中替代氧接受H+(H+/e),自身被还原为红色物质TF,用有机溶剂萃取TF,测定TF吸光值,反映了电子传递链的递氢能力。OD 值越大,脱氢酶活性越强[16]。脱氢酶活性的测定参考周恢等[17]的方法。采用MIC、4MIC 壳聚糖处理菌悬液,以灭菌水代替壳聚糖为对照,37 ℃(细菌)或30 ℃(酵母)震荡培养0.5,5 h 和9 h 后取出。取2 mL 菌液,加入2 mL pH 7.0 的磷酸缓冲溶液、2 mL 4 mg/L TTC 溶液、2 mL 0.1 mol/L 葡萄糖溶液,混匀。37 ℃,黑暗反应2 h 后加入1 mL 甲醛终止反应,再加入4 mL 丙酮和5 mL 石油醚,37 ℃黑暗震荡提取10 min,以石油醚为参比,测定波长492 nm 处的吸光度。脱氢酶活性按式(2)计算:
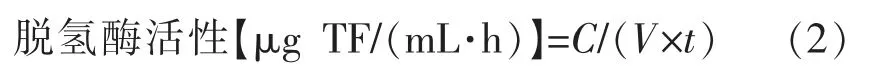
式中,C——TTC 还原量,μg;V——菌悬液体积,mL;t——反应时间,h。
1.8 β-半乳糖苷酶活性的测定
MIC 和4MIC 壳聚糖处理菌悬液4 h 后取样离心获得菌体。参考朱敏等[18]的方法,0.25 mL 无菌生理盐水溶解菌体制成菌悬液,加入一滴甲苯,于37 ℃振荡30 min,使酶释放。加0.25 mL 0.75 mol/L ONPG 溶液,于30 ℃水浴10 min,测定OD420nm值。酶活力按式(3)计算:

1.9 数据分析
利用Excel 2010 统计试验数据,利用t检验进行显著性分析,显著性水平设为P<0.05。
2 结果与分析
2.1 壳聚糖对3 种菌的MIC 和MBC
由表1 和表2 可知,壳聚糖对乳酸菌、酵母菌、大肠杆菌的MIC 分别为0.2,0.4,2 mg/L。壳聚糖对乳酸菌的生长抑制作用最强,酵母菌次之,大肠杆菌最弱,敏感性相差较大,壳聚糖对大肠杆菌的MIC 是乳酸菌的10 倍,是酵母菌的5 倍。

表1 壳聚糖对乳酸菌和酵母菌的MICTable 1 The MIC of chitosan for L.plantarum and S.ellipsoideus

表2 壳聚糖对大肠杆菌的MICTable 2 The MIC of chitosan for E.coli
由表3 和表4 可知,壳聚糖对乳酸菌、酵母菌、大肠杆菌的MBC 分别为0.8,3.2,16 mg/L。壳聚糖对乳酸菌、酵母菌、大肠杆菌的MBC/MIC 比值分别是4 倍、8 倍、8 倍。

表3 壳聚糖对乳酸菌和酵母菌的MBCTable 3 The MBC of chitosan for L.plantarum and S.ellipsoideus

表4 壳聚糖对大肠杆菌的MBCTable 4 The MBC of chitosan of E.coli
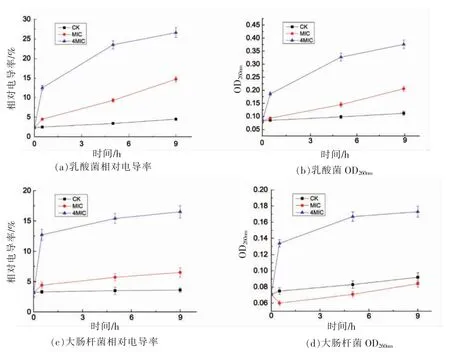
2.2 不同质量浓度壳聚糖对菌株相对电导率和OD260nm 值的影响
当微生物细胞膜遭到破坏时,其内部电解质会外泄至细胞外,导致细胞外液体的电导率上升,相对电导率反映的是细胞膜对小分子的离子渗漏阻隔性能。当细胞膜遭到较大破坏时,胞内大分子物质如核酸等也会从细胞内释放到细胞外。核酸在波长260 nm 处有很强的紫外吸收,测定细胞外的电导率和OD260nm有助于判断菌体细胞膜破坏程度。试验发现壳聚糖对菌株电导率的影响很大,可能是因为壳聚糖本身带有离子或螯合离子。另外,培养基和生理盐水中含有的离子对电导率测定也有很大干扰。本研究经过多次试验后,发现菌体培养后,通过离心去除培养基可以减少培养基的离子干扰。此外,菌体在加入的壳聚糖溶液和灭菌水中生长,在测定相对电导率时,也可通过扣除因添加壳聚糖引起的电导率变化来消除壳聚糖对电导率测定的影响。
4MIC 壳聚糖处理后3 种菌的相对电导率和OD260nm值都显著上升,且显著高于MIC 壳聚糖处理后菌株的相对电导率和OD260nm值。4MIC 壳聚糖处理乳酸菌的相对电导率,在0.5 h 上升425%,9 h 上升701%,OD260nm值分别上升125%和262%。MIC 处理后的乳酸菌相对电导率分别上升100%和289%,OD260nm值分别上升12.5%(不显著)和71%(图1a 和b),说明4MIC 壳聚糖已经显著促进离子和核酸外流,MIC 壳聚糖对核酸外渗作用的促进作用较弱。
4MIC 壳聚糖处理大肠杆菌的相对电导率在0.5 h 上升350%,9 h 上升415%,OD260nm值分别上升71%和89%;MIC 壳聚糖处理大肠杆菌的电导率在0.5 h 和9 h 分别上升36%和91%,OD260nm值在0.5 h 和9 h 分别下降23%和11%(图1c 和d)。MIC 壳聚糖处理大肠杆菌比MIC 壳聚糖处理乳酸菌的离子渗漏少,说明MIC 壳聚糖促进乳酸菌核酸渗漏,但没有促进核酸外渗。而受MIC 壳聚糖处理的大肠杆菌OD260nm值下降,可能是壳聚糖有凝结作用,大肠杆菌MIC 高,壳聚糖添加量特别大,容易降低背景吸收。高浓度壳聚糖对大肠杆菌的抑菌效果好,低浓度壳聚糖效果差。
4MIC 处理酵母菌的相对电导率,在0.5 h 上升了268%,9 h 上升了238%,OD260nm值分别上升169%和164%,前期增加非常明显;MIC 处理酵母电导率上升196%和137%,OD260nm值分别上升111%和150%(图1e 和f)。低浓度和高浓度对酵母抑制效果类似。

图1 壳聚糖对3种微生物相对电导率和OD260nm 的影响Fig.1 The effect of chitosans on the relative conductivity and OD260nm of three kinds of microorganisms
2.3 壳聚糖对菌内脱氢酶和β-半乳糖苷酶活性的影响
脱氢酶与氧化磷酸化有关,主要存在真核生物的线粒体膜上[19]。细菌没有线粒体,脱氢酶主要在细胞膜上。3 种菌对照都有较大的吸收值,均呈现红色(见图2 和图3),说明脱氢酶活力正常,TTC 能够通过酵母菌的细胞壁和细胞膜,进入细胞与线粒体膜上的脱氢酶反应,然而酵母菌红色低于细菌,说明TTC 进入细胞膜较难,进入量较少。
乳酸菌经过MIC 和4MIC 质量浓度的壳聚糖溶液处理以后,与对照组相比,其脱氢酶活性均显著降低。4MIC 和MIC 壳聚糖对乳酸菌,在0.5 h分别达到93%和77.8%的抑制率,9 h 脱氢酶活性极低,说明壳聚糖能够快速透过乳酸菌细胞壁,并抑制细胞膜上脱氢酶(见图2a)。
大肠杆菌试验添加壳聚糖质量浓度高,对大肠杆菌絮凝较强,引起菌体沉淀,每次摇均匀后测定。4MIC 和MIC 壳聚糖处理大肠杆菌后,脱氢酶活性变化比较小,说明大肠杆菌的细胞壁对壳聚糖的阻隔性很好(图2b)。

图2 壳聚糖对3种微生物细胞内的脱氢酶活性的影响Fig.2 The effect of chitosans on the dehydrogenase activities in three kinds of microorganisms
酵母菌经过MIC 和4MIC 质量浓度壳聚糖溶液处理以后,其脱氢酶活性均在第0.5 小时就被完全抑制,说明壳聚糖能够经过酵母菌的细胞壁和细胞膜,抑制了细胞内脱氢酶的活性。
对照微生物都悬浮在液体中,3 种菌经过壳聚糖处理后都有沉淀,说明壳聚糖对3 种菌体都产生絮凝作用,微生物主要在沉淀中。乳酸菌上清液还有一些浑浊,说明壳聚糖对菌体沉淀不彻底,而大肠杆菌和酵母菌上清液非常澄清,说明壳聚糖对大肠杆菌和酵母菌絮凝作用很强。培养0.5 h,对照组的乳酸菌和大肠杆菌细胞内的脱氢酶活力很强,溶液颜色呈现红色,而对照组的酵母菌溶液颜色呈淡红色,可能因为TTC 进入细胞内,到达线粒体膜较少。4MIC 和MIC 壳聚糖处理乳酸菌和酵母菌的沉淀和上清液都呈无色,说明乳酸菌细胞膜和酵母菌线粒体膜的脱氢酶受到抑制,而4MIC 和MIC 壳聚糖处理的大肠杆菌沉淀呈现红色,说明大肠杆菌细胞膜的脱氢酶没有受到抑制(见图3),壳聚糖可能容易透过乳酸菌细胞壁作用于细胞膜上的脱氢酶,透过酵母菌细胞壁和细胞膜进入细胞内作用于线粒体膜的脱氢酶,而没有大量透过大肠杆菌细胞壁,故几乎不抑制其细胞膜上的脱氢酶活力。

图3 经过壳聚糖处理的3 种微生物脱氢酶活性照片(0.5 h)Fig.3 The photos of dehydrogenase activities in three kinds of microorganisms treated with chitosan(0.5 h)

表5 壳聚糖对3种微生物细胞内β-半乳糖苷酶活性的影响(U)Table 5 The effect of chitosans on the β-galactosidase activities in three kinds of microorganisms(U)
β-半乳糖苷酶属于胞内物质,因此前人常用β-半乳糖苷酶渗出细胞浓度代表细胞膜破损情况。3 种菌经MIC 壳聚糖处理后其细胞内的β-半乳糖苷酶活性显著下降,此时MIC 壳聚糖完全能抑制3 种菌的繁殖,但是去除壳聚糖后,3 种菌又继续生长,反而延缓了菌株个体的寿命。β-半乳糖苷酶的活性下降是由该酶被结合引起的,还是由细胞膜渗漏导致胞内酶减少引起的尚不清楚。4MIC 壳聚糖处理乳酸菌和酵母菌后,其细胞内的β-半乳糖苷酶活力均比MIC 壳聚糖处理高,说明壳聚糖过多进入细胞引发菌体的衰老或逆境反应,导致了β-半乳糖苷酶的合成。只有4MIC 壳聚糖处理大肠杆菌的β-半乳糖苷酶活力相比MIC壳聚糖处理大肠杆菌的β-半乳糖苷酶活力进一步受到抑制,这可能与壳聚糖较难进入大肠杆菌细胞有关。
壳聚糖对非膜上酶——β-半乳糖苷酶的抑制强度较弱,而对膜上酶——脱氢酶的抑制很强,说明壳聚糖可能主要抑制膜上酶。进入细胞后,可能是通过内质网运输到达细胞器膜,而不是在细胞质的溶液中扩散。
3 讨论
水溶性壳聚糖对3 种菌的MBC/MIC 比值为4~8 倍,这和Sun 等[2]报道水溶性壳聚糖对大肠杆菌、金黄色葡萄球菌的两者比值类似。然而,本研究结果显示大肠杆菌的MIC 为2 mg/L,MBC 为16 mg/L,与Sun 等[2]的报道不一致,可能与培养基或水溶性壳聚糖pH 值差异有关,大肠杆菌对酸很敏感。
本研究发现水溶性壳聚糖对乳酸菌和酵母菌的抑菌活性远远大于对大肠杆菌的抑菌活性。这与Hong 等[19]研究得出水溶性壳聚糖对G+菌的抑制作用强于G-的结论相符。但Sun 等[2]报道称水溶性壳聚糖对金黄色葡萄球菌(G+)的MIC 为2 mg/mL 高于大肠杆菌,说明G-菌更加敏感。Chen 等[20]认为水溶性壳聚糖对G-的抑制作用强于G+菌。另外Sun 等[2]报道壳聚糖对甘蔗节菱孢的MIC 和MBC 均为16 mg/mL,对灰葡萄孢的MIC 和MBC均为0.13 mg/mL,说明其对霉菌和细菌的抑制差异很大。壳聚糖对微生物并非都起抑制作用,吴智艳等[21]报道称0.05~0.125 mg/mL 的壳聚糖处理可促进平菇菌丝生长。综上所述,壳聚糖的抑菌机理仍然不够清楚,存在未知干扰因素,导致抑菌效果不稳定。
MIC 壳聚糖处理乳酸菌、大肠杆菌、酵母0.5 h 后相对电导率分别是对照2,1.4,3 倍,而4MIC壳聚糖处理组分别是4.3,4.0,4.4 倍。MIC 壳聚糖处理乳酸菌、大肠杆菌、酵母0.5 h 后OD260nm值是对照1.1,-0.8,2.1 倍,4MIC 壳聚糖处理OD260nm值分别是2.2,2.0,2.3 倍。差距非常大。由于我们平时测定的相对电导率上升幅度较小,该数值不足于作为评价菌是否死亡的指标。原因可能是菌体外溶液中本身含有大量离子,导致检测的菌体相对电导率变化幅度很小。致死微生物渗出的相对电导率是对照的4 倍,渗出的OD260nm值是对照的2 倍。李小芳等[5]报道称碱性磷酸酶存在于细胞膜和细胞壁间隙中,β-半乳糖苷酶存在于细胞膜的内部,而核酸存在于质膜内部,一般不会分泌到细胞外部。壳聚糖处理后,碱性磷酸酶首先被释放,而后是β-半乳糖苷酶泄漏。壳聚糖处理0.5 h 后菌液中OD260nm和OD280nm值显著升高,可能是壳聚糖对细胞壁和细胞膜磷脂双层结构都有影响,导致细胞内容物泄露。
本试验测定了细胞内非膜上的β-半乳糖苷酶,该酶存在于溶酶体、液泡或细胞质中。作为诱导酶,平时该酶的活性很低,如果用半乳糖或乳糖诱导,则β-半乳糖苷酶会大量合成。β-半乳糖苷酶也可作为衰老指标,当细胞衰老时,β-半乳糖苷酶活性上调[22]。本研究发现壳聚糖处理导致乳酸菌和酵母菌的脱氢酶活性受到显著抑制,而大肠杆菌没有受到显著抑制,3 种菌的β-半乳糖苷酶活性受到抑制较轻,这说明壳聚糖能够透过乳酸菌和酵母菌细胞壁,而较难透过大肠杆菌的细胞壁,这可能与它们的细胞壁结构和组成有关。乳酸菌是G+细菌,含90%肽聚糖和10%磷壁酸,两者都带负电荷,细胞壁虽厚但容易透过亲水物质。壳聚糖也称壳糖胺,脱乙酰后带有NH3+基团,带正电,故壳聚糖容易与乳酸菌细胞壁结合。大肠杆菌是G-细菌,细胞壁虽薄但包含外膜和肽聚糖内层。外膜分3 层,外层是脂多糖(LPS),内层是脂蛋白,中间是磷脂双分子层。其中脂质双层类似细胞膜,是细胞壁阻隔大分子物质的主要屏障。LPS 含类脂,也有阻隔作用,然而LPS 带有负电荷,能与壳聚糖结合。脱乙酰度高的壳聚糖,具有破坏LPS 结构的能力。酵母细胞壁虽厚,但壳聚糖却容易透过。原因是酵母细胞壁的主要成分是多糖,细胞壁内层是葡聚糖、外层是甘露糖,中间是蛋白质,均为亲水物质,因此壳聚糖相对容易透过。
研究发现壳聚糖能显著抑制乳酸菌和酵母菌的脱氢酶活性,前者位于细胞膜上,后者位于线粒体膜上,说明壳聚糖能够快速进入酵母菌细胞内。Li 等[23]报道称体外壳聚糖的加入会改变牛血清白蛋白的二级结构,并引起牛血清白蛋白荧光猝灭,即壳聚糖与酶相遇可能会导致酶活性显著下降。Jia 等[3-4]报道称银粒子壳聚糖纳米颗粒可引起灰葡萄孢菌丝原生质体浓缩,细胞壁破裂。吡啶-壳聚糖处理灰葡萄球菌会引起严重的形态学改变。李小芳等[5]报道称壳聚糖处理导致细菌形态变化,细胞表面变得模糊,甚至出现破碎细胞,采用FITC 标记壳聚糖处理金黄葡萄球菌,通过激光共聚焦发现,处理后培养30 min 时,带有荧光的壳聚糖在菌体外围成一圈,无法进菌体细胞内部;培养24 h 时,壳聚糖杀死菌体,荧光呈现破碎状,说明壳聚糖不只是透过细胞壁,还会破坏细胞壁,并且对细胞膜也有破坏作用。
壳聚糖可能具有抑制细菌基因复制和转录的作用,然而壳聚糖进入真核细胞后,如何避过各种蛋白等结合,直达细胞核和线粒体,仍值得研究。王琼等[24]应用荧光定量PCR 发现6.0 g/L 壳聚糖可抑制金黄葡萄球菌的肠毒素基因转录,但没有说明菌的数量是否一致。刘晓非等[25]报道称低分子壳聚糖和羧甲基壳聚糖处理大肠杆菌后,壳聚糖能与mRNA 探针结合,从而阻碍mRNA 探针和DNA 结合。李小芳等[26]发现体外DNA 与壳聚糖能够结合,认为壳聚糖可能有一部分进入细菌细胞内部,与DNA 之间由静电作用形成新的复合物,导致DNA 双螺旋结构被破坏,进而抑制细菌的繁殖。张小燕等[27]报道称2.5 g/L 低分子壳聚糖对变形链球菌生物膜作用15 min 后,菌体参与转运功能、感受态、信号传导的基因显著上调;而参与能量代谢和转录调节的基因显著下调。本试验发现壳聚糖对酵母脱氢酶抑制作用很强,对β-半乳糖苷酶活性抑制作用较弱。细胞内蛋白质主要采用膜泡运输方式[18],壳聚糖进入细胞后,可能不是溶解于液体移动,而是通过膜泡运输。壳聚糖的抑菌能力的强弱关键可能取决于其透过细胞壁的能力,以及对细胞膜的破坏程度。
4 结论
水溶性壳聚糖抑制乳酸菌最强,其次是酵母菌,大肠杆菌最弱。这取决于微生物细胞壁对壳聚糖的阻隔性。4MIC 壳聚糖对3 种菌破坏强烈。MIC 壳聚糖容易透过酵母菌的细胞壁,且能迅速破坏酵母菌细胞膜。MIC 壳聚糖也容易透过乳酸菌细胞壁,并对乳酸菌细胞膜破坏速度较慢,但是强度较大。MIC 壳聚糖处理大肠杆菌后,细胞膜只是离子渗漏增加,大分子核酸渗漏较少,说明壳聚糖不容易透过细胞壁。壳聚糖对乳酸菌细胞膜上脱氢酶和酵母菌线粒体脱氢酶的抑制很强,对大肠杆菌细胞膜脱氢酶的抑制较弱。壳聚糖对细菌细胞质和酵母菌溶酶体中的β-半乳糖苷酶活性抑制作用较弱。综上所述,壳聚糖进入菌体细胞后,可能通过内质网膜泡进行移动。
