晚期上皮性卵巢癌初始治疗相关预测手段研究进展*
2021-12-17潘璐璐陈昌贤综述李力审校
潘璐璐 陈昌贤 综述 李力 审校
上皮性卵巢癌(卵巢癌)是女性生殖系统最常见的三大恶性肿瘤之一,其死亡率高居首位,严重威胁到女性的生命和健康。理想的初始肿瘤细胞减灭术(primary debulking surgery,PDS)以及规范足疗程的术后辅助化疗,得到美国国立综合癌症网络(NCCN)的极力推崇[1]。但约70%患者初诊时已属晚期,并多合并远处转移,初始手术时很难达到理想的肿瘤细胞减灭(即R0 切除)。新辅助化疗(neoadjuvant chemotherapy,NACT)可减轻肿瘤负荷,为后续的间歇性肿瘤细胞减灭术(interval debulking surgery,IDS)创造有利条件。多项研究表明,虽然NACT 不能提高患者生存期,但可以提高手术R0 率,使围术期并发症的发生率和死亡率均显著降低70%~80%[2-3]。晚期卵巢癌初始治疗方案选择的争议由来已久,尽管NACT 得到国际上的公认,但有关其使用指征及疗效仍存在主观上的不同认知,临床上仍有NACT 使用不当的现象。在选择初始治疗方案时,应主要考虑肿瘤负荷及患者的自身状况,即何种病灶可以切净,何类患者可以耐受预期的PDS。为避免主观臆断,迫切需要寻找客观的预测手段。因此,本文将就晚期卵巢癌初始治疗及预后相关预测手段进行综述,为临床实践提供参考。
1 预测手段及意义
1.1 化疗敏感性
肿瘤标记物HE4 及CA125 是现阶段最常用于化疗敏感性预测的指标,3 个疗程NACT 后HE4<115 pmol/L 和CA125<35 U/mL,预测铂类敏感性的特异度分别为68.7%和57.9%,灵敏度分别为92.9%和90.9%[4-6]。乳腺癌易患基因(breast cancer,early onset,BRCA)、多药耐药相关蛋白(multidrug resistanceassociated protein,MRP)1 和乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)、核苷酸切除修复交叉互补基因(excision repair cross-complementation,ERCC)1 及B 淋巴细胞 瘤-2(B-cell lymphoma-2,Blc-2)基因等均与铂类耐药相关,可作为化疗敏感性的潜在生物标志物,其中BRCA 突变者对化疗更敏感,总生存期(overall survival,OS)更长,高表达的MRP1、ERCC1、Blc-2 及低表达的BCRP 与化疗耐药相关[7-9]。
1.2 手术满意率
基于CT 放射学参数的评估及腹腔镜探查均可用于预判R0 率。Suidan CT 评分[10]是包含3 个临床特征及8 个CT 特征的无创评估方案(表1),若评分<3分建议PDS,反之则选择NACT 及IDS。Fagotti 腹腔镜评分[2,11-12]包含7 个参数(表2),每个参数赋值2 分,总分即为腹腔镜预测值(laparoscopic predictive index value,PIV)。若分值<8 分建议PDS,反之则选择NACT 及IDS。同时Fagotti 等[2]还提出预测术后并发症的模型(表3),6~8 分为高危组,3~5 分为中危组,0~2 分为低危组,高危组建议行NACT 及IDS。在2020年美国妇科肿瘤学会(SGO)会议上,梅奥中心提出的风险分类算法[13],结合患者的临床分期、手术范围及严重合并症等进行评估。并需符合下列三条标准中任一:1)白蛋白<3.5 g/dL;2)年龄≥80 岁;3)年龄为75~79 岁,且符合ECOG 评分>1 分、Ⅳ期(肝实质或肺脏转移)、可能需要复杂手术(即不仅仅行子宫、双侧输卵管卵巢或大网膜切除)的任一条,则认为与PDS 相关的发病率或死亡率为高风险,建议NACT 及IDS,反之首选PDS。若最近(时间<6 个月)接受过剖腹、心梗、支架或静脉栓塞手术,也建议NACT。

表1 Suidan 评分[10]

表2 Fagotti 腹腔镜评分[2,11-12]

表3 Fagotti 术后并发症预测模型[2]
1.3 预后评估
基于CA125、HE4 和卵巢恶性肿瘤风险模型(risk of ovarian malignancy algorith,ROMA)的预测模型可有效预测卵巢癌预后。在转移或复发患者中,CA125、HE4 和ROMA 指数显著升高[14-15]。系统性免疫炎症反应与癌症进展密切相关。中性粒细胞与淋巴细胞之比(neutrophil to lymphocyte ratio,NLR)、单核细胞与淋巴细胞之比(monocyte to lymphocyte ratio,MLR)、纤维蛋白原和中性粒细胞与淋巴细胞之比(fibrinogen and neutrophil lymphocyte ratio,F-NLR)、血小板与淋巴细胞之比(platelet to lymphocyte ratio,PLR)、格拉斯哥预后评分(Glasgow prognostic score,GPS)、系统免疫炎症指数(systemic inflammation index,SII)以及预后营养指数(prognostic nutrition index,PNI)等对预后均有一定的预测价值(表4)。其中,高NLR、F-NLR、MLR、PLR、SII、GPS 者OS 较短, 而低PNI 者PFS 较短,且高SII 与肿瘤复发密切相关[16-17]。另外,基于microRNAs 构建的预后风险评估模型也有较高的预测性能,miRNA-34a-5p 和miRNA-93-5p 降低可带来PFS 和OS 获益[18]。
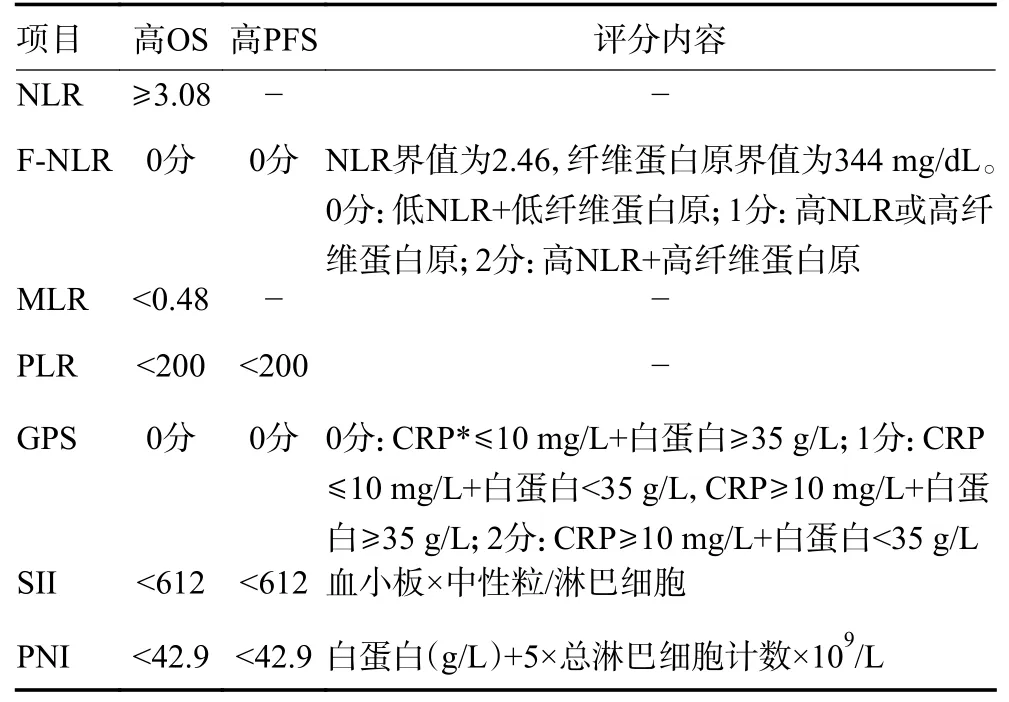
表4 炎症评分的预测应用[16-17]
2 预测手段的使用及局限性
2.1 对于NACT 及IDS
化疗耐药是卵巢癌治疗失败的根本环节,导致治疗困难。在确定NACT 前,原发肿瘤对初次化疗的潜在反应是首要考虑的问题。有条件的医疗机构可检测BRCA1、ERCC1 等基因,以初步预判化疗敏感性,但因其预测性能尚不明晰,临床上未广泛普及,需更多的数据加以验证。根据Suidan 评分、Fagotti 评分评估手术R0 率,如CT 评分≥3 分或PIV≥8 分,则考虑NACT 及IDS。另外,根据梅奥中心的分类算法评估为高风险者,也建议选择NACT 及IDS。CA125、HE4 表达水平及下降程度预测NACT 化疗反应,如3 个疗程NACT 后CA125、HE4 降至正常,提示化疗敏感,治疗有效。
2.2 对于PDS
PDS 的抉择主要取决于手术能否达到R0。Suidan评分可初步评估R0 率,如评分<3 分建议PDS,其评估总准确率为72%[10]。随着腹腔镜技术的发展,其诊断和治疗价值得到广泛认可。必要时可进行腹腔镜探查,如PIV<8 分建议PDS。其评估总准确率为90%[11],且与经腹手术一致,在很大程度上可避免初治患者非必要的剖腹探查,但对患者预后是否有影响,目前尚无明确的研究。Suidan 评分和Fagotti 评分主要关注的是肿瘤负荷、手术难易、手术团队能否胜任手术以及能否达到R0 等,虽广泛应用于临床,但国内外尚无统一定论,仍需大宗数据的验证。
手术切净率应首要考虑,但手术耐受性也不容忽视,绝大部分患者无法接受预期手术均是因为有严重合并症[19]。梅奥中心提出的分类算法将年龄、白蛋白、手术复杂性等纳入考虑,低风险者首选PDS。梅奥评分标准易于掌握,且能大幅减少腹腔镜评估患者的数量,使初治患者得到精准治疗,也大幅降低了手术死亡率,其临床可行性及预后效益极大。但其局限性在于评估肿瘤负荷不够精准,建议临床上将以上评分联合使用,使得手术决策精准有效。
2.3 对于预后评估
初始方案确定后,不论何种治疗模式下,在后续治疗中均要积极评估预后,既要注重结果,更要把握时机、关注过程。基于血清CA125、HE4 和ROMA 的预测模型可以评估化疗疗效,如经评估化疗不敏感,应积极干预,及时调整化疗方案及剂量。治疗完成后,基于血常规的炎症评分可初步评估复发风险,此评分简便价廉,有助于临床广泛应用。基于microRNA 模型对卵巢癌预后的预测提供了新的思路,但仍需更多数据加以验证。另外,围术期管理也需重点关注。由于卵巢癌手术范围大,器官组织功能恢复慢,导致IDS前后的化疗时机很难控制。化疗间隔>10 周被认为可降低OS[20]。如何根据血液生化指标、营养状况等进行系统评估,以精准确定化疗时机,仍是当前的研究难点之一。
3 结语
综上所述,目前术前评估晚期卵巢癌手术R0 率,临床常用的有Suidan 评分和Fagotti 评分,而梅奥评分标准是将手术耐受性、手术相关并发症发病率及死亡率纳入考虑,可广泛在临床实践中推广。经评估,对于高龄患者、一般情况差、有严重内科合并症、无法耐受PDS,且肿瘤病灶广泛转移而无法切净的IIIc~Ⅳ期卵巢癌患者,宜考虑NACT 及IDS,反之则首选PDS。同时,临床上可通过CA125、HE4、ROMA 模型、炎症评分等,有效预测化疗敏感性及预后。目前,在分子研究中相关标志物,如耐药基因、microRNAs 等也提供了新的预测思路,但仍需更多研究加以验证。如预测预后不佳,可及时考虑二线化疗、免疫治疗、靶向治疗等。有效利用相关预测手段,使初治卵巢癌患者得到正确诊疗,以引领晚期卵巢癌的治疗进入精准时代,达到风险与获益的统一。
