三羧酸循环的代谢物与肿瘤发生相关性的研究进展*
2021-12-17魏晨徐瑞华鞠怀强
魏晨 徐瑞华 鞠怀强
细胞代谢是一切生命活动的动力之源,为细胞的生长和增殖提供能量来源与物质基础。在细胞代谢过程中,复杂多样的代谢酶会产生大量的代谢产物小分子。这些小分子除了在经典的代谢途径中发挥作用外,还作为信号分子发挥非代谢性的功能,将来源于细胞外的微环境因素和细胞内的基因表达信息联系起来,对细胞的各种特性和进程产生影响,最终影响肿瘤的发生和发展。
线粒体是细胞能量代谢中心,在线粒体中发生的三羧酸循环(tricarboxylic acid cycle,TCA cycle)是需氧生物体内普遍存在的代谢途径。三羧酸循环的主要功能是产生还原当量,如NADH 和FADH2(由琥珀酸脱氢酶产生)。NADH 和FADH2 可将电子转移到ETC 来驱动氧化磷酸化并生成ATP。突变的IDH 能消耗NADPH,将α-酮戊二酸转化为D-2-HG,并生成NADP+。糖、脂肪、氨基酸分解代谢最终都将产生乙酰CoA,然后进入三羧酸循环进行氧化供能。同时,三羧酸循环也是糖、脂肪、氨基酸代谢联系的枢纽,柠檬酸经载体转运至胞质后在柠檬酸裂解酶作用下裂解成乙酰CoA 及草酰乙酸,乙酰CoA 随后可被用于合成脂肪酸等。如图1 所示,该循环由8 种酶组成,分别是柠檬酸合成酶(CS)、乌头酸酶(ACO2)、异柠檬酸脱氢酶(IDH)、α-酮戊二酸脱氢酶(OGDH)、琥珀酰CoA 合成酶、琥珀酸脱氢酶(SDH)、延胡索酸酶(FH)和苹果酸脱氢酶(MDH)。三羧酸循环的众多中间代谢产物,作为内源生物活性小分子在肿瘤发生发展中所发挥的作用越来越受到关注。三羧酸循环衍生的代谢物主要包括琥珀酸盐、延胡索酸盐、D-2-羟基戊二酸、乙酰CoA 和NADPH 等,可对信号功能和细胞转化的多个关键过程产生影响,与肿瘤发生发展密切相关。本文将依次探讨琥珀酸、延胡索酸、2-羟基戊二酸、乙酰CoA 和NADPH 的非代谢功能,对这些三羧酸循环中间代谢物与肿瘤发生发展的研究进展进行综述。
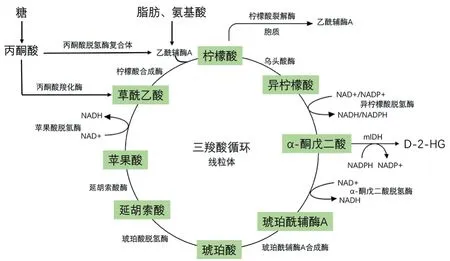
图1 三羧酸循环
1 琥珀酸
琥珀酸由琥珀酰CoA 在琥珀酰CoA 合成酶的催化下生成,这是三羧酸循环中唯一的底物水平磷酸化反应,在水解琥珀酸的同时可生成ATP 或GTP。生成的琥珀酸将在SDH 的催化下生成延胡索酸。琥珀酸发挥其信号分子功能的过程主要涉及缺氧诱导因子-1α(HIF-1α)的稳定和蛋白质的琥珀酰化修饰[1]。
HIF-1α 作为缺氧条件下的重要转录因子,能在转录水平促进血管生成、细胞有氧呼吸向糖酵解的转变及细胞的凋亡和自噬,并参与调节多条信号通路来促进肿瘤的增殖和转移[2-3]。HIF-1α 蛋白通过羟基化、乙酰化、磷酸化等翻译后修饰途径及信号转导途径稳定其蛋白质结构并增强其活性。其中,脯氨酸羟化酶(PHDs)对HIF-1α 稳定性的调控至关重要。其使HIF-1α 的第564 位和第402 位的脯氨酸残基羟基化,而HIF-1α 碳端存在富含脯/丝/苏氨酸(Pro/Ser/Thr)的氧依赖降解结构域(ODDD),可与肿瘤抑制蛋白(pVHL)结合,聚集多种泛素蛋白,共同组成泛素连接蛋白酶复合体,从而将羟化的HIF-1α 亚基泛素化,并经泛素连接蛋白酶复合体途径降解[4]。而PHD 属α-酮戊二酸依赖性双加氧酶类,能将α-酮戊二酸(α-KG)转化为琥珀酸,转化的琥珀酸则会通过产物抑制作用,抑制PHD 来稳定HIF-1α[5],从而促进肿瘤发生。最近有研究发现,癌细胞可以释放琥珀酸,激活琥珀酸受体(SUCNR1)信号,并进一步通过磷脂酰肌醇3-激酶(PI3K)-HIF-1α 轴促进肿瘤的迁移、侵袭和远处转移[6]。另外,琥珀酰化修饰是一种重要的蛋白翻译后修饰,可通过调控蛋白酶活性和基因表达,参与糖代谢、氨基酸代谢、脂肪酸代谢、酮体合成及活性氧清除等多种生命活动[7]。琥珀酰化修饰水平主要受琥珀酰基供体和琥珀酰基转移酶/去琥珀酰化酶的调控,琥珀酰基供体及琥珀酰基转移酶对琥珀酰化修饰发挥正向调控作用,去琥珀酰化酶对琥珀酰化修饰发挥负向调控作用。当琥珀酸脱氢酶缺失时,通过三羧酸循环产生的琥珀酰CoA 增多,核小体上的赖氨酸琥珀酰化修饰显著增加[8]。实际上,组蛋白琥珀酰化的发生依赖于诸多催化酶,其中赖氨酸乙酰转移酶2A 是组蛋白琥珀酰化修饰的转移酶,可以利用琥珀酰CoA 作为底物,催化组蛋白H3K79 位点的琥珀酰化,进而促进癌基因转录,影响肿瘤的发生发展[9]。除组蛋白外,线粒体内的代谢酶也能发生琥珀酰化,如谷氨酰胺酶的琥珀酰化修饰能促进其由单体向有活性的四聚体转换,提高催化活性,增强对谷氨酰胺的分解代谢和还原性物质的产生,从而对抗氧化应激,促进肿瘤细胞存活和肿瘤生长[10]。此外,大量的线粒体外琥珀酰化的发生表明,除琥珀酰CoA 外,琥珀酸或其他琥珀酸代谢产物也可以影响细胞质及细胞核的琥珀酰化水平[11]。研究发现琥珀酰化修饰与包括肠癌、肺癌、皮肤黑色素瘤、肝细胞癌等多种恶性肿瘤的发生相关,且在肿瘤中的作用具有组织异质性[12]。不同肿瘤中琥珀酰化水平差异的原因是什么,琥珀酰化修饰如何参与肿瘤的发生发展等问题还需进一步深入研究。
2 延胡索酸
延胡索酸最初在果蔬中发现,在三羧酸循环中,它由琥珀酸脱氢酶(SDH)催化琥珀酸氧化生成,同时也是酪氨酸分解代谢、尿素和嘌呤核苷酸循环的产物[13]。延胡索酸可以被延胡索酸酶(FH)水解进一步生成苹果酸。除了代谢性功能以外,延胡索酸及FH对肿瘤发生发展的作用主要与其介导的氧化应激、甲基化修饰及DNA 损伤修复、细胞焦亡等密切相关。
鉴于延胡索酸在能量代谢中的核心作用,FH 曾被认为是一种管家酶[14]。但是,研究发现FH 的基因突变能导致遗传性平滑肌瘤病与肾细胞癌[15],并且FH 缺失的肾癌呈高度侵袭性,原发灶较小即能转移,临床预后很差。FH 缺失或失活突变将导致延胡索酸累积,研究发现延胡索酸可与细胞内的谷胱甘肽结合,从而破坏抗谷胱甘肽的抗氧化功能,升高活性氧水平导致氧化应激[16-17]。另有研究表明,延胡索酸会使铁反应元件结合蛋白2(IRP2)琥珀酰化,促进转铁蛋白的转录[18]。这些都与代谢酶的催化功能无关,而是由延胡索酸的高水平积累所致,且不可逆。
当然,延胡索酸作为影响肿瘤微环境的线粒体信使,其功能多样。FH 缺陷型肾细胞癌虽多表现出高频拷贝数改变,但其体细胞突变负荷低,提示发病与表观遗传学机制相关[19]。最近的数据表明,延胡索酸是TET 依赖的DNA 去甲基酶家族和一系列组蛋白去甲基化酶的有效抑制剂[20-21]。延胡索酸的积累能够抑制具有抗肿瘤转移作用的miR200 家族的miRNAs 发生TET 依赖性DNA 去甲基化,促进上皮-间质转化(EMT),该过程涉及癌症的发生和转移[22-23]。另外,FH 的酶活性及其产物延胡索酸是DNA 损伤反应的关键元件,FH 缺陷可通过破坏DNA 损伤修复来促进肿瘤生长[24]。焦亡(pyroptosis)是炎症性细胞死亡类型之一,在自身免疫性疾病及肿瘤中都发挥重要作用。细胞焦亡过程中的明星分子Gasdermin 家族成员GSDMD 和GSDME可被代谢过程产生的延胡索酸在特定半胱氨酸位点加上2-琥珀酰基(succinyl)修饰,从而抑制其形成寡聚体,阻止焦亡的发生[25]。因此,延胡索酸积累激活的下游分子与信号通路,有望作为肿瘤治疗的潜在靶点。
3 D-2-羟基戊二酸
2-羟基戊二酸是一种α-羟基酸,存在两个同分异构体-D-2-羟基戊二酸(D-2-HG)和L-2-羟基戊二酸(L-2-HG)。正常情况下,哺乳动物细胞中微量的2-HG分别由苹果酸脱氢酶(MDH)和羟基酸-含氧酸转氢酶(HOT)催化生成[26]。在生理条件下,IDH1/2 负责将异柠檬酸氧化为α-KG,为机体提供生物合成的原料和能量,同时伴随生成的还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)对于维持细胞氧化还原环境的平衡起到至关重要的作用。研究发现,突变型IDH1/2(mIDH1/2)能够将α-KG 转化为致癌代谢物D-2-HG,并通过表观遗传调控的改变促进肿瘤发生发展[27-29]。
近年来,在不同类型的肿瘤细胞中发现了IDH1/2突变,并证实突变产生过量的D-2-HG 是导致肿瘤发生和发展的根本原因,以胶质瘤、软骨瘤、急性髓细胞白血病和肝内胆管癌最为常见[11]。D-2-HG 在结构上与α-KG 相似,其发挥α-KG 拮抗物作用,竞争性抑制多个α-KG 依赖的双加氧酶,包括KDMs 和TET DNA羟化酶家族。在胶质瘤和肝内胆管癌中,mIDH1/2 产生的D-2-HG 能驱动CpG 岛甲基化表型而促进肿瘤发生,高浓度的2-HG 抑制了TET 酶的活性,致使CCCTC-结合因子(CTCF)结合位点表现出广泛的高甲基化状态,表观遗传调控异常,进而诱导抑癌基因沉默、抑制细胞分化、促进细胞增殖,最终导致肿瘤的发生与发展[30-33]。在低级别胶质瘤中mIDH1 产生的D-2-HG 还可以通过抑制组蛋白去乙基化酶KDM4A,使mTORC1/2 的负向调节因子-DEPTOR 不稳定,从而激活mTOR 信号通路,促进肿瘤的发生发展[34]。
除了导致表观遗传的失调控,D-2-HG 还能增加HIF-1α 蛋白的稳定性。IDH1/2 突变产生的D-2-HG抑制了α-KG 依赖性的双加氧酶PHDs 的活性,使HIF-1α 不被泛素化降解,从而稳定HIF-1α 蛋白,而HIF-1α 稳定性增加的现象已经在IDH1 突变的脑组织中得到证实[35]。值得一提的是,突变的IDH 过度消耗细胞内NADPH 也会导致ROS 增多,使细胞更容易受到ROS 的损伤,引起细胞膜破坏、DNA 损伤和基因组的不稳定,导致肿瘤的形成。另外,D-2-HG 的作用不仅局限于对细胞表观遗传水平的调控,越来越多的研究表明其在细胞内的浓度往往与免疫系统正常功能的发挥密切关联。现已证明,D-2-HG 可能通过抑制补体激活和T 淋巴细胞活化等过程,促进IDH1/2 突变型胶质瘤的免疫逃逸[36]。在铁死亡领域,mIDH1 产生的D-2-HG 还可以通过下调谷胱甘肽过氧化物酶4(GPX4)蛋白水平,使细胞内脂质过氧化物累积,增加癌细胞对铁死亡的敏感性[37],这对未来癌症治疗方法的创新有着重要意义。
4 乙酰CoA
乙酰CoA 可通过糖酵解来源的丙酮酸脱羧、脂肪酸β 氧化和氨基酸如亮氨酸、异亮氨酸和色氨酸的降解而产生[13]。三羧酸循环中,乙酰CoA 为草酰乙酸到柠檬酸的生成提供乙酰基。乙酰CoA 不能直接透过线粒体膜,而是以柠檬酸的形式经线粒体柠檬酸盐载体离开线粒体到达胞质,随后被ATP-柠檬酸盐裂解酶(ACL)裂解,再度转化为乙酰CoA 和草酰乙酸。哺乳动物细胞中组蛋白乙酰化依赖于ACL 裂解柠檬酸生成的乙酰CoA,而抑制ACL 则会降低组蛋白乙酰化水平[38]。在糖剥夺条件下,核转位的CoA 合成酶2(ACSS2)能够在核内局部催化CoA 的生成,并可通过增加溶酶体生物发生及自噬相关基因启动子区的组蛋白3 乙酰化水平,促进其表达,此过程与人神经胶质瘤的侵袭性增加相关[39]。事实上,除了组蛋白乙酰化,非组蛋白乙酰化也涉及生理和疾病相关的关键细胞过程,如基因转录、DNA 损伤修复、细胞分裂、信号转导、蛋白质折叠、自噬和新陈代谢等。乙酰CoA 还可以通过激活钙/钙调蛋白依赖性激酶Ⅱ(CaMKⅡ)促进前列腺癌远处转移[40]。因此,乙酰CoA 参与的乙酰化修饰能够通过多种机制影响蛋白质功能,包括调节蛋白质稳定性、酶活性、亚细胞定位以及通过调控蛋白质与蛋白质、蛋白质与DNA 相互作用等,从不同的维度调控肿瘤的发生发展。
5 NADPH
NADPH 即还原型辅酶Ⅱ,其来源除了三羧酸循环中的异柠檬酸脱氢酶以外,主要还包括苹果酸酶、戊糖磷酸途径和叶酸代谢途径。NADPH 可作为供氢体为细胞的合成代谢(如脂肪酸、核苷酸的合成等)提供还原电子对。NADPH 还可以作为谷胱甘肽的辅酶,是细胞内抗氧化防御系统的重要组分,在维持肿瘤细胞内的氧化还原稳态,防御活性氧损伤方面发挥关键的作用[41-42]。最近研究发现,NADPH 通过与第二信使Ins(1,4,5,6)P4 竞争性结合组蛋白去乙酰化酶3(HDAC3),阻碍HDAC3-Ncor 复合物的形成,从而抑制HDAC3 的活性,增加组蛋白乙酰化水平[43]。这说明NADPH 不但可以抵御氧化应激,还可以作为信号分子参与表观遗传状态的调控,HDAC3 也可以作为细胞内NADPH 稳态的感受器,通过感知细胞内NADPH 的水平,调控组蛋白乙酰化和基因表达。
6 结语
目前关于代谢物作为信号分子的研究虽已取得较多进展,如延胡索酸盐作为促肿瘤信号分子、乙酰CoA 参与调控表观遗传促进肿瘤发生发展等研究,为这一新兴领域增添了新的内容,但仍然有诸多问题亟待探索,如琥珀酸等是否可以作为疾病或肿瘤进展的生物标记或驱动因素,积累的代谢产物在细胞中如何分布,这些细胞如何以旁分泌的方式释放信号等。考虑到代谢酶和代谢小分子能够发挥多种调节作用的特点,以肿瘤代谢为靶标开发新型的肿瘤治疗药物,将会成为未来肿瘤治疗领域新的研发热点,对于某些肿瘤的治疗有可能产生重大的突破。
