视听觉联合干预在改善住院新生儿头部转向偏好中的应用
2021-12-17郭宏卿谢安慰冉双芹
郭宏卿,谢安慰,冉双芹
(1.苏州大学附属儿童医院,江苏 苏州 215000;2.南京医科大学附属苏州科技城医院,江苏 苏州 215153)
新生儿头部转向偏好是指新生儿在仰卧位时头部持续转向一侧,和/或无法将头部保持在中线位置,其转到对侧的主动运动受限,不能保持被动旋转后的姿势[1]。头部转向偏好是引起姿势性斜头畸形的重要原因,且严重的头部转向偏好也会导致后期姿势不对称和运动不对称,影响新生儿家属的满意度。有研究表明,在矫正胎龄足月的早产儿中,头部转向偏好的发生率为44.8%,这些新生儿中斜头畸形的发生率为10.4%,且头部转向偏好与住院时间呈正相关[2]。有头部转向偏好的新生儿在6个月时发生斜头畸形的可能性是没有头部转向偏好新生儿的3倍[3]。目前临床上常用改变体位的方法预防或改善新生儿头部转向偏好,但存在定位效果欠佳等问题。团队前期的研究已表明,环境中的声音、光线等是住院新生儿头部转向偏好发生的重要影响因素,适当的环境干预可通过影响新生儿的行为来协助其维持被动的卧位[4]。基于此,本研究通过对住院新生儿的头部转向偏好进行视听觉联合干预,取得了较好的效果,现报道如下。
1 对象与方法
1.1 对象采用方便抽样法,选取2020年1—4月首次入住苏州大学附属儿童医院新生儿科的新生儿140例。纳入标准:胎龄≥32周,入院时日龄≤28 d;意识清醒,生命体征平稳;入院时具有一侧头部转向偏好。排除标准:先天性斜颈;头部、躯干部先天畸形;视觉疾病;听力障碍;肌力障碍性疾病、肌张力松弛、臂丛神经损伤;医嘱被动体位;重度窒息。剔除标准:不能判断头部转向偏好方向;新生儿科住院治疗时间≤7 d。采用查表法获取140个随机数字依次对应140例新生儿,随机数字从小到大进行排序,前70个随机数字对应的新生儿设为对照组,后70个随机数字对应的新生儿设为观察组。研究过程中剔除14例(13例新生儿住院时间<7 d,1例新生儿头部转向偏好时间经2次观察均为临界值而无法判断头部转向偏好),最终纳入分析的新生儿为对照组59例、观察组67例。两组新生儿性别、日龄、胎龄、头部转向偏向等比较,差异均无统计学意义(P>0.05),见表1。本研究通过医院伦理委员会审批(2016043),所有新生儿家属均签署知情同意书。
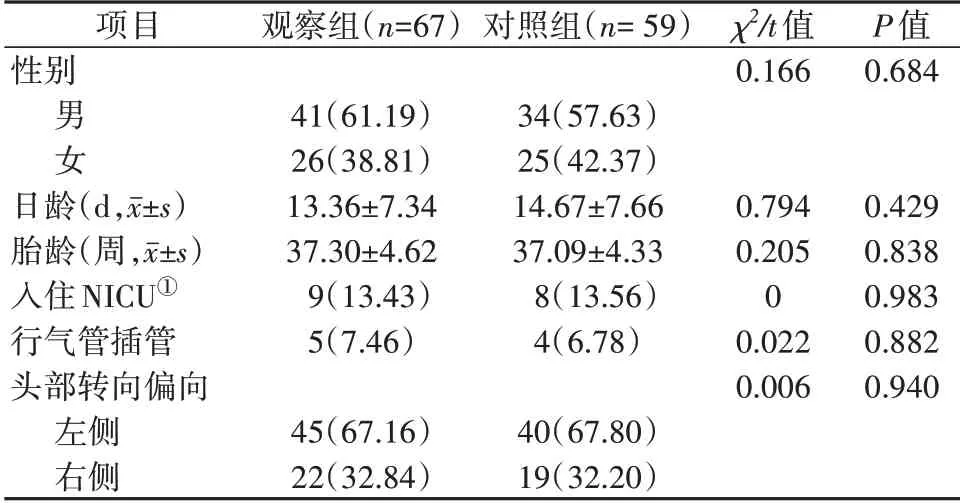
表1 两组新生儿一般资料比较 [n(%)]
1.2 方法
1.2.1 干预方法两组新生儿均给予常规护理及体位干预:从0点起每3 h更换体位1次,更换体位前先更换尿布,体位依次为左侧、平卧、右侧、平卧,以此循环;在侧卧位时减少头部转向偏好方向侧卧位1次,将其改为头部转向偏好方向的反方向侧卧位(干预体位),即每天平卧位4次、头部转向偏好同向侧卧位1次、头部转向偏好反向侧卧位(干预体位)3次;每天18:00至21:00,床位护士将新生儿置于头部转向偏好反向侧卧位(干预体位),并在更换体位后开启对准新生儿的摄像机进行拍摄;在暖箱中的新生儿每日调换头部朝向;如遇新生儿外出检查等特殊情况,则需要保证每天干预体位的时间不少于9 h;喂奶30 min后及时更换回原体位;新生儿哭闹时均使用安慰奶嘴进行安抚。两组新生儿均在头部转向偏好纠正后停止体位干预。观察组新生儿在对照组基础上实施视听觉联合干预,主要包括视觉干预和听觉干预两部分。
1.2.1.1 视觉干预研究小组通过网络寻找颜色鲜艳的5款卡通小动物或婴儿头像图案,彩色打印并裁剪成10 cm×14 cm的纸质图片。实施干预时,床位护士随机挑选1张图片贴在与新生儿头部转向偏好相反方向一侧的暖箱门上或小床边缘,尽量保持图片中心与新生儿眼部平齐,图片距离眼部约15~20 cm。图片长期放置,若该图片使用3 d后新生儿仍存在头部转向偏好,则更换其他图片再行干预。
1.2.1.2 听觉干预研究小组准备具有音量调节功能的播放器,如“米兔”“火火兔”等,设置成播放器自带儿歌、轻音乐等乐曲循环播放模式,调节音量至35~45分贝。实施干预时,床位护士将播放器放置于新生儿头部转向偏好方向的反方向,在不遮挡图片的情况上尽量靠近新生儿的头部。在新生儿处于干预体位且觉醒或哭闹状态时开启音乐播放器,在新生儿入睡后关闭播放器。床位护士及时记录时间、更换体位及音乐干预次数等资料。
1.2.2 观察指标及资料收集方法
1.2.2.1 头部转向偏好研究团队将Boere-Boonekamp等[5]头部转向判断方法进行改良,即在新生儿非睡眠状态时将其置于去枕平卧位,将新生儿仰卧的头及躯干置于中线位置,去除所有能够引起外部支撑的物品,如新生儿身上有外部管道则由护士将管道妥善固定并置于牵引作用最小的位置,观察10 min内新生儿头部的旋转及维持情况,在不同的时间段共观察3次,总计观察30 min,≥22.5 min内存在右侧或左侧转向,则判断为头部转向偏好。头部转向偏好的判定由经过培训和考核的2名人员(1名儿科医师及1名护士,或2名护士)同时进行判断,如有疑问或不能判断时则由2名以上研究小组成员再行判断。每天下午13:00至16:00,由经过培训的责任护士记录两组新生儿的头部转向偏好情况。记录内容包括:①头部转向偏好变化,连续记录7 d新生儿的头部转向偏好变化情况,分为有转向和无转向,转归率=无转向偏好例数/研究总例数×100%;②头部转向偏好方向改变,分为同向改变(头部转向偏好纠正后再一次发生与研究开始时同方向的头部转向偏好)和反向改变(头部转向偏好纠正后发生与研究开始时相反方向的转向偏好)。
1.2.2.2 入睡时间每天18:00至21:00,由1名研究小组成员采用调阅摄像监控的方式进行查阅并计算,另1名研究成员进行复核,新生儿第1次觉醒到睡着的时间计为入睡时间,以min为时间单位。
1.2.2.3 医源性相关因素使用研究小组自行设计的头部转向偏好调查表,收集日龄、性别、胎龄、是否入住NICU、出院诊断等一般资料,有创通气(常频或高频呼吸机)、无创通气(持续气道正压通气呼吸机)等辅助呼吸方式。如两种辅助方式均使用,则取其中使用天数长的一种辅助通气方式记录。
1.2.3 统计学方法研究人员对所有数据进行复核,采用SPSS 25.0软件进行统计分析。计量资料采用均数±标准差表示,如满足正态分布且方差齐,则采用独立样本t检验;如果不满足正态分布,则采用两独立样本的秩和检验(Mann-WhitneyU检验)。计数资料采用例数、百分比表示,若“理论频数≥5,且样本数≥40”,则采用Pearsonχ2检验(不校正)进行组间比较;若“1≤理论频数<5,且样本数≥40”,采用Yatesχ2检验(校正)比较;若“样本数<40,或理论频数<1”,采用Fisher’s精确概率法比较。所有检验结果以P<0.05为差异有统计学意义。
2 结果
2.1 两组新生儿干预7 d内头部转向偏好的变化情况及转归率比较研究第1、2、3天两组新生儿头部转向偏好转归率比较,差异均无统计学意义(P>0.05);从第4天起,观察组新生儿头部转向转归率高于对照组,差异均有统计学意义(P<0.05)。见表2。

表2 两组新生儿头部转向偏好变化情况及转归率比较
2.2 两组新生儿头部转向偏好方向改变情况干预7 d内,观察组新生儿头部转向偏好发生同向改变3例(4.48%)、反向改变4例(5.97%),对照组新生儿头部转向偏好发生同向改变2例(3.39%)、未发生反向改变。见表3。

表3 两组新生儿头部转向偏好方向改变情况[n(%)]
2.3 两组新生儿入睡时间的比较除第7天外,其余时间点两组新生儿入睡时间比较,差异均有统计学意义(P<0.05),见表4。
表4 两组新生儿入睡时间比较 (min,±s)

表4 两组新生儿入睡时间比较 (min,±s)
时间第1天第2天第3天第4天第5天第6天第7天观察组(n=67)5.19±3.38 5.08±3.21 5.12±3.14 5.25±3.30 5.01±4.17 4.81±3.62 5.20±3.68对照组(n=59)7.48±4.15 7.39±4.20 7.32±4.24 6.98±5.45 7.47±4.75 7.74±5.01 6.92±4.99 χ2值2.772 2.832 2.702 2.187 2.522 2.789 1.798 P值0.007 0.006 0.008 0.031 0.013 0.007 0.076
2.4 两组新生儿头部转向偏好转归的相关因素比较干预7 d后,根据头部转向偏好的转归情况将两组内新生儿分为有效组和无效组,两组的有效组及无效组之间分别进行相关因素比较,各相关因素对观察组新生儿头部转向偏好转归均无统计学意义(P>0.05),对照组中只有日龄对其头部转向偏好转归有统计学意义(P<0.05)。见表5。
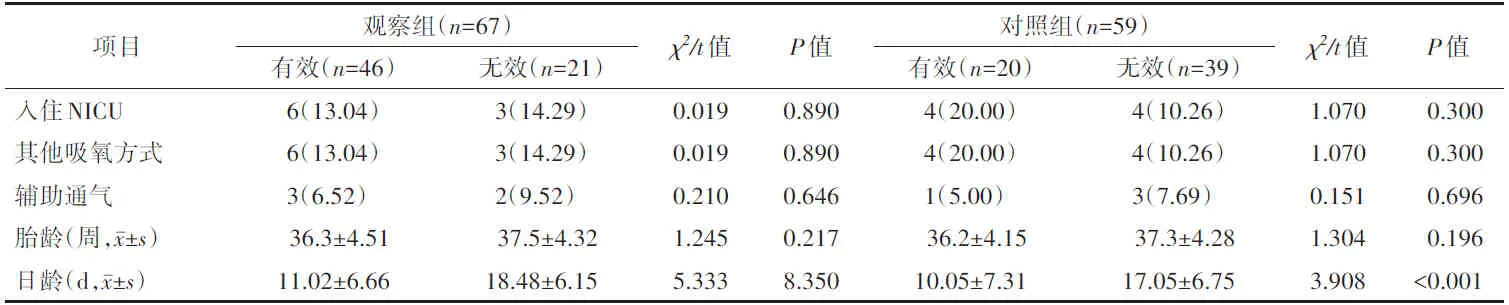
表5 干预7 d后两组新生儿头部转向偏好转归的相关因素比较 [n(%)]
3 讨论
3.1 视听觉联合干预内容具有科学性本研究采用的视听觉联合干预是基于新生儿一出生即具有视、听觉的能力,易受外界视觉、听觉和触觉等感知觉刺激影响的特点而设计的。中枢神经系统正常的新生儿在觉醒状态下能注视物体,且具备追视移动的物体和声音的“寻觅行为”,28周听觉发育良好的早产儿,对外界噪声刺激可反应为眨眼或惊跳[6]。虽然不会区分颜色,但新生儿对五颜六色的物品比对灰色物品更感兴趣[7]。因此,本研究选择图案鲜艳、丰富的卡通动物或婴儿头像的图片。新生儿调节视焦距能力不强,最佳视觉距离为15~25 cm[8],故本研究将图片放置在离新生儿眼睛15~20 cm的暖箱或小床边缘。新生儿有听力反射,听觉灵敏、喜高频,觉醒状态下的新生儿会向发声方向慢慢转头,但音频过强时新生儿会表现为头转离声源、大哭等抗拒行为[6]。NICU常处于高噪音水平,本研究采用35~45分贝的儿歌等音乐作为听觉干预媒介,因声音源离新生儿距离约15~20 cm,故噪音对音乐的影响不大,可使听觉干预不受噪音影响。
3.2 视听觉联合干预能有效改善新生儿头部转向偏好表2结果显示,观察组7 d内的头部转向转归率为68.66%,高于对照组的33.90%(P<0.05),说明视听觉联合干预配合体位干预对改善新生儿头部转向偏好的效果优于单纯改变体位的方法。新生儿具有头部骨质软、颅骨骨化不完全、骨缝未完全闭合、头部占比大的特点,一旦头部转向偏好发生,易导致斜头畸形,且两者互相影响,特别是头部比例更大、自行调整卧位能力更差的早产儿[2]。头部转向偏好一般在出生后短期内即可出现,其发生可能与早期新生儿自行调整卧位的能力欠佳有关,新生儿长时间头部被动转向一侧而造成习惯性头部转向。目前临床上常用新生儿睡姿矫正法纠正头部转向偏好[9],早产儿一般通过支撑物(如鸟巢等)来获取姿势的稳定性以固定体位,而住院足月儿很少使用全身支撑,因此不容易固定体位,特别是颈部活动能力增强的晚期足月儿,即使身处于对侧卧位也常习惯性自行转向偏好的一侧,导致住院期间睡姿矫正法效果不佳。听觉、视觉刺激均作用于大脑皮层,通过调节大脑皮质,使大脑皮层出现新的兴奋灶,从而影响人的高级神经活动和新生儿神经发育[10-11]。视听觉联合干预在体位固定时,新生儿在柔和的音乐及色彩鲜艳图案的视觉、听觉刺激下,头部通过寻觅声音和感知图案而转向图片和声音的一侧,进而协助维持其被动体位的稳定性,进而达到纠正头部转向偏好的效果。
3.3 视听觉联合干预有助于缩短新生儿的入睡时间音乐疗法能促进内啡肽物质的释放,增强副交感神经系统活动[10]。施子霞[12]的研究显示,音乐治疗对改善NICU早产儿的生命体征、促进生长发育、延长睡眠时间具有较好的效果。表4结果显示,除第7天外,观察组新生儿的入睡时间均短于对照组(P<0.05),说明听觉干预能够安抚新生儿情绪、缩短入睡时间,与廖金花等[13]研究结果一致,且缩短入睡时间也有助于巩固入睡时的头部定位。有研究表明,新生儿对不同音乐反应不同,海洋音乐有模拟子宫环境的效果[14]、现场音乐更具感召力[15]、母亲的声音能带来更多的积极情绪[16]。今后研究可探讨不同音乐对新生儿头部转向偏好的干预效果差异。
3.4 视听觉联合干预受医源性因素影响小表5显示,除对照组的日龄外(P<0.05),其他相关因素均对纠正住院新生儿头部转向偏好无统计学意义(P>0.05),提示视听觉联合干预受NICU的环境、辅助通气仪器设备等医源性因素的影响较小,也可能与纳入辅助呼吸、吸氧等影响因素的例数较少有关。王美芬[17]的研究认为,胎龄较小的低出生体重儿对“咯咯”声的反应、对红球反应、对说话人脸的反应等行为能力相对较差,但会随着日龄的增加逐渐恢复。故视听联合干预作用于日龄较大的新生儿更为有效,也可能与新生儿的各项发育有关。有研究表明,出生1周内的新生儿听觉、视觉和触觉刺激的反应在右侧好于左侧,而姿势与反应性有关,这种差异增强了右侧头部转向偏好[18]。本研究对象头部右侧转向偏好多于左侧,故大多数新生儿从左侧进行视听觉刺激,对刺激方向间的差异性本文尚未进行分析,今后研究可进一步探讨。
3.5 视听觉联合干预的注意事项①视听觉干预物品的选择和放置。新生儿对视觉刺激没有适应性,然而长时间注视同一种物体会导致其兴趣降低。一项行为学研究发现,新生儿对高兴面孔的注视时间较恐惧面孔的注视时间更长[19]。故选择视觉干预物品时可经常更换不同的图片以保持新生儿的兴趣,尽量选择鲜艳的动物或高兴面孔的图片。新生儿视觉范围窄,且随着日龄的增大其视网膜和皮质逐渐成熟,视觉范围逐渐增大[20]。因此,图片应尽量置于中间视野。②避免干预过度。本研究中有少部分新生儿在头部转向偏好纠正后再次出现头部转向偏好,最早者于第3天出现,且观察组新生儿从第5天开始部分新生儿出现头部转向偏好方向的改变,而对照组无头部转向偏好方向改变,虽然差异无统计学意义(P>0.05),但仍提示在进行视听觉联合干预时可能存在过度干预的情况,也可能与新生儿习惯性找寻声音和图片有关。因此,在干预后期,护士应增加评估频次,在头部转向偏好纠正后应及时停止干预,避免干预过度。
4 小结
视听觉联合干预对改善住院新生儿头部转向偏好具有较好的效果,能够缩短新生儿的入睡时间,且不受其他医源性因素影响。然而在实施过程中应注意选择合适的音乐和图片,注意按时评估,避免干预过度。本研究未分析不同头部转向偏好方向之间的效果差异,后期将进一步增加样本量予以深入探讨,并尝试增加味觉、触觉等干预方法,以期为纠正新生儿头部转向偏好提供更多可行的方法。
