Ca2+对植物乳杆菌LIP-1冷冻干燥抗性的影响及其在热饮中的应用
2021-12-17满都呼薛舒苑刘嘉媛修玉凤马思楠刘泽西王俊国
满都呼,薛舒苑,刘嘉媛,修玉凤,马思楠,刘泽西,王俊国
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
益生菌是一类通过改善宿主体内微生态平衡,进而促进宿主健康的微生物[1]。现在市面上的益生菌制剂多采用真空冷冻干燥法制备,因为真空冷冻干燥法制备的益生菌具有活菌数较高、保质期较长和运输成本较低的特点,所以该技术常应用于工业生产中[2]。冻干过程中不可避免会造成菌体损伤,导致菌株失活,影响产品 性能[3]。目前的研究表明,改变培养基成分能够有效提高菌株的冷冻干燥存活率。Li Chun等[4]的研究发现,改变培养基中碳源成分能够提高保加利亚乳杆菌的冷冻干燥存活率。杨弋[5]的研究发现,将镁离子加入培养基能够增强菌株的耐热能力。Schindler等[6]的研究证明,加入钙离子能够提高保加利亚乳杆菌的冷冻干燥抗性。
益生菌制剂的使用温度有严格限制,目前市场上80%的益生菌制剂需用40 ℃以下的温水冲泡,超过45 ℃,产品活菌数大幅度降低,最终影响产品的益生特性[7]。因此如何提高益生菌制剂在热饮中的活菌数成为科研人员开发益生菌及其相关制品时的重点研究内容。
目前关于提高冻干菌粉在热饮中存活率的研究近乎空白,因此,为提高菌株的冷冻干燥抗性和耐热性,本研究以1 株具有降血脂益生功能的植物乳杆菌LIP-1为研究对象,通过在培养基中添加不同浓度的CaCl2,探究 Ca2+对菌株冷冻干燥抗性和耐热性的影响,最后比较未加钙菌粉、加钙菌粉和未加钙市售菌粉在不同热饮中的活菌数,并探究内在机制,为提高益生菌制剂在热饮中的存活率提供理论基础与数据支持。
1 材料与方法
1.1 材料与试剂
选取分离自新疆自然发酵酸马乳、拥有良好耐酸耐胆盐特性和较强降胆固醇活性的植物乳杆菌LIP-1(Lactobacillus plantarumLIP-1)为研究对象,该菌株由内蒙古农业大学乳品生物技术与工程教育部重点实验室提供[8]。
热饮选择市面常见的6 类饮品:阿萨姆奶茶 统一企业中国控股有限公司;矿泉水、东方树叶茶饮料 农夫山 泉股份有限公司;原味咖啡 雀巢公司;美汁源橙汁 可口可乐(中国)投资有限公司;利乐无菌包纯牛乳 伊利集团;菌粉(配料:食用玉米淀粉、白砂糖、低聚果糖、脱脂乳粉、植物乳杆菌,活菌数1010CFU/g) 市售。
无水CaCl2(分析纯) 天津永晟精细化工有限 公司;青霉素G(色谱纯) 北京索莱宝科技有限公司; 正己烷(色谱纯) 天津福晨化学试剂有限公司;甲醇(色谱纯) 天津光复科技发展有限公司;质量分数30%甲醇钠溶液(色谱纯)、氯仿(色谱纯) 上海麦克林生化科技有限公司。
1.2 仪器与设备
DF-101S磁力搅拌水浴锅 郑州予华仪器制造有限公司;移液枪、Centrifuge-5810R高速离心机 德国Eppendorf公司;MLS-3750灭菌锅、STAC-S45F恒温培养箱 日本三洋公司;ZHJH-1214B超净工作台 南京依贝仪器设备有限公司;FD-1A-50真空冷冻干燥机 北京 博医康实验仪器有限公司;DW-86L388J医用低温保 存箱 青岛海尔特种电器有限公司;MOV-212S干热灭菌箱 日本松下公司;ND100-1干式氮吹仪 南京肯凡电子科技有限公司;Technologies 6850气相色谱仪 安捷伦科技(上海)有限公司。
1.3 方法
1.3.1 菌种活化
将植物乳杆菌LIP-1以体积分数2%接种量接种于MRS液体培养基,于37 ℃培养箱中培养18 h,连续培养3 代,将活化的菌株置于4 ℃保存备用。
MRS培养基配制:大豆蛋白胨10.0 g、牛肉浸膏10.0 g、酵母粉5.0 g、葡萄糖20.0 g、无水乙酸钠10.0 g、无水磷酸氢二钾2.0 g、五水硫酸锰0.05 g、七水硫酸镁0.2 g、吐温-80 1.0 g、柠檬酸钠2.0 g、蒸馏水1 000 mL,将上述试剂充分混匀,121 ℃灭菌15 min;MRS固体培养基在MRS的基础上添加1%琼脂,121 ℃灭菌15 min。
1.3.2 Ca2+对植物乳杆菌LIP-1生长的影响
分别将0.0、0.5、1.0、1.5、2.0 mmol/L CaCl2加入到MRS液体培养基中,配制成不同Ca2+浓度的培养基。将活化好的菌株以4%接种量接入Ca2+培养基中,于37 ℃培养箱中培养18 h,将培养好的菌株采用稀释平板计数法计算活菌数。
1.3.3 真空冷冻干燥
将Ca2+培养基中收集的0.1 g菌泥中加入2 mL灭菌脱脂乳,充分混匀后置于-80 ℃超低温冰箱中预冻24 h。预冻后的样品置于真空冷冻干燥机中冻干,冻干条件:冷阱温度-45 ℃,真空度20 Pa,冻干时间24 h。采用稀释平板计数法计算冻干菌粉活菌数。冷冻干燥存活率按式(1)计算。
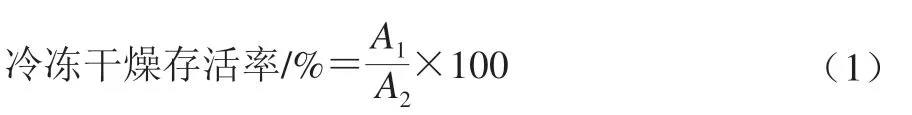
式中:A1为经真空冷冻干燥后活菌数/(108CFU/mL);A2为真空冷冻干燥前活菌数/(108CFU/mL)。
以冻干菌粉活菌数与冷冻干燥存活率为指标筛选 Ca2+最佳添加浓度。
1.3.4 最佳浓度Ca2+对冻干菌粉耐热性的影响
菌株热致死处理指的是在一定温度、时间条件下处理后菌株存活率低于10%的处理[9]。植物乳杆菌LIP-1的热致死温度为75 ℃,热致死时间为30 s[10]。首先对菌株进行热致死处理,评价最佳浓度Ca2+对冻干菌粉耐热性的影响。以筛选出的最佳浓度Ca2+组为实验组,以未添加Ca2+组为对照组,将2 组冻干菌粉用生理盐水等体积复溶,置于75 ℃水浴锅中30 s热致死处理后,进行平板计数。
1.3.5 菌粉在不同热饮中耐热存活率的测定
以最佳浓度Ca2+培养的植物乳杆菌LIP-1制备的加钙冻干菌粉(实验组)、未加钙菌粉(对照组)和市售菌粉为实验对象,每组取0.1 g菌粉,分别添加到5 mL 55 ℃矿泉水、咖啡、果汁、牛乳、奶茶和茶饮料中,在热饮适口温度(55 ℃)下水浴加热5 min,通过平板计数法测定各组菌粉的活菌数,并计算实验组与对照组菌粉的耐热存活率。耐热存活率按式(2)计算。

1.3.6 细胞损伤评价
采用青霉素G和NaCl敏感性实验对3 组菌粉进行细胞壁和细胞膜损伤评价[11]。所有敏感性实验均采用植物乳杆菌LIP-1的NaCl及青霉素G最低抑菌浓度。NaCl-MRS选择性固体培养基即MRS培养基中添加0.5 mol/L NaCl,121 ℃灭菌15 min;青霉素G-MRS选择性固体培养基即MRS培养基121 ℃灭菌15 min后,添加7.5 μg/L青霉素G(已过滤灭菌)。
1.3.7 细胞膜脂肪酸的测定
参考Bligh等[12]的方法。用5 mL无菌去离子水对3 组菌粉进行复溶,然后使用5 mL生理盐水洗菌3 次(4 000 r/min、4 ℃、5 min);称取洗后的菌泥0.5 g,加入1.9 mL氯仿-甲醇(体积比1∶2)溶液,连续振荡15 min,再加入氯仿及去离子水各0.625 mL,再次振荡15 min,将混合均匀的样品在4 ℃、8 000 r/min条件下离心10 min;吸取下层液相,转移至无菌离心管中,氮吹至干,再加入1 mL 1 mol/L甲醇钠-甲醇溶液,冰浴后振荡5 min;最后加入0.625 mL正己烷振荡混匀,在4 ℃、8 000 r/min条件下离心5 min,吸取上清液,使用有机滤膜将液体移入气相色谱进样瓶中。
气相色谱条件:DB-WAX毛细管色谱柱(60 m×0.25 μm,0.25 mm);进样口温度250 ℃;检测口温度260 ℃;氮气分流比5∶1,流速1 mL/min;柱温程序:初始温度80 ℃,升温速率6.5 ℃/min,升至170 ℃,升温速率转为27.5 ℃/min,升至215 ℃保持2 min,升温速率再转为40 ℃/min,升至230 ℃保持2 min;进样量3 μL。采用峰面积归一法计算脂肪酸相对含量。
1.4 数据处理
实验均平行测定3 次,结果表示为平均值±标准差。应用SPSS软件进行显著性分析,并使用Origin 2018与Excel软件绘图。
2 结果与分析
2.1 不同浓度Ca2+对植物乳杆菌LIP-1活菌数及冷冻干燥存活率的影响
由图1可知,不同浓度Ca2+对植物乳杆菌LIP-1的活菌数与冷冻干燥存活率有不同影响。未添加Ca2+的对照组活菌数为(9.53±0.03)(lg(CFU/mL)),当Ca2+浓度达到0.5 mmol/L时,菌株的活菌数最高,达到(9.61±0.03)(lg(CFU/mL)),显著高于对照组 (P<0.05)。随着Ca2+浓度高于0.5 mmol/L,菌株的活菌数逐渐降低。冷冻干燥存活率方面,与对照组相比,添加Ca2+组冷冻干燥存活率均显著提高(P<0.05),且随Ca2+浓度的增加呈先升高后降低的趋势,Ca2+浓度为1.0 mmol/L时达到最高。但与菌株活菌数结合考虑,Ca2+浓度为0.5 mmol/L时,冷冻干燥后具有更高的活菌数,故将Ca2+浓度0.5 mmol/L组作为最优组别。
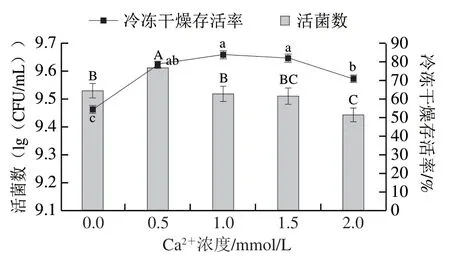
图1 不同浓度Ca2+对植物乳杆菌LIP-1活菌数与冷冻干燥存活率的影响Fig. 1 Effect of different concentrations of Ca2+ on the viability and freeze-drying survival of Lactobacillus plantarum LIP-1
2.2 最佳浓度Ca2+对冻干菌粉耐热性的影响
为进一步探究Ca2+对菌株耐热性的影响,本研究选取活菌数与冷冻干燥存活率均为最高的0.5 mmol/L Ca2+组为实验组,以未添加Ca2+为对照组。首先通过热致死实验来判断对照组与实验组菌株是否具有耐热性。
由图2可知,未添加Ca2+的对照组热致死处理后的活菌数为(8.26±0.12)(lg(CFU/mL)),而添加Ca2+的实验组经过热致死处理后活菌数为 (8.95±0.18)(lg(CFU/mL)),显著高于对照组 (P<0.05),证明培养基中添加Ca2+能够提高植物乳杆菌LIP-1的耐热性。

图2 最佳浓度Ca2+菌粉热致死前后的活菌数Fig. 2 Viable counts of freeze-dried cells of LIP-1 with added Ca2+ at optimized concentration before and after thermal treatment
2.3 菌粉在不同热饮中的耐热性评价
尽管现阶段实验证明,加入Ca2+培养的植物乳杆菌LIP-1具有一定的耐热性,但其能否在各类热饮中维持较好的耐热性和存活率,仍需要通过实验来验证。
由于饮用水温过高会烫伤食道黏膜[13],同时本实验室前期研究发现,大众对55 ℃左右热饮的接受程度最高,因此将实验组、对照组和市售菌粉分别添加到55 ℃的矿泉水、茶饮料、咖啡、果汁、奶茶和牛乳中保持5 min,得出各组菌粉在不同热饮中的活菌数。由图3可知,在上述6 类热饮中,3 组菌粉活菌数出现了同样的变化趋势,实验组的活菌数均显著高于对照组和市售菌粉组(P<0.05),说明0.5 mmol/L Ca2+的加入能够有效提高菌粉在各类热饮中的存活率。
3 组菌粉在矿泉水中的活菌数最低,这是由于矿泉水中缺乏保护物质,不能在热处理时为菌株提供更好的环境,导致菌体大量死亡[14];茶饮料中3 组菌粉的活菌数显著高于矿泉水(P<0.05),这可能是因为茶饮料中的茶多酚在一定程度上减轻了菌株受到的热损伤[15];3 组菌粉在咖啡和果汁中的活菌数显著高于矿泉水和茶饮料(P<0.05),这可能是因为咖啡和果汁中含有大量糖类物质,能够在一定程度上对菌株起到保护作用[16]; 3 组菌粉在奶茶和牛乳中活菌数显著高于其他组别 (P<0.05),这可能是由于这2 种热饮中富含蛋白质、脂质和糖类,能够对菌株起到较好的保护作用[17]。
上述实验中发现,3 组菌粉在矿泉水中的活菌数显著低于其他组(P<0.05),因此选择矿泉水进行后续实验,可以排除糖类、脂质和蛋白质类等物质对菌株的保护。接下来将进一步探究实验组耐热性提高的内在机制。首先对在矿泉水中55 ℃处理5 min的3 组菌粉进行细胞损伤评价。
2.4 3 种菌粉植物乳杆菌细胞壁和细胞膜的损伤评价
当菌株的细胞壁发生损伤时,青霉素G能够进入细胞,导致菌株死亡;当细胞膜发生损伤时,NaCl能够进入细胞,导致菌株死亡,因此采用敏感性实验来判断菌株细胞壁和细胞膜的损伤程度[18]。
由图4可知,青霉素G敏感性实验结果显示,热处理后实验组菌粉的活菌数为(8.43±0.04)(lg(CFU/mL)), 对照组菌粉的活菌数为(8.01±0.03)(lg(CFU/mL)), 市售菌粉活菌数为(7.89±0.05)(lg(CFU/mL)),实验组菌粉显著高于其他2 组菌粉(P<0.05),表明实验组菌粉的植物乳杆菌细胞壁损伤程度较轻。NaCl敏感性实验结果显示,热处理后实验组菌粉活菌数为(8.22±0.06)(lg(CFU/mL)),对照组菌粉和市售菌粉分别为(7.67±0.05)、(7.41±0.04)(lg(CFU/mL)), 实验组菌粉显著高于其他2 组菌粉(P<0.05),表明实验组菌粉的植物乳杆菌细胞膜损伤程度较轻。由于菌粉在热致死后对NaCl更加敏感,表明植物乳杆菌细胞膜在热致死过程中受到的损伤更大。
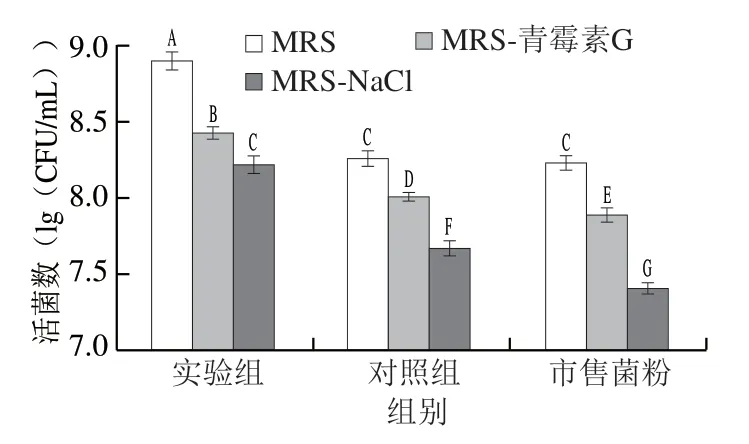
图4 3 种菌粉植物乳杆菌细胞壁与细胞膜的损伤评价Fig. 4 Evaluation of cell wall and cell membrane damage of three freeze-dried bacterial cultures
2.5 3 种菌粉植物乳杆菌细胞膜脂肪酸组成
相关研究表明,细胞膜脂肪酸是影响细胞膜完整性的关键因素,因此本研究对3 种菌粉植物乳杆菌细胞膜脂肪酸进行测定[19]。
当乳酸菌处于不利环境时,菌株为了维持细胞膜的完整性会改变细胞膜脂肪酸的成分及含量。乳酸菌细胞膜脂肪酸的碳链长短、饱和度及环丙烷脂肪酸的含量均对乳酸菌的抗逆性有影响[20]。对于3 种菌粉经热处理后的植物乳杆菌细胞膜脂肪酸成分及相对含量,由表1 可知,实验组菌粉月桂酸(C12:0)、棕榈酸(C16:0)、顺-9-十六碳烯酸(C16:1n-7)、硬脂酸(C18:0)、γ-亚麻酸(C18:3n-6)、反-亚油酸(C18:2n-6t)相对含量较其他2 组菌粉降低,亚油酸(C18:2n-6c)、环丙烷脂肪酸(C19cyc11)、花生酸(C20:0)、顺-11,14-二十碳二烯酸(C20:2n-6)、顺-5,8,11,14,17-二十碳五烯酸(C20:5n-3)和顺-4,7,10,13,16,19-二十二碳六烯酸(C22:6n-3)相对含量与对照组相比升高。此外,在实验组中检测出2 组长链不饱和脂肪酸C20:5n-3和C22:6n-3。
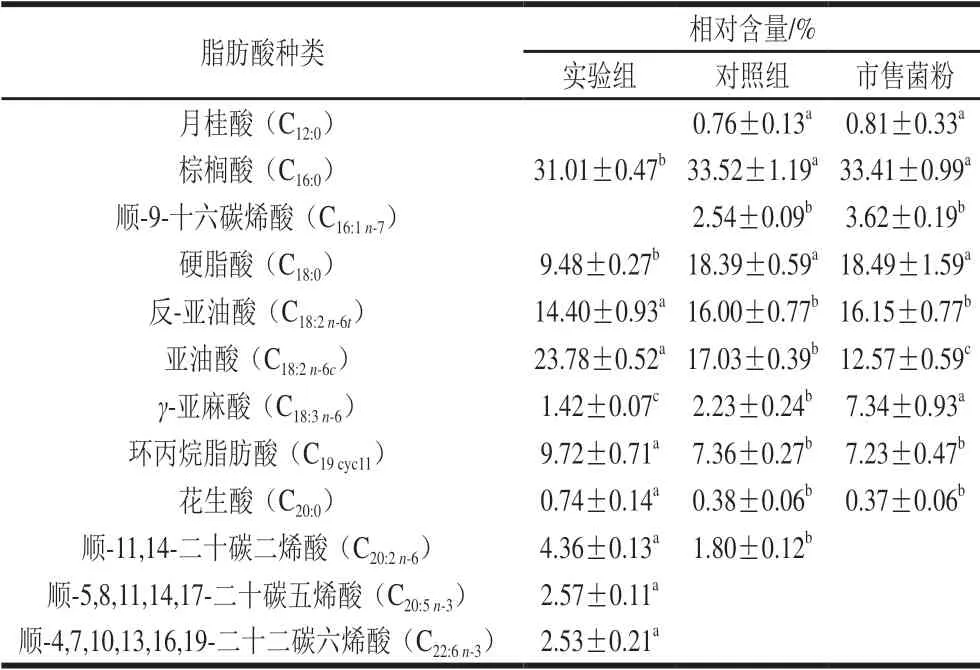
表1 3 种菌粉的植物乳杆菌细胞膜脂肪酸组成Table 1 Fatty acid composition of cell membranes of three freeze-dried bacterial cultures
实验组菌粉的植物乳杆菌细胞膜脂肪酸不饱和度显著高于其他2 组,表明Ca2+能够提高菌株热处理后的细胞膜脂肪酸不饱和度。实验组菌粉的植物乳杆菌细胞膜环丙烷脂肪酸相对含量为(9.72±0.71)%,显著高于其他2 组 (P<0.05)。上述结果表明,加入适宜浓度Ca2+能够帮助植物乳杆菌菌株调整细胞膜不饱和脂肪酸和环丙烷脂肪酸相对含量,进而提高冻干菌粉的植物乳杆菌耐热性。
3 结 论
为提高菌株植物乳杆菌LIP-1的冷冻干燥抗性和在热饮中的存活率,向培养基中添加不同浓度的CaCl2。结果表明:培养基中添加0.5 mmol/L Ca2+能够提高植物乳杆菌LIP-1的冷冻干燥抗性和耐热性;将加钙菌粉、未加钙菌粉和市售菌粉加入不同热饮中进行耐热性评价,证明Ca2+能够提高菌株在不同热饮中的耐热性;对菌株进行损伤评价后发现,细胞膜损伤是菌株在热饮中死亡的主要原因,探究内在机制发现,Ca2+能够提高细胞膜不饱和脂肪酸及环丙烷脂肪酸的相对含量,减小细胞膜损伤,提高菌株的冷热抗性。本研究为植物乳杆菌LIP-1冻干菌粉在热饮中的应用提供了理论参考与数据支持。
