双酚A 对猪肾细胞炎性因子表达及凋亡的影响
2021-12-17汪序忠周晓龙杨松柏李向臣
周 羽,刘 媛,汪序忠,周晓龙,杨松柏,段 星,宋 丹*,李向臣
(1.浙江农林大学动物科技学院动物医学院,浙江杭州 311300;2.浙江省畜禽绿色生态健康养殖应用技术研究重点实验室,浙江杭州 311300;3.浙江省安吉振望农牧科技有限公司,浙江湖州 313300)
双酚A(BPA)是环境内分泌干扰物,也是一种重要的有机化工原料,已大量应用于生活塑料制品制造以及食品金属包装表面涂层等。BPA 的大量生产和广泛应用也使得BPA 在环境中普遍存在。BPA 能够通过消化道、呼吸道和皮肤吸收进入生物体体内[1],通过与雌激素受体、雄激素受体、甲状腺素受体等多种生物受体相互作用,进而干扰生殖系统、内分泌系统、免疫系统、神经系统、代谢功能,以及对后代的生长和发育造成健康危害[2]。已有研究证明BPA 有毒和严重的不确定副作用,可能是发展成乳腺癌、前列腺癌、卵巢癌、肺癌等癌症的危险因素[3]。研究报道,环境中所含的BPA 能够降低雄鼠的精子数量、活力,造成精子DNA 损伤[4]。子宫长期暴露于低剂量的BPA(1 μg/kg/day)会引起雌鼠成年时期输卵管病变[5],高剂量的BPA(100mg/kg/day)会导致胚胎发育迟缓,发育不全[6]。美国食品和药物管理局(FDA)确定5 mg/kg BPA 为未观察到全身毒性副作用的适当水平。已证明,50 mg/kg 的BPA 是造成大鼠肾脏功能中度损伤的最低剂量,并且用于模拟职业工人所暴露的BPA 量[7]。此外,流行病学研究表明,在成年人和儿童尿液中高水平的BPA 与低度蛋白尿风险有关,这也提醒人们注意日常生活中暴露于BPA 可能对肾脏产生不利影响,并可能导致终身累进性肾脏损伤[8]。
目前对于BPA 的研究大部分集中在对动物和人体生殖系统的影响,对肾脏功能的研究较少,特别是对于猪肾脏损伤的研究尚未见报道。因此,本试验以猪肾细胞(PK15)为试验材料,检测BPA 对细胞活力、凋亡、炎性因子表达以及ROS 含量的影响,探讨BPA 在猪肾细胞的毒性作用,并揭示其引起肾损伤的可能作用机理,不仅为进一步了解BPA 暴露的毒性作用机理提供科学依据,而且为评估和预防BPA 对猪机体的毒性作用提供参考,进而促进畜牧业的可持续发展。
1 材料与方法
1.1 主要试剂 双酚A:纯度>99.8%,购自上海阿拉丁生化科技股份有限公司;DMEM 高糖培养基、磷酸盐缓冲液(PBS)购自美国Hyclone 公司;胎牛血清购自德国PAN-Biotech 公司;青链霉素双抗购自北京CellMax 细胞技术有限公司;胰蛋白酶购自美国Gibco公司;DL2000 Plus DNA Marker 购自南京Vazyme 生物技术有限公司;二甲基亚砜(DMSO),多聚甲醛购自北京索莱宝科技有限公司;ROS 试剂盒购自美国Sigma 公司;Hoechst33258 细胞凋亡染色试剂盒购自上海碧云天生物技术有限公司;Trizol、反转录试剂盒、荧光定量PCR 试剂盒购自TaKaRa 公司。
1.2 主要仪器 试验仪器主要包括CO2细胞培养箱、全波长酶标仪、梯度PCR 热循环仪、荧光定量 PCR 仪(Thermo Electron Corporation)、激光共聚焦荧光显微镜(Nikon)、超净工作台(青岛海尔特种电器有限公司)、微量核酸蛋白浓度测定仪(杭州奥盛仪器有限公司)、台式高速离心机(香港力康发展有限公司)、倒置相差显微镜(重庆奥特光学仪器有限责任公司)。
1.3 细胞培养 PK15 细胞在补充有10% 胎牛血清(FBS)和1%青霉素-链霉素的DMEM 高糖培养基,37℃、5% CO2恒温培养箱中培养。当细胞长满时,将细胞培养于6 孔细胞培养板中,根据试验设计进行BPA处理。
1.4 细胞活力测定 细胞约以 1×105个/mL 浓度接入96孔板,待细胞融合度达到70%~80%,设置不同浓度的BPA (0、1、10、100、200、500 和1 000 μmol/L) 处理,然后设置不同时间梯度(0、2、4、6 h)处理,加入CCK-8 试剂孵育2 h,使用酶标仪读取450 nm 吸光度,以测定细胞活力并确定最适BPA 处理浓度和处理时间。
1.5 RNA 的提取、引物鉴定和qRT-PCR 分析 使用Trizol 试剂提取PK15 细胞中总RNA,使用TaKaRa反转录试剂盒将RNA 反转录为 cDNA。以所得cDNA为模板,利用内参基因GAPDH 作为对照,进行PCR 扩增,琼脂糖凝胶电泳检测cDNA 质量。使用10×EasyTaqPCR SuperMix 进行 PCR 反应,琼脂糖凝胶电泳验证炎性和凋亡相关基因的引物扩增条带大小和特异性。所有引物退火温度均调整为61℃,PCR 扩增条件为 95 ℃ 1 min;95 ℃ 10 s,61 ℃ 5 s,72 ℃ 15 s,40 个循环;72℃ 5 min。根据TaKaRa 反转录试剂盒以及荧光定量PCR 试剂盒说明书混合反应体系,在荧光定量PCR 仪上进行基因表达分析。各基因引物序列见表1。

表1 定量引物序列
1.6 ROS 染色检测 以2',7' -二氯二氢荧光素二乙酸酯(DCFH-DA)来评估ROS 含量。DCFH-DA 是一种细胞通透性非荧光探针,它在细胞内去酯化,被ROS氧化后转化为高度荧光的2',7'-二氯荧光素。PK15 细胞置于六孔板内培养,200 μmol/L 的BPA 处理6 h,10 μmol/L DCFH-DA 37℃暗箱孵育30 min,孵育后用PBS 反复清洗去除多余的染色液即可置于激光扫描共聚焦显微镜下观察。
1.7 Hoechst33258 染色 细胞以 1×105个/mL 浓度接入放有细胞爬片的6 孔板。当细胞融合度达到70%~80%时,用200 μmol/L BPA 处理试验组6 h,对照组不做处理。处理后,用4%多聚甲醛室温固定细胞10 min,去除固定液,PBS 反复清洗后加入0.5 mL Hoechst 染色液,染色5 min。去除染色液,PBS 反复清洗,加抗荧光淬灭封片液于载玻片上,封片,在激光共聚焦显微镜下观察并拍照。
1.8 统计分析 试验数据以均数±标准误表示。根据具体试验,数据分析采用单因素方差(ANOVA)分析不同组间差异或学生t检验分析两组之间的差异。使用Graphpad Prism 软件绘制图表。P<0.05 代表差异显著,有统计学意义。
2 结果
2.1 BPA 对PK15 细胞活力的影响 用不同浓度的BPA处理PK15 细胞,CCK-8 检测细胞活力如图1-A 所示,随着BPA 浓度的增加,细胞活力呈剂量依赖性降低。与对照组相比,当BPA 浓度大于等于200 μmol/L 时,PK15 细胞的活力下降(P<0.001)。然后设置不同的时间梯度),选用200 μmol/L BPA 处理PK15 细胞,结果如图1-B 所示,随着处理时间的延长,细胞活力越低,且在处理6 h 时降低(P<0.001)。

图1 BPA 对PK15 细胞活力的影响
2.2 RNA 的提取及cDNA 的制备 使用Trizol 溶液提取PK15 细胞总RNA,利用微量核酸蛋白浓度测定仪测定RNA 浓度后进行琼脂糖凝胶电泳分析,发现28S,18S 和5S 条带均较清晰,且28S 最亮,5S 最浅(图2-A)。随后,将总RNA 反转录成cDNA,以获得的cDNA 为模板利用内参基因GAPDH进行PCR 扩增,结果显示扩增条带单一,且大小符合预期(图2-B)。

图2 RNA 和cDNA 的琼脂糖凝胶电泳
2.3 普通PCR 验证引物特异性 如图3 所示,炎性相关因子基因的引物扩增条带中总有一条大小符合预期,且条带清晰而单一(图3-A),凋亡相关基因的引物扩增条带也符合预期(图3-B)。
图3 引物验证的琼脂糖凝胶电泳
2.4 BPA 对PK15 细胞中炎性相关基因表达的影响 如图4 所示,与对照组相比,200 μmol/L BPA 处理PK15细胞6 h 后,炎性因子相关基因IL-8、IL-6、TNF-αmRNA 相对表达量升高(P<0.05),IL-1βmRNA 呈现上升趋势(P>0.05)。

图4 BPA 对PK15 细胞中炎性相关基因表达的影响
2.5 BPA 对PK15 细胞凋亡的影响 如图5-A 所示,与对照组相比,BPA 处理后促凋亡基因Caspase3和BAXmRNA 相对表达量增加(P<0.01),抗凋亡基因BCL-2mRNA 相对表达量下降(P<0.01)。免疫荧光染色结果显示,对照组中没有明显凋亡细胞,染色均匀,细胞呈现弱淡蓝色荧光;而BPA 处理组中见具有凋亡特征的细胞,细胞核凝结,且呈现强蓝色荧光(图5-B)。

图5 BPA 对PK15 细胞凋亡的影响
2.6 BPA 对PK15 细胞中ROS 水平的影响 如图6 所示,与对照组相比,BPA 处理组的ROS 荧光强度增强(P<0.001)。
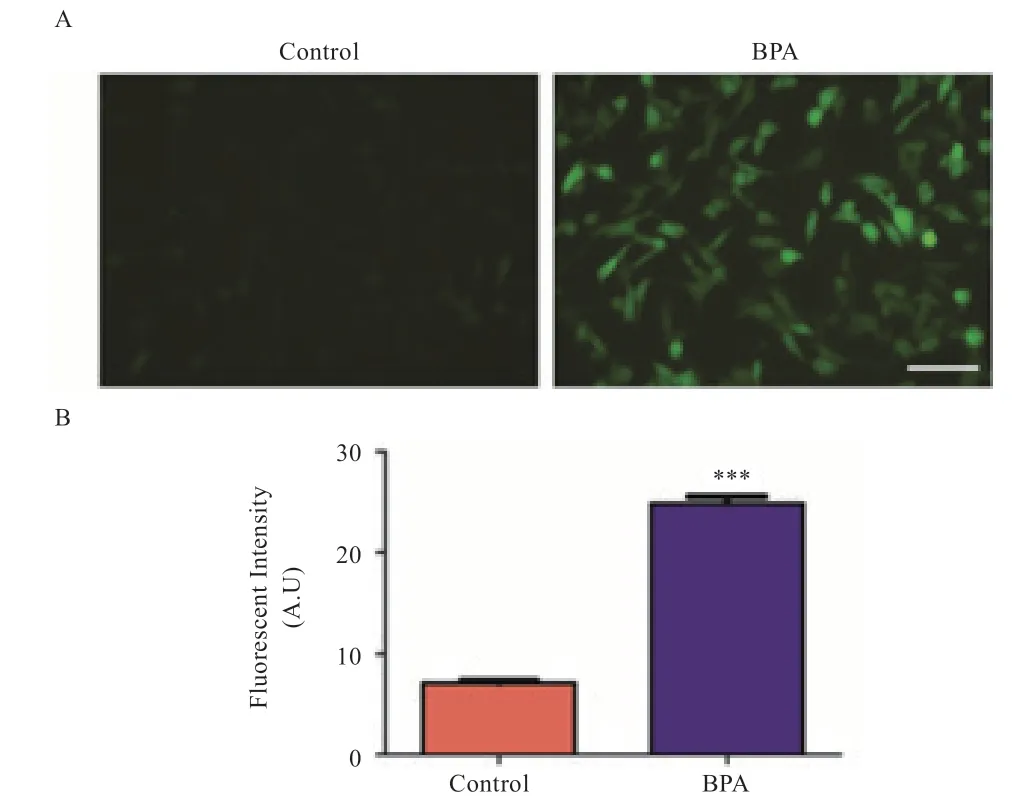
图6 BPA 对PK15 细胞中ROS 水平的影响
3 讨 论
BPA 是公认的环境污染物,对人和动物机体的生殖系统、胚胎发育、神经系统、免疫系统等多方面均具有不利影响,对肝、肾、脾和肺等器官有严重的毒性作用,如BPA 诱导人体肝脏脂质积累,促进非酒精性脂肪肝的发展[9]。低剂量BPA(0.1 μg/mL)能够加重小鼠肺炎症反应,导致免疫功能异常[10];高剂量BPA(400 mg/kg)大鼠脾脏组织中淋巴滤泡显著减小,红髓面积增大,白髓面积减小[11]。肾脏是动物机体重要的器官,维持整个机体的稳态,其功能单位肾元通过三层结构的毛细血管壁,由肾小球滤过将血液和尿液中的杂质和有害物质排出体外,并通过重吸收以维持体液的体积和含量。所以一旦肾脏出现问题,机体内的有毒物质排不出去,有很大安全隐患。本试验结果表明,高浓度的BPA 能够显著降低PK15 细胞活力,增加凋亡的细胞数,促进炎性相关因子的表达以及增加细胞内ROS 含量。这是关于BPA 对猪肾细胞损伤的首次报道,本研究提供了BPA 通过抑制细胞活力,增加细胞凋亡以及炎性反应来损害猪肾脏细胞的证据。
Wang 等[12]研究指出,人类尿中BPA 的最低浓度高达5.56 μg/L,相当于24.35 nmol/L ;Jiao 等[13]选用0.4 mmol/L BPA 作用于大鼠小肠上皮细胞6 h 来模拟急性损伤。考虑到高水平BPA 可能对肾脏细胞产生的影响,本研究分别设置不同浓度和时间梯度的BPA 处理,通过CCK-8 检测细胞活力发现,BPA 浓度越高,处理时间越长,细胞活力则越低,这与BPA 暴露对小鼠腔前卵泡颗粒细胞、神经干细胞、结肠上皮细胞和小肠上皮细胞的研究结果一致[13-14],即当BPA 暴露浓度超过100 μmol/L 时,细胞活力和增殖率显著降低。因此本研究选用200 μmol/L BPA,处理6 h 用于后续试验。
在畜牧业生产中,饲养管理不当、病理因素和环境因素都有可能损伤体内抗氧化防御系统,诱导氧化应激。在正常条件下,生物体内ROS 的产生和清除维持着一种动态平衡,这种平衡在不利条件下会受到干扰。过量的ROS 会干扰生物体内氧化还原状态,引起氧化应激发生。研究表明,100 μmol/L BPA 暴露增加了胚泡内ROS 含量,导致线粒体损伤,对猪胚胎发育具有不良影响[15]。BPA 可促进猪卵母细胞产生较高的ROS,抑制卵母细胞的减数分裂成熟,卵丘细胞扩张和功能障碍,以及卵母细胞凋亡[16]。本研究结果表明,BPA 显著增强了ROS 染色荧光强度,即增加了ROS 产生,能够诱导猪肾细胞发生氧化应激。
肾脏疾病的病理类型多样,多种慢性肾脏疾病的发生与发展均与氧化应激有关,因此炎症调节是肾脏疾病治疗发展的关键之一[17]。ROS 升高被认为是炎性反应的标志,其通过诱导多种炎性介质和促炎细胞因子的分泌来启动炎性反应[18]。TNF-α、IL-6、IL-8 和IL-1β是最常见的炎症检测标志物。IL-6 是一种促炎细胞因子,具有支持机体多种慢性炎性反应、诱导急性期反应等功能。IL-6 刺激NK-κB 配体受体活化因子会导致骨吸收和骨质疏松,诱导血管内皮生长因子产生,导致血管生成和血管通透性增加,出现炎症病变[19]。TNF-α是一种参与机体全身性炎症反应的细胞信号蛋白,是炎症反应的关键调节剂[20];IL-8 也是一种有效的促炎趋化因子,IL-8 和TNF-α水平的升高与各种疾病的成年患者的急性肾损伤有关[21]。BPA 暴露可干扰免疫功能,结合PK15 细胞中一些关键促炎因子IL-6、IL-8、TNF-αmRNA 相对表达量显著上调,推断BPA 可能通过细胞内ROS 积累增加而诱导PK15 细胞发生炎性反应。
有证据表明,ROS 含量增加可能作为第二信使上调促凋亡基因的表达,激活天冬氨酸特异性半胱氨酸蛋白酶(Caspase),诱导细胞凋亡[22]。线粒体外膜上的BAX 和BCL-2 二聚体的形成,引起线粒体外膜通透性的改变[23]。当线粒体受损时,Caspase 激活并参与随后的水解反应,导致细胞凋亡。而且炎症过度可能误导细胞激活线粒体凋亡通路,导致细胞凋亡[24]。Yuan 等[25]使 用1、10、100、1 000 μmol/L 的BPA 处理恒河猴胚胎肾上皮细胞,发现BPA 引起ROS 水平上升,诱发氧化应激,进而参与细胞凋亡。一致地,本研究结果显示,BPA 处理的细胞中促凋亡基因Caspase3和BAX表达显著增加,抗凋亡基因BCL-2表达显著降低。Hoechest33258 染色显示BPA 显著增加了凋亡细胞数量,充分证实BPA 可诱导细胞凋亡。综上表明,BPA 诱导的PK15 细胞炎性因子表达上升以及细胞凋亡可能与ROS 含量上升导致的氧化应激增强有着密不可分的关系。
4 结 论
本试验结果表明,高浓度的BPA(200 μmol/L)显著降低PK15 猪肾细胞活力,并且呈现一定浓度和时间依赖性,增加细胞内ROS 含量,诱导细胞凋亡和炎性反应。
