食品添加剂2,3-丁二酮通过激活NF-κB诱发肝细胞L02发生凋亡
2021-12-16吴兰刘阳张雯翔王琛刘畅
吴兰 刘阳 张雯翔 王琛 刘畅


摘要 在现代社会中,食品添加剂在食品工业的生存和发展中起到了关键作用。作为食品添加剂家族的重要一员,2,3-丁二酮(2,3-butanedione,BUT)被广泛用于制造牛奶香精。然而为了降低成本,生产商使用BUT作为原料,对食品的安全性构成了极大的威胁。近年来,已发现BUT可引起肺部闭塞性细支气管炎,但BUT对肝脏是否具有潜在毒性仍然未知。本研究使用L02细胞作为体外模型,检测细胞暴露于BUT 12 h是否会引起肝毒性。实验结果表明,当BUT的剂量达到0.5 mM时,肝细胞活性显著降低,出现大量死细胞,细胞活性氧增加并且线粒体膜电位降低,Capase-3活性显著升高,Nf-κB和Caspase-3基因与蛋白表达量均升高。这些结果表明,当BUT浓度达到一定的剂量阈值时,可以引起一定程度的肝细胞凋亡。
关 键 词 2,3-丁二酮;L02细胞;细胞凋亡;Nf-κB;Caspase-3
中图分类号 TQ657.1 文献标志码 A
Abstract In modern society, food additives play an important role in the survival and development of the food industry. Among which, 2,3-butanedione (BUT) is widely used in the production of milk flavor. In order to reduce costs, manufacture uses the BUT as a raw material, which would pose a great threat to the food safety. In recent years, it has been reported that BUT causes pulmonary bronchiolitis obliterans. However, the potential toxicity of BUT on the liver remains unknown. In the present study, we used an in vitro model of L02 cells to test whether exposure to BUT for 12 h would cause hepatotoxicity. Our results showed that BUT caused an extreme reduction in the hepatocyte viability and massive cell death, increased reactive oxygen species production, decreased mitochondrial membrane potential, significantly increased the activity of Capase-3, and finally elevated Nf-κB and Caspase-3 genes expression. All in all, our results indicate that BUT causes hepatocytes apoptosis when reaching to a certain dose threshold.
Key words 2, 3-butanedione; L02 cells; apoptosis; Nf-κB; Caspase-3
0 引言
在社會经济快速发展的今天,食品工业已取得了长足的进步,其中食品添加剂的重要性也日益凸显[1]。然而,各种食品安全问题也正不断出现[2]。为减少或避免食品安全问题的发生,防止其对人体产生不利影响,人们必须采取相应措施,减少食品中有害添加剂的使用。随着中国社会主义市场与计划经济的蓬勃发展,食品工业也随之快速发展与进步,食品中“色”、“香”越来越受到消费者的青睐。食品添加剂已成为现代食品中不可或缺的一部分,在改善食品的外观、颜色和味道方面发挥着重要作用[3-7]。另一方面,对食品添加剂的非法使用也会引起严重疾病的发生,如心脑血管疾病、癌症等[8-9]。目前,世界上已使用了25 000多种食品添加剂(其中80%是香料)[10]。能够直接被人们使用的约3 000~4 000种,其中600~1 000种食品添加剂为人们所常用。由于每个国家的食品安全控制要求和技术的差异,其对食品添加剂的可允许使用类型和范围是不同的。例如,美国食品药品监督管理局(FDA)已发布了2 922种食品添加剂,其中1 755种得到管理。目前,中国的食品添加剂已达23类,超过2 000种,主要包括香料,消泡剂,防结块剂,增味剂,防腐剂,膨松剂等[10]。
2,3-丁二酮(BUT),也称为二乙酰,是一种重要的香料,颜色介于黄色和浅绿色之间,具有强烈的奶油香气[11]。它不仅是乳制品中的重要成分,同时也是奶油、奶酪和其他需要乳白味的非乳制品的重要香料[12]。此外,BUT还可用作明胶[13]的固化剂,摄影用粘合剂[14],以及药物[15],农药[4,16]和其他精细化学品[17]的合成中间体。由于其广泛的应用,BUT正在受到越来越多的关注。除人工添加外,脂类[18]、碳水化合物[19]和维生素等食物成分可通过多种方式形成,如过氧化、氧化分解、美拉德反应[20]、光敏氧化[15,21-22]等反应。虽然BUT被美国FDA[23]归类为公认安全类添加剂,但其在各个方面的安全性依然需要人们加以重视。目前国内外关于BUT安全性的研究报告很少,相关研究也有待加强。
近年来的研究表明,BUT具有闭塞性细支气管炎和诱导氧化应激等毒性作用[15]。目前,关于直接食用BUT引起的大鼠急性中毒的报道尚未确定,但有一些有效的证据显示BUT的剂量可能诱发包括肝脏在内的多种器官的损伤[23]。但是,关于由BUT引起的肝损伤的报道并不多。因此,选择BUT来损害正常肝细胞,以便在细胞水平上初步发现BUT对肝脏的损害。希望本文的研究可以为BUT的健康危害提供可靠的理论依据,并为修订BUT在食品中应用的有限标准提供参考。
1 材料
1.1 药品与试剂
2,3-丁二酮(中国阿拉丁公司);CCK-8试剂(中国,建成生物工程研究所);线粒体膜电位检测试剂盒(JC-1)、活性氧检测试剂、Caspase-3活性检测试剂(中国,碧云天公司);RPMI-1640培养基(美国,赛默飞公司);抗体CASPASE-3、NF-κB(美国,Santa Cruz Biotechnology公司);二抗(美国,Jackson ImmunoResearch公司);细胞裂解缓冲液(中国,碧云天公司);苯基甲基磺酰氟(PMSF,美国,Sigma公司);BCA蛋白测定试剂盒(中国,碧云天公司);Trizol 、PrimeSc试剂盒(日本,Takara公司)。
1.2 仪器
GENE SPEED离心机(中国,基因有限公司);Tanon EPS 300(中国,天能有限公司);Tanon 6600发光成像工作站(中国,天能有限公司);RT- PCR仪(美国,赛默飞有限公司);Light Cycle 480II PCR仪(瑞士,罗氏公司);倒置荧光显微镜(日本,Nikon公司);酶标仪(瑞士,TECAN贸易有限公司)。
1.3 细胞
人正常肝脏细胞L02细胞购买于上海中科院并且长期保存于本实验室。
2 方法
2.1 细胞培养
在包含L-谷氨酰胺,25 mM HEPES缓冲液和碳酸氢钠的RPMI-1640培养基中培养人正常肝细胞L02。该培养基补充有MEM非必需氨基酸(1%)。所有细胞均补充有10%的胎牛血清和1%的青霉素-链霉素,并在37°C下用5%的CO2培养。待细胞密度达到70%~90%时,采用0.25%胰酶消化传代。
2.2 CCK-8法
将对数生长期的细胞经胰酶消化后种植于96孔板中,各给药浓度细胞设置复孔3孔。待细胞浓度密度增殖至60%~70%时,分别加入0、0.2、0.5、1.0、2.0、4.0 mM的BUT培养24 h,將10 μL CCK-8加入96孔板的每个孔中,并在37 °C下孵育2.5 h。用酶标仪在450 nm波长下测定各孔的吸光度,并计算各浓度的平均值,分析并记录实验结果。
2.3 BUT处理诱导L02细胞的形态变化
细胞传代并种植于6孔板后,培养细胞待密度为60%~70%时,加入不同浓度的BUT,待处理12 h后,用光学显微镜(200×)观察细胞后,并拍摄下不同浓度细胞的状态。
2.4 流式细胞术检测细胞凋亡
将BUT处理12 h的细胞培养基吸入合适的离心管中,用PBS冲洗贴壁细胞一次,加入适量胰蛋白酶细胞消化液消化细胞。加入上述中收集的细胞培养液,搅拌均匀,移入离心管,1 000g离心5 min,弃上清液,收集细胞,用PBS轻轻重悬。再次离心重悬的细胞,5 min 1 000g,弃上层液, 加入195 μL Annexin V-EGFP结合液轻轻重悬细胞。加入5 μL Annexin V-EGFP,轻轻混匀。再加入10 μL碘化丙啶染色液,轻轻混匀。室温(20~25 ℃)避光孵育10~20 min,随后置于冰浴中。并使用铝箔进行避光。孵育过程中可以重悬细胞2~3次以改善染色效果。随即进行流式细胞仪检测。
2.5 线粒体膜电位(MMP)测定
细胞种植于六孔板在给与BUT刺激12 h后,吸出培养液,用PBS溶液洗涤一次,然后加入1 mL细胞培养液以及1 mL JC-1染色溶液并充分混合。在细胞培养箱中于37 ℃孵育20 min。在温育期间,以每1 mL JC-1染色缓冲液(5×)4 mL蒸馏水的比例制备适量的JC-1染色缓冲液(1×),并置于冰浴中。在37 ℃下温育后,吸出上清液,并用JC-1染色缓冲液(1×)洗涤两次。即加入2 mL细胞培养基,其中可能含有血清和酚红。在倒置荧光显微镜下观察。
2.6 细胞活性氧(ROS)测定
DCFH-DA用无血清培养基按1∶1 000稀释至终浓度10 μM。待细胞接受BUT 12 h刺激后,用适当量的含有DCFH-DA的新鲜培养基更新细胞培养基,并在细胞培养箱中于37 ℃孵育20 min。用无血清细胞培养基洗涤细胞3次,以充分除去未被细胞吸收的DCFH-DA。使用488 nm的激发波长和525 nm的发射波长,通过荧光酶标仪检测药物处理后的荧光强度,以测量每种药物浓度下细胞活性氧的程度。
2.7 活细胞Caspase-3活性检测
细胞种植于96孔板中,待细胞密度大约达到70%时,不同浓度的BUT处理L02细胞12 h。用含5 μM底物的新鲜培养液或者PBS对细胞进行换液,Ac-DEVD -CHO抑制剂组要补充原来浓度的抑制剂。室温避光孵育15~30 min。酶标仪设置激发波长485 nm,发射波长515 nm。记录数据。
2.8 实时定量PCR(qPCR)
使用 Trizol 法提取总 RNA 后,用反转录试剂盒将 1 μg 的总 RNA 反转录为 cDNA,随后,使用 SYBR Premix Ex Taq 检测目的基因的 mRNA 表达水平,以人β-actin基因为内参。引物序列如下:
β-actin F:5’-GAAACTGCTGCCTCACATCCG-3’,R:5’-GCTGGCACAGTGACCTCACACG-3’;
NF-κB F:5’-CTACACAGGACCAGGGACAG-3’,R:5’-GCACAGCATTCAGGTCGTAG-3’;
Caspase-3 F:5’-ACTGGACTGTGGCATTGAGA -3’,R:5’-GCACA AAGCGACTGGATGAA-3’ 。
2.9 Western blot法检测蛋白表达水平
RIPA 裂解液冰浴裂解肝细胞,收集总蛋白。取等量蛋白进行 SDS-PAGE凝胶电泳,湿转法转至PVDF膜上,5%脱脂奶粉在室温下封闭1 h,加入一抗(β-actin以1∶5 000稀释,和 NF-κB和CASPASE-3以1∶1 000稀释),4 ℃孵育过夜,PBST洗膜3次后加入HRP 标记的二抗(1∶1 000稀释),室温下孵育1 h,使用 PBST 洗涤3次,每次10 min,采用ECL化学发光试剂显影。
2.10 统计分析
使用软件包Origin 8对获得的结果进行统计分析。找到了每个研究参数的算术平均值和标准差(SD)。两组之间的比较通过t检验确定对显著性结果进行配对检验。与空白对照组(0 mM)做配对检验,显著性水平为*P <0.05,**P<0.01为极显著性差异。
3 结果
3.1 在体外用BUT直接处理肝细胞会降低细胞活力
为了评估BUT是否可以在体外影响肝细胞的存活力,用剂量从0 mM增加到4.0 mM的BUT剂量处理了L02细胞12 h。实验表明,BUT 12 h后,低剂量的BUT对 L02细胞活力影响较小,当浓度增加至0.2 mM时细胞活力出现显著性降低(P <0.05,细胞活力为87%)(图1)。与未处理的细胞相比,在4.0 mM时,细胞活力约降低至19%(P <0.01)。累积计算法计算得到BUT的半数致死剂量(LD 50)值为2.0 mM。
3.2 细胞形态变化
用光学显微镜观察细胞后,发现细胞间开始失去接触,随着BUT浓度的增加而分离。当BUT浓度达到4.0 mM时,发现健康形态特征和细胞完整性完全消失,可以清楚地看到死细胞。
3.3 BUT诱导L02细胞凋亡
为了确认BUT对人正常肝细胞凋亡的影响,使用Annexin V-PE / 7-AAD染色和流式细胞仪对凋亡细胞的数量进行了定量分析(图3)。可以从图3中看出随着BUT浓度升高细胞的凋亡率明显增加。当BUT处理浓度达到0.5 mM时(凋亡率增加至22%),与对照组相比已出现显著性差异。待浓度达到2.0 mM,细胞的凋亡率达到57%,当浓度为4.0 mM时细胞几乎全部凋亡(凋亡率为86%)。
3.4 BUT对L02细胞线粒体毒性的影响
为了更好地了解BUT是如何引起肝细胞活力降低,首先检测了细胞线粒体的完整性。如图4所示,用JC-1染色BUT处理的L02细胞后,发现1.0 mM的BUT即可引起线粒体损伤,且线粒体损伤程度与BUT浓度成正比。随着浓度的增加代表线粒体膜电位下降的绿色荧光逐渐增加,直至4.0 mM时线粒体膜电位较高时的红色荧光几近消失。
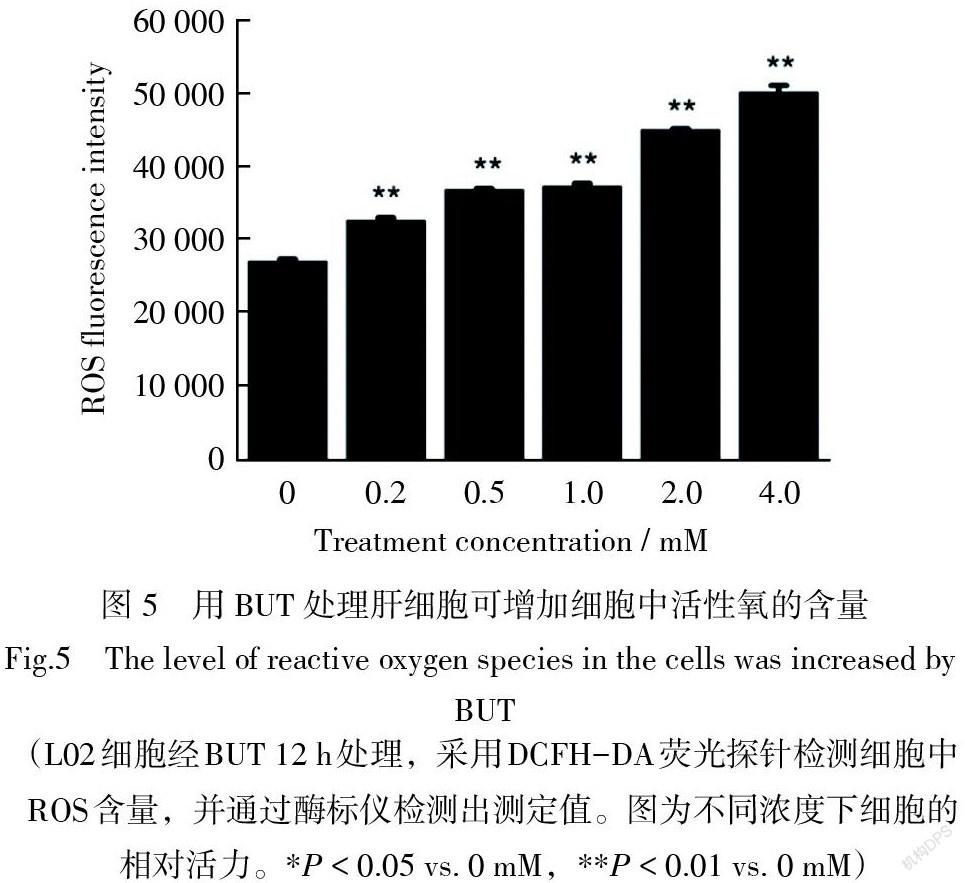
3.5 BUT诱导L02细胞中ROS升高
为了进一步研究BUT处理引起L02细胞损伤,使用荧光酶标仪测量了细胞中活性氧的水平。实验表明,直接暴露于BUT 12 h后,与未处理的细胞相比,细胞中ROS的含量随着BUT的浓度增加呈剂量依赖性升高(图5)。
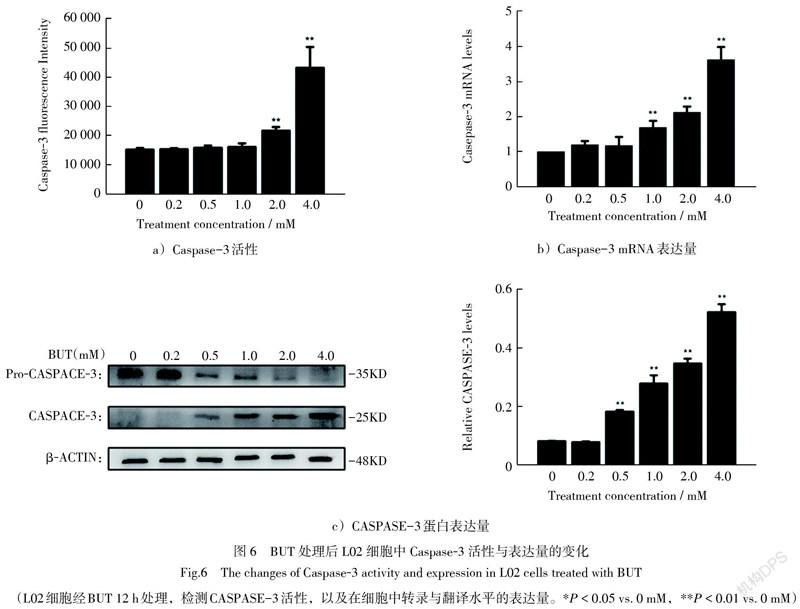
3.6 L02细胞中Caspase-3活性与表达量升高
当细胞发生凋亡时,Caspase-3可被激活,因此对BUT处理的L02细胞的Caspase-3的活性进行检测。实验结果显示,与空白组 Caspase-3比较,低浓度的BUT对细胞Caspase-3活性没有明显影响,当浓度达到2.0 mM,Caspase-3的活性显著升高,(P <0.01),4.0 mM BUT组的Caspase-3活性极显著性地升高,(P <0.01)。(图6a))。RT-qPCR和Western blot检测发现,当BUT浓度达到1.0 mM时,Caspase-3的mRNA和蛋白表达水平也均显著性升高(图6b)和6c))。
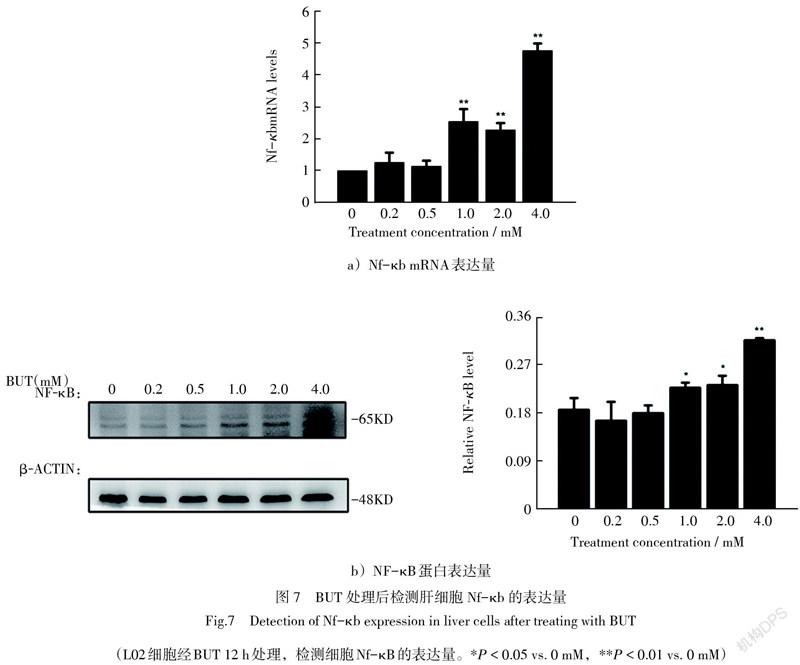
3.7 BUT浓度增加凋亡相关蛋白的变化
NF-κB信号通路广泛存在于真核细胞内,参与多种基因的调控,对细胞的增殖、分化、凋亡和炎症反应起着重要作用,因此我们通过RT-qPCR和Western blot实验检测BUT处理的L02细胞中NF-κB是否活化。如圖7所示,BUT可以在转录和翻译水平活化NF-κB p65。这些结果表明,BUT可能是通过激活NF-κB信号通路诱导L02细胞的凋亡。
4 结论
肝脏作为常见的毒性靶器官,它能够代谢血液循环中的异物,以帮助清除体内潜在毒素的影响。作为FDA批准的常见食品添加剂,BUT被广泛用于牛奶味食品中[24-25]。值得注意的是,食品成分安全是FDA的首要任务。但近年来,据报道BUT可能对人肺造成诸如支气管炎的毒性作用。鉴于肝脏是代谢血液循环中的异物以帮助清除体内潜在毒素的内在作用的主要器官之一,因此有理由怀疑其是BUT的另一个潜在毒性靶器官。但是,关于由BUT引起的肝脏损害的报道很少。因此,本文的研究发现了BUT可以一定程度的引起肝损伤,为修订BUT在食品中应用的有限标准提供一些参考。
线粒体在细胞存活和细胞内环境的稳定维持中起着重要作用。线粒体的变化被认为是细胞凋亡的重要形态学变化,并且被认为是细胞凋亡的早期细胞标志物[26]。在本研究中,研究了线粒体的2个参数:线粒体膜电位(MMP)和活性氧(ROS)浓度。这2个指标从不同的肝毒性角度反映了细胞凋亡的基本机制。ROS在肝毒性机制中起作用,由于ROS水平升高会损害脂质、蛋白质或DNA,从而导致脂质过氧化和线粒体功能障碍[27]。MMP主要检测线粒体内膜和外膜之间的电位差,这是早期评估潜在肝毒性药物的常用指标[28]。线粒体在细胞存活和维持细胞内环境的稳定维持中起着重要作用[29]。在目前的研究中,BUT暴露后,活细胞数量减少,线粒体膜电位降低,ROS浓度增加,Caspase-3的活力及蛋白表达量升高,表明BUT诱导的肝毒性可能导致细胞凋亡。
生物體内最重要的信号传导途径之一是NF-κB通路,据报道,它可以激活与炎症[30],增殖,凋亡,转移和侵袭[31]有关的基因,因此在细胞凋亡发生中起着至关重要的作用。NF-κB转录因子的激活通过NF-κB复合物的NF-κB p65成分的核易位而发生[32]。BUT已显示在0.5~4.0 mM浓度下可促进人正常肝细胞L02细胞的NF-κB活性。因此,BUT引起的L02细胞凋亡可能是通过激活NF-κB活信号通路来实现的。
总而言之,BUT虽是FDA批准的常见食品添加剂,但在一定浓度下,应考虑其对肝脏的毒性。
参考文献:
[1] VINDEROLA G. Dried cell-free fraction of fermented milks:new functional additives for the food industry[J]. Trends in Food Science & Technology,2008,19(1):40-46.
[2] ADINOLFI F,DI PASQUALE J,CAPITANIO F. Economic issues on food safety[J]. Ital J Food Saf,2016,5(1):5580.
[3] BASTAKI M,FARRELL T,BHUSARI S,et al. Estimated daily intake and safety of FD&C food-colour additives in the US population[J]. Food Additives & Contaminants:Part A,2017,34(6):891-904.
[4] BERDAGUÉ J L,MONTEIL P,MONTEL M C,et al. Effects of starter cultures on the formation of flavour compounds in dry sausage[J]. Meat Science,1993,35(3):275-287.
[5] COLE G L,ENDLER J A. Artificial selection for food colour preferences[J]. Proc Biol Sci,2015,282(1804):20143108.
[6] KOYAMA K I,AMITANI H,ADACHI R,et al. Good appearance of food gives an appetizing impression and increases cerebral blood flow of frontal pole in healthy subjects[J]. International Journal of Food Sciences and Nutrition,2016,67(1):35-39.
[7] MIETH L,BELL R,BUCHNER A. Memory and disgust:Effects of appearance-congruent and appearance-incongruent information on source memory for food[J]. Memory,2016,24(5):629-639.
[8] FORTIN N D. PHOs:illegal food additives since 2005[J]. Food Technology,2014,68(11):96.
[9] YANG J,HAUSER R,GOLDMAN R H. Taiwan food scandal:The illegal use of phthalates as a clouding agent and their contribution to maternal exposure[J]. Food and Chemical Toxicology,2013,58:362-368.
[10] MARTYN D M,MCNULTY B A,NUGENT A P,et al. Food additives and preschool children[J]. Proceedings of the Nutrition Society,2013,72(1):109-116.
[11] BLANCHARD E M,SMITH G L,ALLEN D G,et al. The effects of 2,3-butanedione monoxime on initial heat,tension,and aequorin light output of ferret papillary muscles[J]. Pflügers Archiv,1990,416(1/2):219-221.
[12] RINCON-DELGADILLO M I,LOPEZ-HERNANDEZ A,WIJAYA I,et al. Diacetyl levels and volatile profiles of commercial starter distillates and selected dairy foods[J]. Journal of Dairy Science,2012,95(3):1128-1139.
[13] MADAN P L,JANI R K,BARTILUCCI A J. New method of preparing gelatin microcapsules of soluble pharmaceuticals[J]. Journal of Pharmaceutical Sciences,1978,67(3):409-411.
[14] AKHTAR M J,JACQUOT M,ARAB-TEHRANY E,et al. Control of salmon oil photo-oxidation during storage in HPMC packaging film:Influence of film colour[J]. Food Chemistry,2010,120(2):395-401.
[15] MATHEWS J M,WATSON S L,SNYDER R W,et al. Reaction of the butter flavorant diacetyl (2,3-butanedione) with N-α-acetylarginine:a model for epitope formation with pulmonary proteins in the etiology of obliterative bronchiolitis[J]. Journal of Agricultural and Food Chemistry,2010,58(24):12761-12768.
[16] KOVACIC P,COOKSY A L. Role of diacetyl metabolite in alcohol toxicity and addiction via electron transfer and oxidative stress[J]. Archives of Toxicology,2005,79(3):123-128.
[17] ROBINSON A,HESKETH H,LAHIVE E,et al. Comparing bee species responses to chemical mixtures:Common response patterns?[J]. PLoS One,2017,12(6):e0176289. DOI:10. 1371/journal. pone. 0176289.
[18] HANSEN A,SCHIEBERLE P. Generation of aroma compounds during sourdough fermentation:applied and fundamental aspects[J]. Trends in Food Science & Technology,2005,16(1/2/3):85-94.
[19] PAN D D,WU Z,PENG T,et al. Volatile organic compounds profile during milk fermentation by Lactobacillus pentosus and correlations between volatiles flavor and carbohydrate metabolism[J]. Journal of Dairy Science,2014,97(2):624-631.
[20] ZHOU Y M,XIE F,ZHOU X L,et al. Effects of Maillard reaction on flavor and safety of Chinese traditional food:roast duck[J]. Journal of the Science of Food and Agriculture,2016,96(6):1915-1922.
[21] COGHE S,GHEERAERT B,MICHIELS A,et al. Development of Maillard reaction related characteristics during malt roasting[J]. Journal of the Institute of Brewing,2006,112(2):148-156.
[22] COULOMBE J J,FAVREAU L. A new simple semimicro method for colorimetric determination of urea[J]. Clinical Chemistry,1963,9:102-108.
[23] HUBBS A F,CUMPSTON A M,GOLDSMITH W T,et al. Respiratory and olfactory cytotoxicity of inhaled 2,3-pentanedione in sprague-dawley rats[J]. The American Journal of Pathology,2012,181(3):829-844.
[24] HUANG X L,QIN J J,LU S. Magnesium isoglycyrrhizinate protects hepatic L02 cells from ischemia/reperfusion induced injury[J]. International Journal of Clinical and Experimental Pathology,2014,7(8):4755-4764.
[25] PARK B K,LAVERTY H,SRIVASTAVA A,et al. Drug bioactivation and protein adduct formation in the pathogenesis of drug-induced toxicity[J]. Chemico-Biological Interactions,2011,192(1/2):30-36.
[26] JEVTIĆ G,NIKOLIĆ T,MIRČIĆ A,et al. Mitochondrial impairment,apoptosis and autophagy in a rat brain as immediate and long-term effects of perinatal phencyclidine treatment—influence of restraint stress[J]. Progress in Neuro-Psychopharmacology and Biological Psychiatry,2016,66:87-96.
[27] GU L L,SHEN Z L,LI Y L,et al. Oxymatrine causes hepatotoxicity by promoting the phosphorylation of JNK and induction of endoplasmic reticulum stress mediated by ROS in LO2 cells[J]. Moleculer Cells,2018,41(5):401-412.
[28] DAN Z L,POPOV Y,PATSENKER E,et al. Hepatotoxicity of alcohol-induced polar retinol metabolites involves apoptosis via loss of mitochondrial membrane potential[J]. The FASEB Journal,2005,19(7):845-847.
[29] NIU L Q,HUANG J,YAN Z J,et al. Fluorescence detection of intracellular pH changes in the mitochondria-associated process of mitophagy using a hemicyanine-based fluorescent probe[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2019,207:123-131.
[30] LI Y C,LU Z Y,HUANG Y,et al. F(ab')2 fragments of anti-oxidized LDL IgG attenuate vascular inflammation and atherogenesis in diabetic LDL receptor-deficient mice[J]. Clinical Immunology,2016,173:50-56.
[31] DOLCET X,LLOBET D,PALLARES J,et al. NF-kB in development and progression of human cancer[J]. Virchows Archiv,2005,446(5):475-482.
[32] FERRER T,RUPP J,PIPER D R,et al. The S4-S5 linker directly couples voltage sensor movement to the activation gate in the human ether-á-go-go-related gene (hERG) k+ channel[J]. Journal of Biological Chemistry,2006,281(18):12858-12864.
