不同剂量雷公藤颗粒联合紫癜I号方治疗儿童反复发作性过敏性紫癜的临床研究
2021-12-16李雪军韩姗姗徐闪闪代彦林孙昭恒孙利辉
丁 樱,李雪军,张 霞,韩姗姗,徐闪闪,代彦林,孙昭恒,孙利辉
不同剂量雷公藤颗粒联合紫癜I号方治疗儿童反复发作性过敏性紫癜的临床研究
丁 樱1, 2, 3*,李雪军1, 2, 3,张 霞1, 2,韩姗姗1, 2,徐闪闪1, 2, 3,代彦林1, 2, 3,孙昭恒1, 2, 3,孙利辉1, 2, 3
1. 河南中医药大学第一附属医院,河南 郑州 45000 2. 河南中医药大学儿科医学院,河南 郑州 45000 3. 河南中医药大学,河南 郑州 450000
探讨不同剂量雷公藤颗粒联合紫癜I号方治疗儿童反复发作性过敏性紫癜(recurrent Henoch-Schönlein purpura,RHSP)的疗效及近期安全性。筛选2020年4~12月河南中医药大学第一附属医院儿科肾脏病区RHSP患儿144例,随机分为试验1组、试验2组、中医对照组和西医对照组。试验1组给予0.025 g/(kg·d) 雷公藤颗粒[雷公藤饮片0.5 g/(kg·d)]+紫癜I号方,试验2组给予0.035 g/(kg·d) 雷公藤颗粒[雷公藤饮片0.7 g/(kg·d)]+紫癜I号方,中医对照组给予紫癜I号方,西医对照组给予氯雷他定+维生素C+泼尼松片。治疗4周,随访8周,比较4组疗效及不良反应。试验1组、试验2组皮疹疗效、临床疗效均优于中医对照组和西医对照组,差异有统计学意义(<0.05)。治疗后试验2组中医症状总积分、皮疹(主症)积分、次症积分均优于试验1组、中医对照组、西医对照组,差异有统计学意义(<0.05)。4组患儿不良反应发生率、皮疹复发率、肾脏损伤发生率差异均无统计学意义(>0.05)。0.025、0.035 g/(kg·d)剂量雷公藤颗粒联合紫癜I号方可促进RHSP患儿皮疹消退,以0.035 g/(kg·d) 雷公藤颗粒总有效率更高,短期临床应用未发现明显不良反应。
反复发作性过敏性紫癜;雷公藤颗粒;紫癜I号方;临床研究;儿童
反复发作性过敏性紫癜(recurrent Henoch-Schönlein purpura,RHSP),是儿童较为常见的全身性白细胞碎裂性小血管炎[1],部分学者将皮疹反复新出(≥3次),经常规治疗2周病情无缓解者视为“难治性过敏性紫癜”[2]。紫癜反复发作是引起肾脏损伤的危险因素[3],对于该病反复发作及其所致的肾脏损害,尚无统一的治疗方案,而有效药物雷公藤多苷片也因其性腺损害不良反应及说明书“儿童禁用”标识,使其在儿科临床应用中受限。丁樱教授依据儿童体质量首次将雷公藤颗粒应用于临床并探索其剂量。前期回顾性研究[4]表明,雷公藤颗粒中、高剂量 [0.025、0.035 g/(kg·d)] 联合紫癜I号方均能有效促进RHSP患儿皮疹消退,提示以体质量“精准”计算儿童使用雷公藤颗粒的剂量对提高临床疗效及规避雷公藤不良反应有积极意义。本研究采用前瞻性、随机对照的方法,进一步对2种剂量的雷公藤颗粒联合紫癜I号方治疗RHSP的疗效及近期安全性进行评价,为雷公藤颗粒在儿科临床中的应用及研究提供依据。
1 资料与方法
1.1 试验总体设计
采用前瞻性、随机对照的方法,纳入2020年4~12月河南中医药大学第一附属医院儿科肾脏病区RHSP患儿144例,依据随机数字表法分为试验1组、试验2组、中医对照组和西医对照组,每组各36例。样本量计算依据:根据前期回顾性分析,将治疗4周试验组总有效率控制在96.0%,对照组总有效率控制在70.5%,按1∶1∶1∶1进行分配,在预计2组差异()为15%、显著性水平α=0.05、把握度(1-β)=80%、失访率为20%的情况下,采用梅斯医学样本量计算工具估算试验组样本量为36例,对照组样本量36例,总样本量144例。本研究已通过河南中医药大学第一附属医院伦理委员会审批(批件号2019YL-144-01)。
1.2 诊断标准
RHSP的界定参考《诸福棠实用儿科学》第8版[5]及“难治性过敏性紫癜”纳选标准[2]拟定:①紫癜反复新出,2周内皮疹新出次数≥3次;②经常规治疗2周或2周以上,紫癜仍反复新出者。
1.3 纳入标准
①符合RHSP的入选标准;②中医辨证属血热妄行者;③2周≤病程≤1年;④3岁≤年龄≤16岁;⑤患儿及其家属同意并签署知情同意书。
1.4 排除标准
①伴有其他顽固性变态反应性疾病,如顽固性荨麻疹;②伴有严重消化道症状或肾脏损伤表现者;③合并其他脏器损害或伴有精神、神经系统、造血系统疾病等。
1.5 治疗方案
①试验1组给予0.025 g/(kg·d) 雷公藤颗粒 [相当于雷公藤饮片0.5 g/(kg·d)]+紫癜I号方;②试验2组给予0.035 g/(kg·d) 雷公藤颗粒 [相当于雷公藤饮片0.7 g/(kg·d)]+紫癜I号方;③中医对照组给予紫癜I号方;④西医对照组予氯雷他定+维生素C+泼尼松片。疗程4周。
雷公藤配方颗粒(江阴天江药业有限公司生产,批号19066584),0.5 g/袋,相当于中药饮片10 g,每天分2次冲服。紫癜I号方由生地30 g、丹皮18 g、紫草30 g、忍冬藤30 g、海风藤30 g、络石藤30 g、川芎15 g、水牛角粉45 g、地肤子20 g、当归20 g、连翘20 g、甘草9 g组成(各药味为配方颗粒剂,购自河南中医药大学第一附属医院中药配方颗粒药房,由江阴天江药业有限公司提供;采用饮片水提液进行浓缩、喷雾干燥、制粒,水分≤8.0%,中药饮片符合《中国药典》2020年版规定的质控标准)。体质量20 kg以下患儿每天用量1/3,体质量20~40 kg患儿每天用量1/2,体质量40 kg以上患儿每天1剂,均分2次冲服。氯雷他定片(商品名开瑞坦,10 mg/片,拜耳医药上海股份有限公司,批号JS12884),患儿体质量>30 kg,10 mg/d;患儿体质量≤30 kg,5 mg/d。维生素C片(100 mg/片,华南药业有限公司,批号20210122),100 mg/次,3次/d。泼尼松片(5 mg/片,浙江仙琚制药有限公司,批号2012122),1 mg/(kg·d),分3次口服;3 d后改为晨起顿服,2 d减5 mg,直至减停,最大量不超过60 mg。
1.6 观察指标
1.6.1 疗效指标 ①统计0周、4周皮疹消退时间及皮疹新出次数,进行皮疹疗效评价;②记录0周、4周患儿的皮疹症状及次要症状,计算症状积分,评价临床疗效;③治疗结束后随访8周,每4周进行1次随访记录,评价患儿皮疹复发率及肾脏损伤发生率。
1.6.2 安全性指标 血常规、尿常规、肝肾功能,于0、2、4、8、12周各检测1次;免疫六项0、12周各检测1次;观察患儿有无白细胞(white blood cell,WBC)、血小板(platelet,PLT)及粒细胞下降、丙氨酸转氨酶(alanine aminotransferase,ALT)及天冬氨酸转氨酶(aspartate aminotransferase,AST)升高(ALT、AST>40 U/L)、恶心呕吐、女性患儿月经异常等不良反应。
1.7 评分标准
中医症状量化评分标准参考2002年《中药新药临床研究指导原则》试行版[6]。皮疹(主症)评分标准见表1;中医次症量化评分标准(舌脉只记录不计分)见表2。
表1 皮疹(主症) 评分标准
Table 1 Criteria for scoring rash (main symptoms)

项目主要症状 0分2分4分6分 紫癜颜色无淡红暗红鲜红或紫红 紫癜受累部位无双小腿双小腿、大腿及臀部四肢或累及躯干、颜面部 紫癜数量无散在、少量中等量皮疹密集,或融合成片 紫癜形态无针尖或米粒样绿豆、黄豆或花生样硬币大小,或瘀斑、水疱 紫癜痒感无微觉痒感瘙痒明显瘙痒剧烈
表2 次症量化评分标准
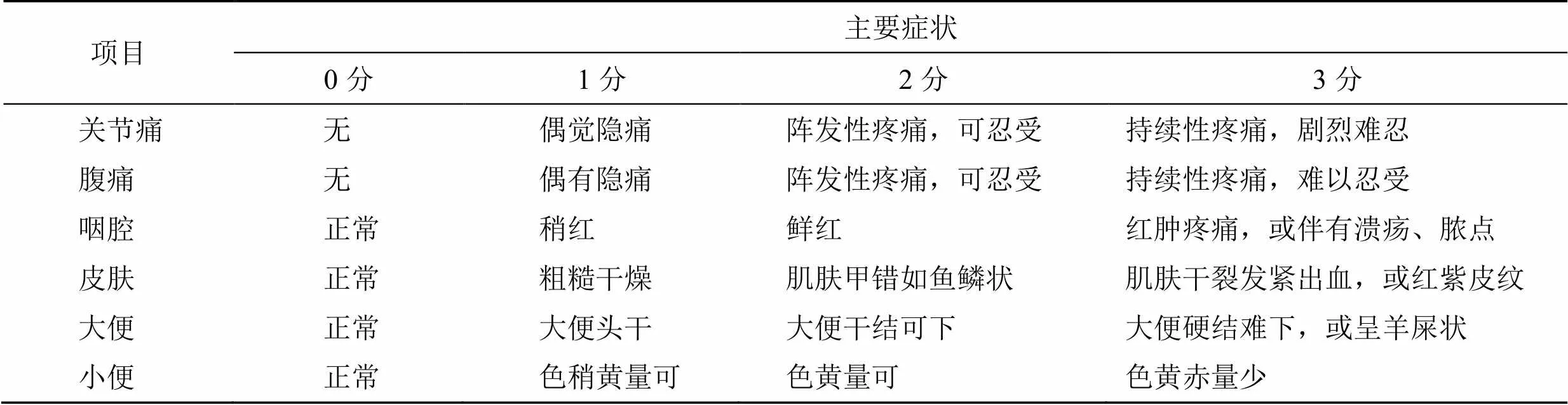
Table 2 Quantitative scoring criteria for secondary symptoms
1.8 疗效判定标准
1.8.1 皮疹疗效评定标准 参考《中药新药临床研究指导原则》试行版[8],将皮疹疗效标准拟定为①临床控制:皮疹全部消退持续无新出。②显效:皮疹消退≥70%;或皮疹全部消退,但治疗期间紫癜少量新出1~2次(<30%治疗前皮疹)。③有效:70%>皮疹消退≥30%;或皮疹全部消退,但治疗期间紫癜少量新出3~5次(50%治疗前皮疹>新出皮疹≥30%治疗前皮疹)。④无效:皮疹消退不足30%;或皮疹全部消退,但反复新出>5次(≥50%治疗前皮疹);或伴有肾脏损害者。
1.8.2 临床疗效评定标准 参考中医症状量化积分、结合实验室指标,将临床疗效分为以下4个等级:①临床控制:症状、体征消失或基本消失,疗效指数≥95%,尿常规无异常;②显效:症状、体征显著改善,疗效指数≥70%,尿常规无异常;③有效:症状、体征均有减轻,疗效指数≥30%,尿常规无显著异常[指偶有镜下血尿者,尿红细胞(red blood cell,RBC)<50/μL];④无效:症状、体征均无明显改善,甚或加重,尿常规示血尿或蛋白尿者,疗效指数<30%。
总有效率=(临床控制+显效+有效) 例数/总例数
疗效指数=[(治疗前中医症状积分-治疗后中医症状积分)/治疗前中医症状积分](尼莫地平法)
1.9 统计学处理
采用SPSS 25.0软件进行统计分析。计数资料选用2检验;计量资料符合正态分布选用单因素方差分析;不符合正态分布,两组间选用Mann-Whitney U秩和检验,多组间选用Kruskal-Wallis H秩和检验;等级资料的比较均选用Kruskal-Wallis H秩和检验;<0.05具有统计学意义。
2 结果
2.1 病例基本资料
共纳入RHSP患儿144例,4组各36例。共剔除19例,其中试验1组剔除4例;试验2组剔除4例;中医对照组剔除5例;西医对照组剔除6例。实际纳入125例,其中试验1组32例,试验2组32例,中医对照组31例和西医对照组30例,125例患儿均完成4周治疗。剔除原因及占比见表3和图1。
2.2 基线资料比较
2.2.1 年龄、病程比较 完成RHSP研究125例,患儿年龄3~16岁,病程2~48周,4组患儿年龄、病程无统计学差异(>0.05),具有可比性。见表4。

表3 各组病例剔除原因

图1 RHSP病例剔除原因占比
2.2.2 性别、体质量、治疗前总积分比较 4组患儿在性别、体质量、治疗前中医症状总积分方面无统计学差异(>0.05),具有可比性。见表5。
2.3 疗效比较
2.3.1 皮疹疗效比较 试验1组、试验2组、中医对照组、西医对照组皮疹总有效率分别为93.75%、96.88%、80.65%、70.00%,差异具有统计学意义(<0.05)。以试验2组皮疹总有效率最高。两两比较,试验1组、试验2组皮疹疗效均优于中医对照组、西医对照组(<0.05);中医对照组皮疹疗效优于西医对照组(<0.05);试验1组与试验2组皮疹疗效无统计学差异(>0.05),见表6。
2.3.2 治疗前后皮疹新出次数、皮疹消退时间比较 4组患儿治疗后皮疹新出次数及皮疹消退时间均减少,具有统计学差异(<0.05)。两两比较,试验1组与西医对照组,试验2组与中医对照组、西医对照组治疗前后皮疹新出次数差值及皮疹消退时间差值具有统计学差异(<0.05);中医对照组与西医对照组在皮疹消退时间差值上具有统计学差异(<0.05);试验1组与试验2组治疗前后皮疹新出次数差值及皮疹消退时间差值均无统计学差异(>0.05),见表7。

表4 各组患儿年龄、病程比较

表5 各组患儿性别、体质量和总积分比较
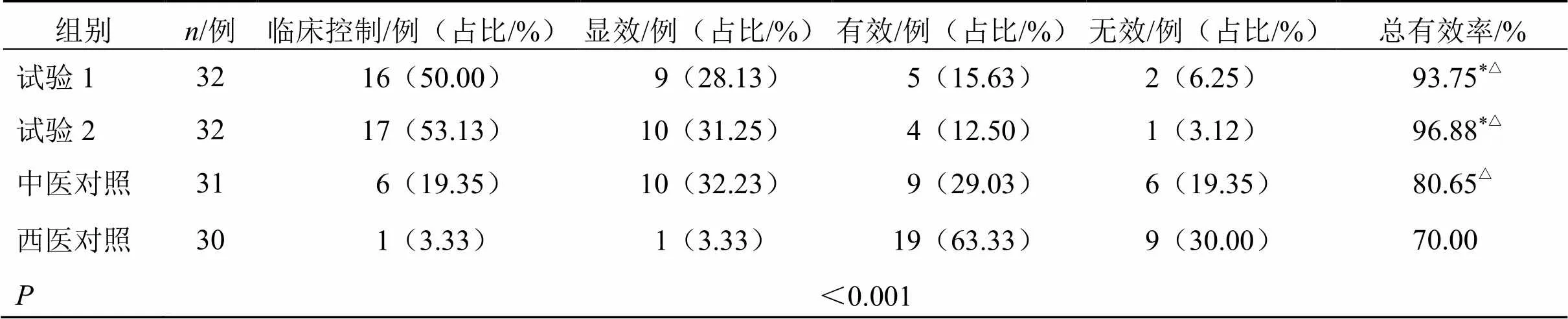
表6 各组患儿皮疹疗效比较
与中医对照组比较:*<0.05;与西医对照组比较:△<0.05,表7、8同
*< 0.05Chinese medicine control group;△< 0.05western medicine control group, same as tables 7 and 8
2.3.3 临床疗效比较 试验1组、试验2组、中医对照组、西医对照组临床总有效率分别为87.50%、96.87%、77.42%、63.33%,差异具有统计学差异(<0.05)。两两比较,试验1组、试验2组均优于中医对照组和西医对照组(<0.05);中医对照组临床疗效优于西医对照组(<0.05);试验1组、试验2组临床疗效无统计学差异(>0.05),见表8。

表7 各组患儿治疗前后皮疹新出次数、皮疹消退时间差值比较 ()
2.3.4 治疗前后中医症状积分比较 4组患儿治疗前后总积分、皮疹(主症)积分、次症积分均具有统计学差异(<0.05)。两两比较,治疗后试验2组各项积分与试验1组、中医对照组、西医对照组相比均有统计学差异(<0.05),治疗后试验1组各项积分与中医对照组相比具有统计学差异(<0.05);中医对照组与西医对照组治疗后总积分、皮疹(主症)积分、次症积分均无统计学差异(>0.05),见表9。

表8 各组患儿临床疗效比较
表9 各组患儿治疗前后中医症状积分比较
Table 9 Comparison of TCM symptom scores of children in each group before and after treatment
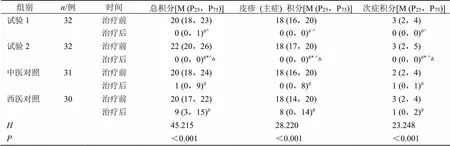
组别n/例时间总积分[M (P25,P75)]皮疹(主症) 积分[M (P25,P75)]次症积分[M (P25,P75)] 试验132治疗前20 (18,23)18 (16,20)3 (2,4) 治疗后0 (0,1)#^0 (0,0)# ^0 (0,0)#^ 试验232治疗前22 (20,26)18 (17,20)3 (2,5) 治疗后0 (0,0)#*^△0 (0,0)#* ^△0 (0,0)#* ^△ 中医对照31治疗前20 (18,24)18 (16,20)2 (2,4) 治疗后1 (0,9)#0 (0,8)#1 (0,1)# 西医对照30治疗前20 (17,22)18 (14,20)3 (2,4) 治疗后9 (3,15)#8 (0,14)#1 (0,2)# H 45.21528.22023.248 P <0.001<0.001<0.001
与同组治疗前比较:#<0.05;与试验1组治疗后比较:*<0.05;与中医对照组治疗后比较:^<0.05;与西医对照组治疗后比较:△<0.05
#< 0.05 vs same group before treatment;*< 0.05test group 1 after treatment:;^< 0.05 Chinese medicine control group;△< 0.05 western medicine control group after treatment
2.4 安全性比较
试验1组、试验2组、中医对照组各发生ALT升高者1例,中医对照组发生服药恶心呕吐者1例,西医对照组发生腹痛者2例。试验1组、试验2组、中医对照组、西医对照组患儿不良反应发生率分别为3.13%、3.13%、6.45%、6.67%,差异无统计学意义(>0.05)。
2.5 紫癜复发率比较
治疗期间试验1组中止2例(治疗期间肾脏损伤者1例,紫癜大量反复新出者1例);中医对照组中止6例(治疗期间肾脏损伤者4例,紫癜大量反复者2例);西医对照组中止3例(治疗期间肾脏损伤者3例,12周失访1例)。试验1组复发者2例,试验2组复发者3例,中医对照组复发者3例,西医对照组复发者7例,以试验1组、试验2组复发率较低,4组患儿皮疹复发率无统计学差异(<0.05),见表10。
2.6 肾脏损伤发生率比较
对治疗期间及随访期间出现的肾脏损伤情况进行统计,试验1组、试验2组、中医对照组、西医对照组患儿肾脏损伤发生率分别为6.25%、6.25%、22.58%、20.00%,无显著差异(>0.05),见表11。

表10 各组患儿紫癜复发率比较

表11 各组患儿肾脏损伤发生率比较
3 讨论
大多数学者认为RHSP是由免疫球蛋白A(immunoglobulin A,IgA)、IgE所介导的一种反复发作(发作次数≥3次)的全身性毛细血管的变态反应性疾病[7-9],RHSP的病因及病理机制涉及免疫紊乱、细胞因子表达失常、肠道微生物菌群失调等[10-14]。较寻常HSP相比,儿童RHSP的治疗更为复杂,也无统一的诊疗标准[15],探索新的治疗手段、控制皮疹新出、减少肾脏损伤是临床研究的目的所在。
中医将RHSP的病机归咎于“内有郁热兼外感伏邪”[16]。丁樱教授将其病机总结为热、瘀、虚3个方面[17],而风邪为致RHSP的主要病因[18-19],风邪入络,络脉闭郁,郁则化热、化火,火热与风邪搏结,损伤脉络,络损血溢,发为紫癜;治疗上则以祛风清热、凉血解毒、活血通络为法,据此研制紫癜I号方,切合RHSP热、瘀之病机。此外,临证中,丁樱教授常使用藤类药物治疗RHSP,以求入络搜邪、祛邪外出之功[20],对于紫癜反复发作,持久不消者,常在此基础上加用雷公藤以加强通络消斑之效,用于治疗RHSP之“络脉性疾病”[21-22],颇有良效。
雷公藤功能善解毒活血通络,通过对抗炎症反应、过敏反应,发挥免疫抑制作用[23-24],可促进皮肤紫癜消退。前期国家“十一五”“十二五”科技支撑计划研究证实了清热止血方联合雷公藤多苷片可有效减少紫癜性肾炎患儿皮疹新出并降低蛋白尿水平,且副作用可控。但由于雷公藤多苷片说明书“儿童禁用”标识,以及部分家长担忧其带来的性腺损害,使该药在儿科临床使用中受限。雷公藤颗粒经久煎过滤浓缩而成,其活性成分也被认为是毒性较强的雷公藤甲素(triptolide)、雷公藤红素(celastrol)等,经水煎后难以提取出,故其毒性相对较低。课题组前期研究初步表明0.025 g/(kg·d)雷公藤颗粒治疗RHSP有显著疗效,在国内首次根据儿童体质量开展了对特殊中药(雷公藤)精准治疗的先例。
本研究结果显示2个剂量的雷公藤颗粒在皮疹疗效上及临床疗效上均优于中医对照组、西医对照组(<0.05),以试验2组的疗效最高(96.88%、96.87%),提示雷公藤颗粒联合紫癜I号方能促进患儿皮疹消退、减少患儿皮疹新出。药理研究表明,雷公藤的主要成分为雷公藤甲素,具有抑制炎症、调节免疫、抗肿瘤等多种机制[25],可通过调节多种炎症信号通路,如核转录因子-κB(nuclear transcription factor-κB,NF-κB)、前列腺素E2受体亚型EP2-蛋白激酶A(prostaglandin E2 receptor subtype EP2-protein kinase A,EP2-PKA)通路等,减少炎症因子的释放,起到调节免疫的作用,从而改善皮疹、关节炎等症状[26-28]。雷公藤的安全性,尤其是其对性腺的影响是学术界及患儿家长最为关注的不良反应之一。本研究中月经已初潮的女性患儿用药后均无月经异常的发生,但由于所纳入的青春期女性患儿较少,故雷公藤颗粒对性腺的影响还需进一步研究。研究表明,雷公藤对性腺影响是可逆的[29-30],故只要合理选用剂型,把握好药物使用剂量,定期监测安全指标,那么针对儿童风湿免疫性疾病,雷公藤制剂也是可以使用的。
本研究首次在国内根据儿童体质量应用雷公藤颗粒,打破了既往中医根据经验应用“有毒中药”的常规剂量,率先开展了以体质量计算儿童应用“有毒”中药配方颗粒剂量的先例,体现了中医“有故无殒”的思想。
利益冲突 所有作者均声明不存在利益冲突
[1] Reamy B V, Servey J T, Williams P M. Henoch-schönlein(IgA vasculitis): Rapid evidence review [J]., 2020, 102(4): 229-233.
[2] 田云粉, 汤春辉, 李平, 等. 吗替麦考酚酯联合激素治疗难治性过敏性紫癜疗效观察 [J]. 中国医院药学杂志, 2020, 40(13): 1453-1457.
[3] Dyga K, Szczepańska M. IgA vasculitis with nephritis in children [J]., 2020, 29(4): 513-519.
[4] 丁樱, 李雪军, 张霞, 等. 雷公藤颗粒治疗儿童反复性过敏性紫癜的剂量探索 [J]. 中医学报, 2021, 36(4): 860-864.
[5] 江载芳, 申昆玲, 沈颖. 诸福棠实用儿科学 [M]. 第8版. 北京: 人民卫生出版社, 2015: 773-775.
[6] 郑筱萸. 中药新药临床研究指导原则: 试行 [M]. 北京: 中国医药科技出版社, 2002: 290-299.
[7] Gicchino M F, Iafusco D, Marrapodi M M,. Gastrointestinal Henoch-Schönleinsuccessfully treated with Mycophenolate Mofetil: Description of 2 case reports [J]., 2021, 100(1): e24093.
[8] AlGhoozi D A, AlKhayyat H M. A child with Henoch-Schonleinsecondary to a COVID-19 infection [J]., 2021, 14(1): e239910.
[9] 许杨, 雷根平. 雷根平辨治难治性过敏性紫癜经验 [J]. 山东中医杂志, 2020, 39(6): 588-591.
[10] McLaughlin S K, Lawrence L, Adler J,. Henoch-schönlein-associated hemorrhagic shock after secondaryinfection [J]., 2020, doi: 10.7759/cureus.11653.
[11] Chen L, Wang X, Yin L,. Effects of dexamethasone and gamma globulin combined with prednisone on the therapeutic effect and immune function of Henoch-Schonleinnephritis in children [J]., 2021, 35(1): e23580.
[12] Koskela M, Nihtilä J, Ylinen E,. HLA-DQ and HLA-DRB1 alleles associated with Henoch-Schönleinnephritis in Finnish pediatric population: A genome-wide association study [J]., 2021, 36(8): 2311-2318.
[13] Rasmussen C, Tisseyre M, Garon-Czmil J,. Drug-induced IgA vasculitis in children and adults: Revisiting drug causality using a dual pharmacovigilance-based approach [J]., 2021, 20(1): 102707.
[14] Kantor R, Galel A, Aviner S. Henoch-Schönleinpost-influenza vaccination in a pediatric patient: A rare but possible adverse reaction to vaccine [J]., 2020, 22(10): 654-656.
[15] 刘明月, 唐雪梅. 儿童过敏性紫癜治疗研究进展 [J]. 中国实用儿科杂志, 2015, 30(9): 676-680.
[16] 郑颖慧, 陈丽萍, 陈利国, 等. 从瘀论治过敏性紫癜中医研究进展 [J]. 辽宁中医药大学学报, 2018, 20(4): 104-107.
[17] 任献青, 郑贵珍, 管志伟, 等. 丁樱教授从热、瘀、虚辨治小儿过敏性紫癜性肾炎经验 [J]. 中华中医药杂志, 2013, 28(12): 3586-3588.
[18] 李雪军, 张霞, 胡明格, 等. 丁樱教授从“风”论治过敏性紫癜经验体会 [J]. 世界最新医学信息文摘, 2019, 19(45): 315-316.
[19] 郭庆寅, 张霞, 朱庆军. 丁樱教授分期辨治儿童过敏性紫癜的经验 [J]. 黑龙江中医药, 2020, 49(5): 62.
[20] 郑海涛, 丁樱, 尚东方, 等. 丁樱教授应用藤类药物治疗过敏性紫癜撷菁 [J]. 光明中医, 2015, 30(3): 604-605.
[21] 袁振华, 任献青, 丁樱, 等. 基于络病学说探讨小儿过敏性紫癜辨治规律 [J]. 中医杂志, 2021, 62(1): 75-78.
[22] 李爽, 张君, 张少卿. 张君从“络”论治过敏性紫癜 [J]. 中国中医基础医学杂志, 2019, 25(4): 465-466, 475.
[23] 廖海泉, 杨斌. 雷公藤多苷对咪喹莫特诱导的小鼠银屑病样皮损作用机制研究 [J]. 中国临床药理学杂志, 2021, 37(3): 288-291.
[24] Kong X, Zhang Y, Liu C,. Anti-angiogenic effect of triptolide in rheumatoid arthritis by targeting angiogenic cascade [J]., 2013, 8(10): e77513.
[25] 李佳鑫, 石金凤, 吴亿晗, 等. 雷公藤甲素抗乳腺癌的机制及应用进展 [J]. 中国中药杂志, 2021, 46(13): 3249-3256.
[26] 张艳艳, 樊冰, 李大可, 等. GTW调节胆碱能抗炎通路改善胶原诱导性关节炎[J]. 中药材2021(1): 1-5.
[27] 白雪, 付瑞嘉, 乐世俊, 等. 雷公藤治疗类风湿性关节炎研究进展[J].中草药, 2020, 51(1): 265-275.
[28] 姜淼, 张海波, 丁樱. 雷公藤多苷药理作用及临床应用研究进展 [J]. 中华中医药学刊, 2021, 39(3): 59-63.
[29] 孟天琦, 马宏博. 雷公藤生殖毒性机制研究进展 [J]. 中华中医药学刊, 2020, 38(3): 196-198.
[30] Jing X, Cheng W, Guo S,. Toxic effects ofHook F on the reproductive system of adolescent male rats [J]., 2017, 95: 1338-1345.
Clinical study on different dosage ofGranules combined with Purpura No. I prescription in treating children with recurrent Henoch-Schönlein purpura
DING Ying1, 2, 3, LI Xue-jun1, 2, 3, ZHANG Xia1, 2, HAN Shan-shan1, 2, XU Shan-shan1, 2, 3, DAI Yan-lin1, 2, 3, SUN Zhao-heng1, 2, 3, SUN Li-hui1, 2, 3
1. The First Affiliated Hospital of Henan University of Traditional Chinese Medicine, Zhengzhou 45000, China 2. School of Pediatrics, Henan University of Traditional Chinese Medicine, Zhengzhou 45000,China 3. Henan University of Traditional Chinese Medicine, Zhengzhou 450000, China
To explore the efficacy and short-term safety of different doses ofGranules (雷公藤颗粒) combined with Purpura No. I prescription (紫癜I号方) for children with recurrent Henoch-Schönlein purpura.A total of 144 children with RHSP were screened from the pediatric kidney disease area of the First Affiliated Hospital of Henan University of Traditional Chinese Medicine from April to December 2020. They were randomly divided into test 1 group, test 2 group, Chinese medicine control group and western medicine control group. Test 1 group was given 0.025 g/(kg·d)Granules [0.5 g/(kg·d) ofdecoction]+Purpura No. I prescription, test 2 group was given 0.035 g/(kg·d)granules [0.7 g/(kg·d) ofdecoction]+Purpura No. I prescription, Chinese medicine control group was given Purpura No. I prescription, and western medicine control group was given loratadine+vitamin C+Prednisone Tablets. All children were treated for 4 weeks and followed up for 8 weeks to comparative efficacy and adverse effects.The curative effect of skin rash and clinical efficacy in test 1 group and test 2 group were better than that of Chinese medicine control group and the western medicine control group, the differences were statistically significant (< 0.05). The total scores of Traditional Chinese medicine (TCM) symptoms, rash (primary symptom) scores, and secondary symptom scores of test 2 group after treatment were better than those of test 1 group, Chinese medicine control group, and western medicine control group, the differences also were statistically significant (< 0.05). There were no significant differences in the incidence of adverse reactions, rash recurrence, and renal injury in the four groups (> 0.05).0.025 g/(kg·d) and 0.035 g/(kg·d)Granules combined with Purpura No. I prescription both can promote the regression of rash in children, and the total effective rate of 0.035 g/(kg·d)Granules were higher, no obvious adverse reactions were found on short-term clinical application.
recurrent Henoch-Schönlein purpura;Granules; Purpura No. I prescription; clinical research; children
R285.64
A
0253 - 2670(2021)24 - 7569 - 08
10.7501/j.issn.0253-2670.2021.24.019
2021-05-20
河南省特色骨干学科中医学学科建设项目(STG-ZYXKY-2020010);河南省中医药科学研究专项课题(20-21ZY2031);中国民族医药学会科研项目(2020ZY265-400603);全国名中医工作室建设项目(2100601-CZ0138);国家自然基金面上项目(81873343);河南省中医药科学研究专项课题(2019ZY1010)
丁 樱(1951—),女,汉族,博士后导师,主任医师,终身教授,国家首批名中医,长期从事小儿肾脏病的研究。Tel: 18037170642 E-mail: dingying3236@sina.com
[责任编辑 潘明佳]
