二维Z型BCN/Sn3O4复合材料的光催化还原性能
2021-12-16王乙舒徐红赟祝玉鑫宋艳华崔言娟
王乙舒,李 雪,闫 丽,徐红赟,祝玉鑫,宋艳华,崔言娟
(江苏科技大学环境与化学工程学院,镇江212100)
利用光催化技术在温和的反应条件下制备具有高附加值的清洁能源,如分解水制H2,氧还原制H2O2,CO2还原制CO等,是太阳能利用的重要研究方向[1~4].氮化碳作为非金属聚合物半导体的典型代表,在光催化领域的应用研究具有重要意义[5].尽管氮化碳(CN)具有结构稳定及价廉易得等优势,但聚合物本身较低的电荷传输性及较高的载流子复合率仍是阻碍其高效光催化应用的主要因素[6].
优化微观电子结构及加速电荷传输性是提高CN光催化活性的重要措施.非金属(B,O,I等)键合掺杂方式在维持聚合物基本结构的同时,能够利用元素间的电负性差异引导电荷重新分散,增强电荷的流动性[7~9].其中,硼元素作为典型的缺电子元素,键合入氮化碳杂环骨架能够有效促进电荷离域,已被证实能够显著增强其光催化性能[10].高密度光生载流子的产生,同时结合快速的电子-空穴迁移及分离通道,这是加速光催化反应的必要条件.复合半导体异质界面的构建,尤其是Z型异质结构的建立,能够有效湮灭低氧化-还原性空穴-电子,在两相半导体间保留高氧化-还原能力,是开发高效光催化剂的有效途径[11~13].
Sn3O4是一种具有中等价态和非化学计量比的化合物,丰富的氧空位使其具有优异的理化性质[14].理论和实验研究表明,Sn3O4具有较低的带隙,表现出优异的可见光响应和光电转换性能,具有光催化应用的价值,但相对较高的氧化电位使其在光催化还原应用中活性较低[15].异质结构的构建是提高其光催化活性的重要手段.Yang等[16]通过化学氧化聚合和水热两步法将多孔Sn3O4纳米片固定在聚吡咯(PPy)中空纳米棒上,构建了一种新型Sn3O4/PPy异质结构光催化剂,最佳产氢活性是纯Sn3O4的7.52倍.Wang等[17]通过超声辅助沉淀沉积和水热法相结合制备了一系列p-n异质结型光催化剂Sn3O4/BiOX(X=Cl,Br,I),研究结果表明,当铋/锡摩尔比最佳时,BiOCl可以在Sn3O4表面形成足够的空间电荷区域,从而促进光生电子-空穴对的分离,说明异质结构催化剂中高质量界面在改善光催化性能方面起着关键作用.最近,Dong等[18]将Sn3O4纳米簇生长在C3N4表面,构建了Sn3O4/C3N4异质结构,在光降解抗生素废水中表现出增强的光催化性能.
利用二维纳米片材料特有的层状结构构建二维-二维(2D-2D)面-面复合型异质结能最大限度地增加界面接触,从而形成稳定高质量的界面异质结构.与CN材料类似,采用合适的合成方法可得到Sn3O4二维纳米片[19].由二维CN和Sn3O4组装建立稳定的Z型异质结构,并在此基础上进行进一步的修饰改性,有望大幅度提升其光催化性能.本文以硼掺杂氮化碳(BCN)和Sn3O4为研究对象合成BCN/Sn3O4二维复合材料,并对其光解水制氢(H2)及活化氧制过氧化氢(H2O2)的光催化活性进行评价.通过调控Sn3O4的复合比例及探索不同的复合合成方式,得到光催化还原性能显著提升的复合材料,并结合结构表征和光电化学分析,确定了二维异质界面的建立及Z型光生电荷的迁移机制.
1 实验部分
1.1 试剂与仪器
二水合氯化锡(SnCl2·2H2O)、二水合柠檬酸钠(Na3C6H5O7·2H2O)、氢氧化钠(NaOH)、三聚氰胺、氧化硼(B2O3)、三乙醇胺和氯铂酸均为分析纯,购于国药集团化学试剂有限公司.
D/max 2500PC型X射线衍射仪(XRD,日本电子株式会社,CuKα射线,波长为0.1504 nm,测试电压为40 kV,测试电流为30 mA,扫描速率为5°/min);SU8010扫描电子显微镜(SEM,日本日立公司);JEOL JEM 2100F型透射电子显微镜(TEM,日本电子株式会社);UV-2550型紫外-可见分光光度计(UV-Vis,日本Shimadzu公司,以BaSO4为参考物质);QuantaMasterTM40型稳态荧光光谱分析仪(PL,美国PTI公司,样品激发波长396 nm);Thermo ESCALAB 250XI型X射线光电子能谱仪(XRD,美国热电赛默飞世尔科技公司);CHI660E型电化学工作站(上海辰华仪器有限公司,电解液为0.2 mol/L Na2SO4溶液,铂片和饱和甘汞电极分别作为对电极和参比电极);GC-7920型气相色谱仪(GC,北京中教金源科技有限公司).
1.2 催化剂的制备
1.2.1 Sn3O4的制备将SnCl2·2H2O(0.90 g,4.0 mmol)和Na3C6H5O7·2H2O(2.94 g,10 mmol)搅拌溶解于10 mL纯水中,再加入10 mL 0.2 mol/L NaOH溶液并持续搅拌,将得到的均匀溶液转移至50 mL内衬为聚四氟乙烯的反应釜中.移入180℃烘箱恒温加热12 h,自然冷却至室温后离心分离沉淀物,用纯水和乙醇分别洗涤数次.将固体产物在60℃下干燥得到橘黄色粉末Sn3O4.
1.2.2 BCN的制备将三聚氰胺(4.0 g)和氧化硼(0.1 g)搅拌溶解于20 mL纯水中,在80℃下水浴加热干燥得到混合白色固体.将所得固体置于加盖坩埚中于马弗炉中煅烧(升温速率5℃/min,恒温550℃煅烧4 h).自然冷却后得到淡黄色固体BCN.
1.2.3 BCN/Sn3O4的制备将0.5 g BCN和一定量的Sn3O4(Sn3O4与BCN质量比分别为1%,3%,5%,7%)加入到30 mL无水乙醇中并超声分散6 h,继续连续搅拌24 h后置于60℃烘箱中干燥得到复合产物,记为BCN/Sn3O4-XU(X为Sn3O4与BCN的质量比,U代表超声复合法合成).将一定量BCN/Sn3O4-3U置于马弗炉中煅烧(升温速率5℃/min,恒温400℃煅烧3 h)得到BCN/Sn3O4-3C(C代表煅烧法合成).类似的,将0.5 g BCN和0.015 g Sn3O4直接研磨得到混合样品BCN/Sn3O4-3M(M代表直接机械混合合成).
1.3 光催化性能测试
1.3.1 光解水制氢称取一定量催化剂分散于100 mL 10%(体积分数)三乙醇胺的水溶液中,将适量氯铂酸水溶液(H2PtCl6·6H2O,0.04 g/mL)加入到上述溶液中并搅拌30 min.系统抽真空,使用300 W氙灯光源(400 nm cut滤光片)进行光照,3%(质量分数)的Pt原位光沉积在催化剂表面.每隔20 min通过气相色谱[热导检测器(TCD),N2为载气]在线自动取样分析H2的产量.在连续长时间光照测试过程中,催化剂用量为25 mg,其它制氢测试过程催化剂用量为50 mg.
1.3.2 活化氧制过氧化氢将50 mg催化剂分散于100 mL纯水中,使用300 W氙灯光源(400 nm cut滤光片)进行光照,每隔60 min取样3 mL,离心取上层清液进行H2O2检测.检测方法:将0.5 mL指示剂(含质量分数1%的邻联甲苯胺的0.1 mol/L盐酸溶液)加入到2 mL上层清液中,放置2 min后加入2 mL 1 mol/L的盐酸溶液,用紫外-可见分光光度法检测吸光度(436 nm).
2 结果与讨论
2.1 催化剂的表征
利用XRD对所制备的BCN/Sn3O4复合材料、BCN和Sn3O4进行物相结构分析[图1(A)].可见,BCN仍保持典型的石墨相堆积结构,其中2θ=13.0°和27.6°处的峰分别对应平面内七嗪杂环的有序排列(100)面及二维类石墨层间堆积(002)面[20].Sn3O4的衍射峰与三斜晶系Sn3O4(JCPDS No.16-0737)相符.2θ=31°~33°范围内的宽衍射峰属于Sn3O4的(2ˉ10)晶面,(1ˉ21)晶面和(210)晶面,2θ=50°~53°范围内的衍射峰对应Sn3O4的(1ˉ4ˉ1),(1ˉ3ˉ2)和(311)晶面[21].从复合材料的XRD谱图中可以观察到源自Sn3O4和BCN两相的衍射峰,而BCN的(002)衍射峰强度略有降低,说明片状Sn3O4可嵌入BCN层间形成复合物,对BCN层间堆积有序度有一定影响.
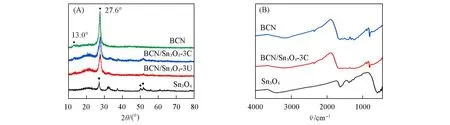
Fig.1 XRD patterns(A)and FTIR spectra(B)of BCN,Sn3O4 and BCN/Sn3O4 samples
图1 (B)为BCN,Sn3O4及BCN/Sn3O4-3C的FTIR谱图.可见,BCN样品在808 cm−1处和1200~1600 cm−1范围内具有显著吸收,分别归属于三嗪环的骨架振动和CN杂环的伸缩振动[22].在2300 cm−1附近处出现弱吸收峰,源于B掺杂合成过程抑制了CN的面内聚合,产生少量末端氰基(C≡N)[23].由Sn3O4谱图可见,位于550 cm-1处吸收峰证明Sn—O键的存在[24].BCN/Sn3O4-3C样品的FTIR谱图与BCN的类似,说明少量Sn3O4的参与不影响BCN本身的微观聚合结构.

Fig.2 SEM images of Sn3O4(A,B),BCN(C)and BCN/Sn3O4⁃3C(D),EDS spectra of BCN(E)and BCN/Sn3O4⁃3C(F)
图2 为所制备样品的SEM照片及X射线能谱(EDS)图.由图2(A)和(B)可见,Sn3O4是由二维纳米片组装成0.5~1.5 μm大小的花状微球,片层大小约为200 nm,厚度约为10~20 nm.二维片状结构有助于与二维聚合物BCN形成面-面接触型复合材料.图2(C)和(D)分别为BCN及BCN/Sn3O4-3C的SEM照片,可见复合产物与BCN的形貌基本保持一致,呈无规则片状堆积.从图2(E)和(F)可以看出,BCN除了含有C,N,O之外,还含有B元素,BCN/Sn3O4-3C样品中同时检测到B及Sn元素,说明BCN/Sn3O4-3C为BCN和Sn3O4的复合产物.
图3 为复合样品BCN/Sn3O4-3C的TEM及HRTEM照片.从图3(A)和(B)中可以看到,Sn3O4纳米片尺寸大小约为200 nm,厚度20 nm左右,与SEM结果一致.Sn3O4纳米片与BCN纳米片形成紧密的面-面复合结构.通过HRTEM照片可以清晰地观察到两相界面及Sn3O4特有的晶格特征[图3(C)和(D)].其中,晶格间距0.362,0.329,0.283,0.174及0.165 nm分别对应Sn3O4的(101),(111),(2ˉ10),(311)及(24ˉ1)晶面,与XRD结果一致[25].

Fig.3 TEM(A,B)and HRTEM(C,D)images of BCN/Sn3O4⁃3C sample
采用XPS对复合材料的表面微观键合结构进行了分析.图4(A)为BCN,Sn3O4及BCN/Sn3O4-3C复合样品的XPS总谱图,在BCN/Sn3O4-3C样品谱图中显示出C,N,B,Sn及O元素,表明含有BCN及Sn3O4两相组分.图4(B)~(F)为组成元素高分辨XPS谱图.BCN的C1s和N1s谱图中均可以观察到3个拟合峰,其中C1s(288.17 eV)及N1s(398.63 eV)共同归属于骨架sp2杂化C—N=C.而284.60,286.30,400.09和401.16 eV处的峰分别归属于BCN中C—C、少量C—O、桥连N—C3和末端不完全聚合C—N—H[26].对B1s谱进行精细拟合分析后可以由191.6 eV附近的峰确定B—N键的存在,来源于B取代sp2杂化C[27].对BCN/Sn3O4-3C及BCN和Sn3O4样品的元素拟合峰进行对比分析发现,BCN/Sn3O4-3C的C1s及N1s谱中sp2杂化C—N=C及B—N的键合能均向低能位置偏移.同时,复合样品中Sn3d谱及O1s的键合能均向高能位置偏移,说明复合结构的构建使得两相材料间产生了界面效应,存在界面间Sn3O4向BCN的电荷转移[28].有效界面异质结构的建立有利于促进半导体光生电荷的迁移,进一步提升光催化氧化还原的转化效率[29].
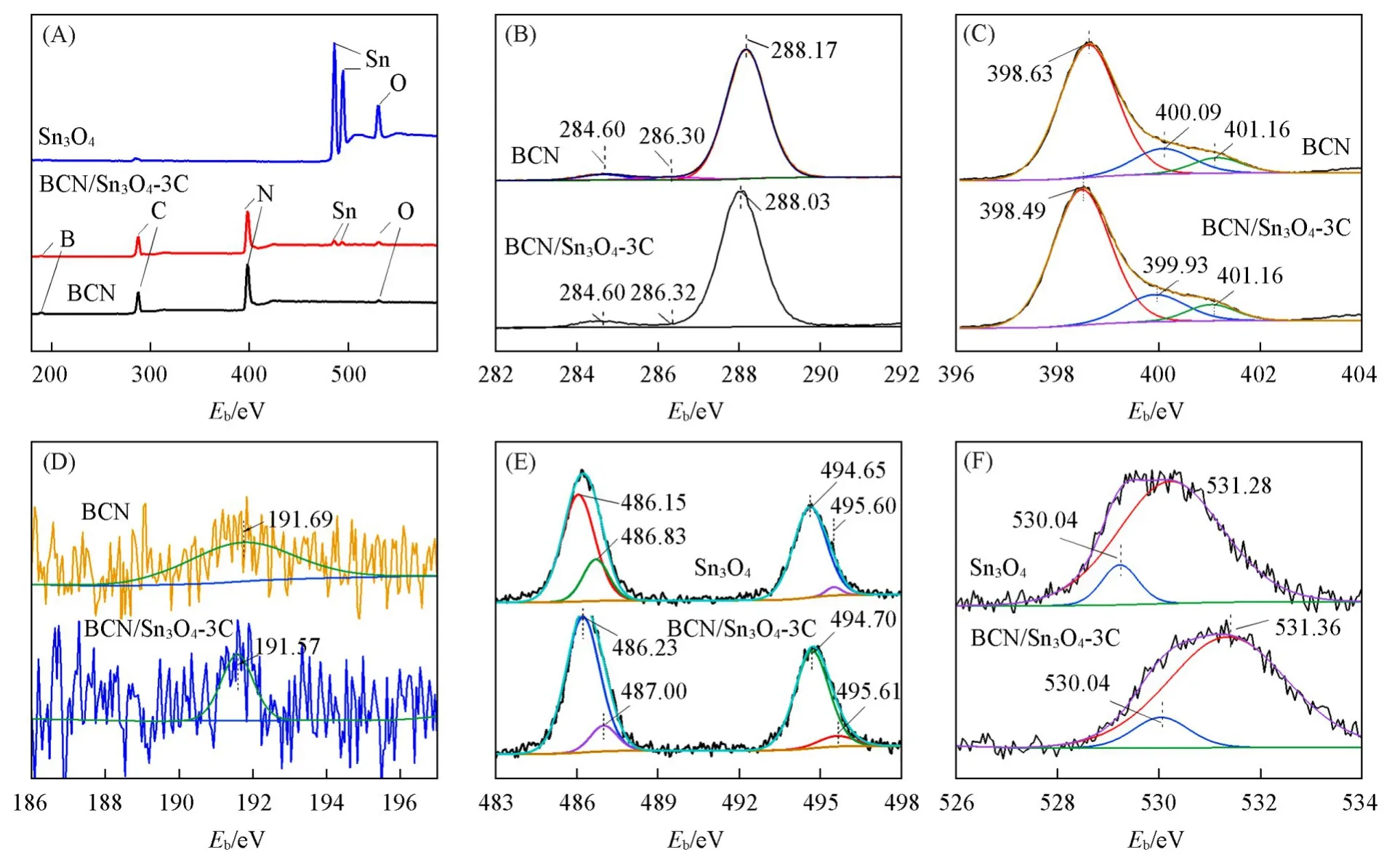
Fig.4 XPS survey spectra(A)and high⁃resolution XPS spectra of C1s(B),N1s(C),B1s(D),Sn3d(E)and O1s(F)of BCN,Sn3O4 and BCN/Sn3O4⁃3C samples
2.2 光/光电性质的分析
BCN及Sn3O4均为典型的可见光响应型催化剂.由图5(A)可见,复合样品的光吸收曲线与BCN类似,带边略微发生红移,说明BCN与少量Sn3O4复合后提高了对可见光的吸收和响应.利用UV-Vis漫反射光谱进行Kubelka-Munk转化可获得半导体禁带宽度[图5(B)].可见,BCN和Sn3O4的带隙宽度分别为2.68和2.49 eV,BCN/Sn3O4-3C的带隙与BCN相比降低至2.64 eV.增强的光吸收能力和降低的带隙宽度有利于提高催化剂的光响应及光电转化效应,从而有利于提升光催化活性.
荧光测试是表征半导体光生载流子激发-猝灭的有效方式.从图6(A)可见,BCN在460 nm附近具有明显的宽PL发射峰,来源于激发电子-空穴的瞬时猝灭.复合样品BCN/Sn3O4具有明显降低的PL发射峰,其中煅烧复合所得样品BCN/Sn3O4-3C峰强降低得更明显,说明相对于BCN,复合样品中激发态电子-空穴对的复合率大幅度降低,更多“自由态”光生电子可直接参与光催化还原反应,且煅烧合成法能够更有效地形成有效界面复合,加速界面间电荷的传输[30].
电化学测试方法可以直观地分析催化剂的光电响应,间接反映催化剂光生电荷的产生和分离效率.图6(B)为所制备材料在可见光照下的瞬时光电流响应曲线,3种材料均具有一定的光电流信号产生,其中BCN/Sn3O4-3C表现出最强的瞬时光电流值,分别约为BCN和Sn3O4的3.5倍和2倍,表明复合样品能够产生更高的载流子密度.经过多次间歇开/关光照测试,BCN/Sn3O4-3C仍保持稳定的光电流响应信号,说明其具有良好的光电活性稳定性.电化学阻抗可表示电荷在半导体中的传输性能,其阻抗值越小说明电荷传输电阻越小.图6(C)为所制备材料的电化学阻抗图,同样,BCN/Sn3O4-3C谱图具有最小的Nyquist谱半径,说明其具有最低的电荷传输阻力.因此电化学测试结果表明,BCN/Sn3O4复合结构的建立显著增强了BCN材料的光电响应活性,更高的电荷载流子密度和低的电荷传输阻力有利于提高光催化反应效率.

Fig.6 Fluorescence emission spectra(A),photocurrent response(B)and impedance spectroscopy(C)of samples
2.3 光催化性能
图7 (A)给出超声复合法得到的BCN/Sn3O4及单组分样品的光解水制氢活性.经过1 h光照反应,不加Pt的CN反应体系中几乎检测不到H2,含有Pt的反应体系中CN与Sn3O4的制氢量分别为18.1和27.4 μmol,说明Pt作为助催化剂在光解水制氢反应过程中至关重要.通过原位B掺杂得到的BCN样品的制氢活性(48.6 μmol)与CN相比得到明显提高.缺电子元素B掺杂能够调控CN的电荷分布,有利于电荷密度向活性反应位的定向迁移,从而提升光催化反应活性.通过简单超声复合法得到的一系列复合样品BCN/Sn3O4-U,其制氢活性与BCN相比均有一定提升,其中BCN/Sn3O4-3U产氢量最高(122.5 μmol),分别为BCN和Sn3O4活性的2.5倍和4.7倍.
稳定有效的界面构建是复合光催化材料活性提升及结构和活性稳定的重要前提.进一步采用煅烧法制备了复合样品BCN/Sn3O4-3C.图7(B)为不同合成方法得到的BCN/Sn3O4复合样品的活性对比图.与超声法所得产物BCN/Sn3O4-3U相比,经1 h光照反应后BCN/Sn3O4-3C制氢活性进一步得到提高(189.1 μmol).作为对比,直接机械混合法得到的BCN/Sn3O4-3M制氢活性仅为51.1 μmol.因此,煅烧合成法有助于得到稳定有效的复合界面,紧密接触的界面有利于两相间建立内建电场从而产生电荷迁移.在光照下,Sn3O4的光生电子向BCN迁移并与BCN的光生空穴发生复合,同时抑制了两相的电子-空穴对复合,产生更多的自由光生电子,从而具有更高效的光催化制氢活性.
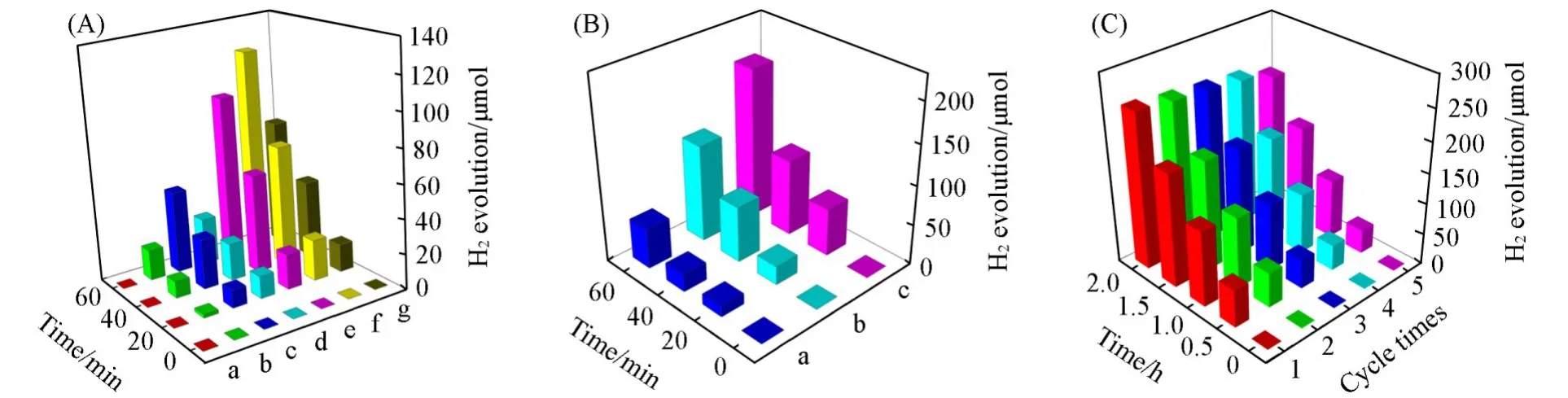
Fig.7 H2 evolution of BCN,Sn3O4 and BCN/Sn3O4 from ultrasonic synthesis(A),H2 evolution of BCN/Sn3O4 from different synthetic routes(B)and activity stability of BCN/Sn3O4⁃3C(C)
活性稳定性是评价催化剂实用性的重要参数.对BCN/Sn3O4-3C样品进行了多次循环使用的产氢活性稳定性测试[图7(C)],可见,经过5次循环反应,连续光照10 h,催化剂产氢活性依然保持在110.4 μmol/h,与初始反应速率125.9 μmol/h相比仅略有下降.因此可以说明,此催化剂在连续反应过程中基本可保持良好的活性稳定性.
在可见光照下对催化剂进行了光催化制备H2O2的活性评价测试.图8(A)给出了催化剂在连续可见光照下的制H2O2活性.可见,BCN与Sn3O4均具有一定的光催化产H2O2活性,且H2O2产量与光照时间呈正相关性,说明二者均具有稳定的光催化制备H2O2的反应能力.简单机械混合法得到BCN/Sn3O4-3M样品活性接近Sn3O4的活性,并没有得到显著提升.相反,超声法和煅烧法得到的复合产物BCN/Sn3O4-3U和BCN/Sn3O4-3C的活性显著提高.其中,BCN/Sn3O4-3C具有最佳的光催化活性,经过4 h光照,H2O2产量达623.5 μmol,分别为BCN和Sn3O4的5.7倍和3.1倍.为了进一步分析H2O2的产生途径,在不同气氛中对BCN/Sn3O4-3C的光催化制H2O2活性进行了测试[图8(B)].可见,不同反应气氛下的催化活性大小顺序为O2>空气>N2.可以推测,H2O2的产生主要源自催化剂活化O2制H2O2[31].图8(C)为BCN/Sn3O4-3C在O2氛围中连续光照下的反应活性曲线.随着光照时间的延长,H2O2产量不断增加,在光照8 h左右基本达到平衡,随后出现下降趋势.这是由于在光催化制H2O2过程中同时存在H2O2生成及分解两个相互竞争的过程[32].对长时间连续反应后的BCN/Sn3O4-3C进行分离并进行了XRD[图8(D)]及TRTEM[图8(D)插图]分析.反应后的产物依然保持BCN和Sn3O4两相组成,并具有较好的复合界面接触,证明了其具有良好的结构稳定性.

Fig.8 H2O2 production of BCN,Sn3O4 and BCN/Sn3O4 samples(A),H2O2 production in different atmosphere(B),reaction persistence in O2(C),XRD spectrum and HRTEM image(inset)of after long time reaction BCN/Sn3O4⁃3C(D)

Fig.9 Mott⁃Schottky curves of BCN(A)and Sn3O4(B),PL spectra of BCN in terephthalic acid solution(C),comparation of PL intensity between BCN and BCN/Sn3O4⁃3C(D),PL spectra detected in H2O2 solution with different concentrations(E)and mechanism diagram of photocatalytic oxygen reduc⁃tion to H2O2 of BCN/Sn3O4⁃3C(F)
为了进一步解释H2O2的生成过程,对催化剂能带结构进行了分析.图9(A)和(B)分别为BCN和Sn3O4的莫特-肖特基曲线,其平带电势值可近似看作n型半导体材料的导带位置.由测试结果可知,BCN和Sn3O4的导带位置分别为−0.86和−0.43 V(vs.SHE).结合带隙值可以推测,BCN和Sn3O4的价带位置分别为1.82和2.06 V(vs.SHE).通过匹配的能带位置以及界面间存在Sn3O4向BCN电荷迁移的表征测试结果可以预测,BCN与Sn3O4界面间属于Z型异质结构.
进一步采用对苯二甲酸化学荧光法对H2O2的生成过程进行解释.图9(C)显示了可见光照下BCN化学荧光法检测·OH的谱图.根据BCN的能带位置可知,其价带位置不足以直接氧化H2O生成·OH[E(·OH/H2O)=2.27 eV;E(·OH/OH−)=1.99 eV(vs.SHE)][33].由此可以预测·OH的产生间接来源于O2还原(O2→·O2−→H2O2→·OH).而在相同条件下,图9(D)显示BCN/Sn3O4-3C的荧光发射峰强度显著增强,表明提高了·OH的产生浓度,间接反映出复合异质结构的建立抑制了光生电荷的复合,加速了光反应的进行.图9(E)为在有光/无光照条件下对不同浓度H2O2溶液进行化学荧光测试的结果.可见,在无光照条件下,几乎检测不到PL发射信号,而在光照条件下,随着H2O2浓度的不断提升,PL发射峰强度不断增强,间接证实了图9(C)和(D)中·OH的产生来源于光照反应过程中产生的H2O2.图9(F)为复合催化剂光催化氧还原制H2O2过程的示意图.Z型异质结的建立使得在无牺牲剂的条件下BCN价带空穴被Sn3O4导带电子复合消耗,抑制了自身载流子的复合率,增强了光生电子密度,从而有利于光还原反应的进行.
3 结 论
分别利用直接煅烧法和超声复合法制备了结构稳定的BCN/Sn3O4复合光催化剂,并进行了可见光催化分解水制氢及氧还原制H2O2的活性评价.结果表明,煅烧复合法相对于超声复合法,更有利于有效异质结构的建立,两相材料之间形成了Z型结构,抑制了光生电荷复合的同时能够增强光生电荷密度,有利于光还原反应的进行.Sn3O4与BCN质量比为3%的复合样品BCN/Sn3O4-3C表现出最佳的光催化活性,产氢速率为189.1 μmol/h,分别为BCN和Sn3O4的3.9倍和6.9倍,制H2O2活性为155.8 μmol/h,分别为BCN和Sn3O4的5.7倍和3.1倍,为构建氮化碳基Z型光催化体系提供了新的研究思路.
