基于TMT10-plex等量标记结合SMOAC富集磷酸肽的定量磷酸化蛋白质组性能评价
2021-12-16赵欢欢李存玉
赵欢欢,李存玉,金 红
(复旦大学生物医学研究院,上海200032)
蛋白质磷酸化是生物体内广泛存在的最重要的共价修饰方式之一.细胞内有30%以上的蛋白质发生磷酸化修饰[1].蛋白质磷酸化是指蛋白质在磷酸化激酶的催化下将三磷酸腺苷(ATP)或三磷酸鸟苷(GTP)上的磷酸基团转移到丝氨酸、苏氨酸或酪氨酸残基上的可逆过程.激酶诱导蛋白质磷酸化,磷酸酶诱导蛋白质去磷酸化,这一可逆过程能调节和控制蛋白质活力和功能,参与各种生理和病理过程,包括细胞增殖、发育分化、细胞凋亡、信号转导及肿瘤发生等生命活动.因而,基于质谱的磷酸化研究在蛋白质组学研究中的作用尤为重要[2,3].
磷酸化蛋白丰度较低,因此在质谱鉴定前通常需要进行磷酸化肽段富集步骤.目前常用的富集方法[4]包括强阳离子交换色谱(SCX)、固相金属离子亲和色谱(IMAC)、金属氧化物亲和色谱(MOAC)以及免疫吸附(利用抗体特异性富集酪氨酸磷酸化肽段)等,其中应用最广泛的是IMAC[5~7]和MOAC[8~10].但是,每种方法对样品磷酸化蛋白组的覆盖度都是有限的,有研究[11]比较了不同的磷酸肽富集方法,包括磷酸酯化学、IMAC和TiO2色谱,结果显示每种方法分离出的磷酸化蛋白质组是不同的、只有部分重叠,这意味着目前没有任何单独的一种富集方法能够全面地分析磷酸化蛋白质组.然而,定量分析磷酸化蛋白质组的必要前提是分离出磷酸化蛋白或磷酸化肽,理想的方法是无偏向地分离出样品中所有的磷酸化肽,且重现性和特异性高.尽管分离磷酸化蛋白和磷酸化肽的方法已经取得了长足的进展[12~17],但具备上述理想性质的技术尚未开发出来.
为了获得尽可能全面的磷酸化蛋白质组,需要使用互补的方法来完成富集.Thingholm等[18]开发了MOAC与IMAC相结合的磷酸肽富集方法,提高了富集磷酸化肽段的选择性和灵敏度.此后,IMAC和MOAC的顺序洗脱富集方法(SIMAC,Sequential elution from IMAC)在各种大规模的磷酸化蛋白质组学研究中获得了广泛应用[19~21].Sun等[22]通过在复杂生物样品中添加磷酸肽标准品测试了SIMAC方法的重复性和线性,结果显示SIMAC方法对大多数磷酸肽只有有限的线性和重复性,可能是每个生物样品单独富集时由磷酸化富集方法本身引入的差异,或是电离过程中不同磷酸化肽的电离水平不同引起的,也可能是由两者结合导致的.为了避免多次富集可能引入的差异,近年来多使用等重标记技术定量磷酸化蛋白质组,用等重同位素标记不同组的肽段,将其混合后再进行磷酸化富集,不同组的样品得以同步完成磷酸化富集.然而,由于磷酸化肽段丰度极低,如需深度挖掘还要在LC-MS/MS分析前使用液相色谱对标记或者富集后的肽段混合物进行组分分离以降低样本复杂度[23,24],同时对样本需求量也较大.
本文旨在开发能够灵敏、高效、全面地定量磷酸化蛋白质组的技术,在SIMAC的基础上探索了另一种顺序组合的富集方法SMOAC(Sequential enrichment of MOAC).考虑到大规模磷酸化蛋白质组学应用中,样品需求量大以及分别富集引入的差异等问题,我们将SMOAC与等重同位素标记技术相结合,对各个样品酶解后的肽段进行等重同位素标记,然后混合,再用SMOAC富集磷酸化肽段.这不仅减少了样品的需求量,避免了多个样品因多次富集引入的差异,也减少了磷酸化肽段的损失,提高了富集效率,从而实现更准确的磷酸化蛋白质差异定量分析.紫草素能抑制人肝癌细胞HepG2的增殖,诱导HepG2细胞凋亡,研究发现经紫草素处理后的HepG2细胞中磷酸化蛋白的表达有变化[25].本文将SMOAC结合TMT-10PLEX试剂等量标记的方法对经紫草素处理的及正常的人肝癌HepG2细胞进行磷酸化差异蛋白分析,以研究方法的可行性,并探索了样品经SMOAC富集后获得单磷酸化肽和多磷酸化肽段的最优采集方式.
1 实验部分
1.1 试剂与仪器
人肝癌HepG2细胞株(中国科学院上海细胞生物学研究所细胞库);紫草素(大连美仑生物技术有限公司);DMEM培养基(Dulbecco’s modified eagle medium)、胎牛血清(FBS)、胰酶、青链霉素混合液(PS)、甲酸(FA,质谱纯)、0.5 mol/L三(2-羧乙基)膦还原剂(TCEP)、1 mol/L四乙基溴化铵(TEAB)和蛋白酶及磷酸酶抑制剂混合物[Protease and Phosphatase Inhibitor Cocktail(100×)]均购自美国Thermo Fisher公司;磷酸盐缓冲液(PBS)购自Adamas试剂有限公司;尿素(Urea,分析纯)、十二烷基硫酸钠(SDS)和碘乙酰胺(IAA)购自国药集团化学试剂有限公司;三氟乙酸(TFA)购自美国Sigma公司;乙腈(ACN,质谱纯)和甲醇购自德国Merck公司.
MilliQ超纯水系统(美国Millipore公司);C18除盐柱(美国Waters公司);C18反相色谱柱、High-Select™TiO2Phosphopeptide Enrichment Kit(TiO2磷酸化肽段富集试剂盒)、High-Select™Fe-NTA Phosphopeptide Enrichment Kit(Fe-NTA磷酸化肽段富集试剂盒)、TMT10plex™Isobaric Label Reagent Set(同位素标记试剂)、-80℃超低温冰箱、Easy-nLC1200型超高效液相色谱仪及Thermo Scientific™Orbitrap Exploris 480型质谱仪(美国Thermo Fisher公司).
1.2 实验过程
1.2.1 细胞培养、分组及给药人肝癌HepG2细胞株经复苏后加入DMEM培养基(10%FBS+1%PS)中,于37℃,5%CO2条件下培养.取对数生长期细胞进行后续实验:0.25%胰酶消化、细胞计数,并取细胞接种于6孔培养板中,每孔1×105个,然后放入培养箱中培养.当细胞生长至80%时开始给药处理.实验设置正常对照组(C1~C6)和处理组(T1~T6),每组6个复孔,处理组加入紫草素(终浓度为10×10-6mol/L),正常对照组加入等量的空白培养基,置于培养箱中培养24 h后收集细胞,用预冷的PBS缓冲液清洗2次,细胞沉淀于-80℃保存,备用.
1.2.2 细胞蛋白质提取、酶解及标记与C18除盐向每管HepG2细胞沉淀中加入8 mol/L Urea+0.1%SDS(质量/体积)并混合均匀,所用裂解液中包含Protease and Phosphatase Inhibitor Cocktail(100×),置于冰上裂解30 min,裂解产物于低温下以12000 r/min转速离心30 min.对上层清液采用二喹啉甲酸(BCA)法测定蛋白浓度.根据BCA所测浓度每个样品取100 μg蛋白溶液,各加入0.5 mol/L TCEP(终浓度10×10-3mol/L),于37℃孵育1 h进行还原反应;避光加入1 mol/L IAA(终浓度40×10-3mol/L),于室温避光静置45 min进行烷基化反应;然后,加入6倍体积于-20℃预冷的丙酮沉淀4 h,以低温12000 r/min转速离心20 min后去掉上层清液;将沉淀用预冷的90%丙酮清洗2遍,高速离心后去掉上层清液,待沉淀表面液体挥发后用100 μL 0.1 mol/L TEAB溶解蛋白沉淀;按胰蛋白酶与蛋白质量比1∶25加入胰蛋白酶,于37℃反应过夜.
从低温冰箱里取出2组六标TMT试剂(126,127N,127C,128N,128C和131),室温下平衡10 min后每管加入41 μL质谱纯乙腈混合均匀使其溶解,按表1所示分别加入到相应的2组酶解肽段中,室温下反应2 h;每管中加入8 μL 5%羟胺于室温下孵育30 min以终止标记反应;2组均取等量标记肽段混合冻干.
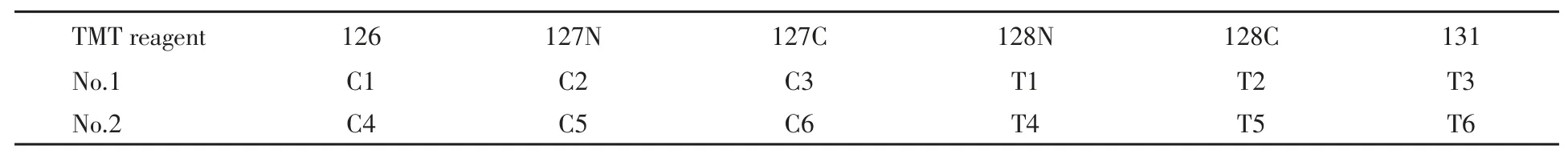
Table 1 TMT reagents of the corresponding samples
用600 μL 0.1%TFA复溶冻干的2组已标记肽段;用1 mL甲醇活化C18柱,1 mL 0.1%TFA平衡柱子;将复溶的标记肽段上样到平衡好的C18柱上;用0.1%TFA清洗3次后,依次用300 μL 140%ACN+0.1%TFA,300 μL 60%ACN+0.1%TFA洗脱肽段;将2次洗脱液合并混合均匀后冻干,待磷酸化富集实验.
1.2.3 SMOAC法磷酸化肽富集SMOAC连续富集法分为MOAC富集和IMAC富集2步,依次使用TiO2磷酸化富集试剂盒及Fe-NTA磷酸化富集试剂盒完成.MOAC富集:取TiO2小柱用洗涤缓冲液清洗1次,再用结合/平衡缓冲液平衡1次;将1.2.2节标记后脱盐冻干的肽段混合物用结合/平衡缓冲液重新溶解,转移到平衡过的TiO2小柱内以1000 r/min转速离心5 min以结合磷酸肽,离心得到的流穿液再转移到TiO2小柱内重复结合1次,收集流穿液;之后依次用结合/平衡缓冲液、洗涤缓冲液、质谱纯水洗涤TiO2小柱,收集这3种清洗液,并与流穿液合并、冻干;分2次用50 μL磷酸化肽段洗脱缓冲液从洗涤过的TiO2小柱中洗脱出与TiO2结合的磷酸化肽(TiO2洗脱液),并立即进行真空离心冻干.IMAC富集:取Fe-NTA树脂柱用试剂盒里的结合/洗涤缓冲液清洗平衡2次;将上述经TiO2富集后的流穿馏分和清洗馏分合并冻干,之后重新溶解于结合/洗涤缓冲液中,并转移到平衡过的Fe-NTA树脂柱中,室温下孵育30 min后以1000 r/min转速离心30 s;用结合/洗涤缓冲液洗涤Fe-NTA树脂柱3次,再用质谱纯水洗涤1次;分2次用100 μL磷酸化肽段洗脱缓冲液从洗涤过的树脂柱中洗脱出磷酸化肽段(Fe-NTA洗脱液),立即进行真空离心冻干.
需要特别注意的是,2次富集用到的缓冲液来源于各自的试剂盒,不能混用.该富集实验采用1.2.2节的2组标记肽段平行进行2组,其中一组将2次洗脱下来的磷酸化肽段合并后进行质谱分析,另一组分别进行质谱分析.另外,为了尽量确保2组分析的上样量一致,前者合并后取一半进行质谱分析,后者全部进行质谱分析.
1.2.4 液相色谱-质谱联用分析经富集后的磷酸化肽段用Thermo Scientific™Easy-nLC1200型超高效液相色谱仪与Orbitrap Exploris 480型高分辨质谱仪联用进行LC MS/MS实验.
色谱条件:C18反相色谱柱(75 μm×500 mm,2 μm,10 nm);流动相:A相为0.1%FA水溶液,B相为80%ACN+0.1%FA溶液;流速300 nL/min;洗脱梯度:0~170 min,2%~20%B;170~174 min,20%~30%B;174~175 min,30%~100%B;175~180 min,100%B.
质谱条件:正离子模式检测;一级质谱分辨率120 K,采集的质量扫描范围为m/z400~1600;采集模式为数据依赖采集,Normalized AGC target(%)设为300,Maximum injection time设为50×10-3s,检测的肽段所带电荷数为2~5,动态排除时间20 s;二级分辨率30 K,Normalized AGC target(%)设为100,Maximum injection time 50×10-3s,二级碎裂模式HCD.
1.2.5 数据库检索质谱数据使用Proteome Discoverer 2.4(Thermo Fisher Scientific)内嵌(Sequest HT)软件进行分析,以Swiss Prot_human为数据库搜库.搜库参数:peptide mass tolerance=10×10-6;enzyme=trypsin;fragment mass tolerance=0.02 u;固定修饰(Fixed modification):TMT6plex(N-term),Carbamidomethyl(C),TMT6plex(K);可变修饰(Variable modification):oxidation(M),acetyl(protein N-term),deamidated(NQ),phosphorylation(S/T/Y);漏切上限(Max missed cleavage)设为2;Site probabilities>75;蛋白假阳性率(False discovery rate,FDR)设为1%.
2 结果与讨论
2.1 实验方法
磷酸化是细胞内最常见的共价修饰方式之一,在各种生理和病理过程中起到重要作用.磷酸化肽段丰度低,不易检出;同时非磷酸化肽的存在会抑制磷酸肽的电离,影响其信号.因此,在质谱分析之前必须要从肽段中分离出磷酸化肽.目前已开发出的多种磷酸化富集方法对磷酸化肽段的富集都有一定的选择性和偏向性,没有任何单独的一种方法能够全面地分离出所有的磷酸化肽.为了提高磷酸化肽段的回收率,尽可能全面地获得样品中的磷酸化肽,本文探索了一种连续互补的富集方法SMOAC来富集磷酸化肽.同时,考虑到常规的磷酸化起始富集需要1 mg的蛋白起始量,为了减少样品需求量,也为了避免每个样品分别富集引入的差异,本文结合TMT等重标记的优势,将待分析的各个样品等重标记并混合后进行富集(具体实验流程如图1).对6例经紫草素处理的和6例未经处理的正常人肝癌细胞HepG2细胞蛋白质进行提取,每个取100 μg蛋白进行还原、烷基化后,分2组(每组3例紫草素处理组+3例正常对照组)用TMT试剂标记,分别混合后进行脱盐、冻干处理.冻干后的肽段先经过TiO2富集,收集洗脱液,即富集后的肽段,流穿液和清洗液冻干后再用Fe-NTA进行第二次磷酸化肽富集,收集洗脱液.为了更完整地评价SMOAC方法,找到获得其质谱数据最有效的分析方式,将2组等量的标记肽段混合物同时进行2组SMOAC富集,每组各有2种洗脱液(TiO2洗脱液和Fe-NTA洗脱液),分3次进行LC-MS/MS分析:一组的2种洗脱液单独分析(图1中①和②),另一组的2种洗脱液合并后一起分析(图1中③).为了保证2组的上样量一致,前者全部用来质谱分析,后者合并后取一半进行质谱分析;为了减少样品损失,同时更充分地鉴定磷酸化肽,我们采用3 h长梯度进行LC-MS/MS分析,分别用Proteome Discoverer 2.4软件检索,对比2种分析方式,探索酶解肽段经SMOAC富集后采集磷酸化肽的有效方式.

Fig.1 Flow chart of analysis
2.2 TiO2洗脱液与Fe-NTA洗脱液鉴定结果分析
从TiO2洗脱液中共鉴定到2467个磷酸化蛋白上7445条磷酸化肽段,肽段特异性约为97%,其中单磷酸化肽段占57.6%,双磷酸化肽占31.4%,三磷酸化肽占11.0%.从二次富集的Fe-NTA洗脱液中共鉴定到3604个磷酸化的蛋白上11297条磷酸化肽段,肽段特异性约为87%,其中单磷酸化肽段占98.3%,双磷酸化肽占1.0%,三磷酸化肽占0.1%(图2).

Fig.2 Analysis results of the amount of peptides identified from TiO2 eluate and Fe eluate by LC⁃MS
由于连续富集的2次洗脱液中磷酸化肽段存在交盖(占总磷酸化肽段的22.1%),故共鉴定到3946个磷酸化蛋白上15349条磷酸化肽段,其中有52%的总磷酸化肽段是只在二次富集的Fe-NTA洗脱液中鉴定到的,而只在首次富集的TiO2洗脱液中鉴定到的磷酸化肽仅占26.4%,单磷酸化肽中有64%是只在Fe-NTA洗脱液中鉴定到的,占单磷酸化肽总数的50%以上,而大部分多磷酸化肽是从首次富集的TiO2洗脱液中鉴定到的;TiO2洗脱液与Fe-NTA洗脱液共鉴定到磷酸化蛋白3946个,其中交盖的蛋白约占54%,只在Fe-NTA洗脱液中鉴定到的约占总鉴定量的37.5%(图3).

Fig.3 Analysis results of the overlap of peptides and proteins identified from TiO2 eluate and Fe⁃NTA eluate by LC⁃MS
以上结果说明了在处理高度复杂的混合物时分析这些通常被丢弃的部分(流穿液和清洗液)的重要性.肽段混合物经TiO2富集后会有一些未能结合在TiO2上的磷酸化肽段或结合不紧密的磷酸化肽段存在于流穿液或清洗液中,将其冻干后再用Fe-NTA进行二次富集,可有效减少磷酸化肽的损失,提高磷酸化肽富集的特异性及鉴定的灵敏度.虽然这种连续富集的策略(SMOAC)需要1次额外的富集步骤,但是工作量远比将肽段混合物分馏后再进行多次磷酸肽富集的工作量要低得多.总之,在分析复杂生物样品的磷酸化蛋白质组过程中,SMOAC是一种快速简便且高效的方法,可显著提高大规模定量磷酸化蛋白质组学的水平.
2.3 两次洗脱液合并质谱分析与分别质谱分析结果比较
2.3.1 磷酸化肽段及位点比较如图4所示,将2次洗脱液合并进行质谱分析与分别进行质谱分析相比,鉴定到的总磷酸化肽段数提高了6%,单磷酸化肽段占所有肽段的比例提高14%,但多磷酸化肽段比例降低了7%.2次洗脱液合并分析鉴定到的总磷酸化肽段较多,说明TiO2洗脱液和Fe-NTA洗脱液中有一些共有的磷酸化肽段,由于丰度较低,在分别分析时未能被质谱检测到,将2次洗脱液合并后信号强度提高而被质谱检测到;鉴定到的单磷酸化占比提高,表明合并后磷酸化信号强度的升高主要得益于单磷酸化肽段丰度的提高;而多磷酸化肽大多数在TiO2洗脱液中鉴定到,合并质谱分析发现其比例反而降低,可能是由于单磷酸肽强度的升高使得其对多磷酸化肽电离化的抑制作用增强[18,26],从而降低了被质谱检测到的机会.综上,SMOAC的2次洗脱液合并分析得到的总磷酸化肽段更多,分别分析得到的多磷酸化肽更多.

Fig.4 Comparison of the amount of phosphopeptides identified from two types of analysis
2.3.2 磷酸化蛋白鉴定及定量比较2次洗脱液分别分析定量得到3946个磷酸化蛋白(FDR<1%),占总鉴定量的91.4%;合并分析定量得到4263个磷酸化蛋白(FDR<1%),占总鉴定量的90.3%.这说明SMOAC能够有效富集TMT标记的磷酸化肽段,利用TMT等重标记技术结合SMOAC富集技术实现磷酸化蛋白质组的高通量定量是可行的.即使是低于1 mg的少量生物样本,该策略也能对其磷酸化蛋白质组进行全面的定量分析,也说明将2次洗脱液合并进行质谱分析得到的磷酸化蛋白更多.
2.4 组内重复标记间相关性分析
由于在样品前处理过程中标记肽段的混合发生在比较早的阶段(富集和质谱分析之前),因此,等量标记最重要的优点之一是提高了实验重现性.为了评价SMOAC富集TMT标记肽段这一流程的可重复性,分析了对照组和处理组组内重复通道间的信号强度.经数据库检索后,将1个通道中的lg Abundances与另一个重复通道中的lg Abundances进行了对比.如图5所示,组内各2个重复间磷酸化蛋白的强度非常好地相关(R>0.95),表明标记肽段用SMOAC方法富集以后出现的变化较小,实验重复性良好.

Fig.5 Scatterplots reflecting correlation of protein abundances in technical replicates
2.5 差异磷酸化蛋白结果分析
采用Student’s T-test,以磷酸化蛋白质在经紫草素处理的及正常的HepG2细胞中表达含量作为参考,在SMOAC 2次洗脱液合并分析的数据中找出具有显著差异的磷酸化蛋白1961种(以P<0.05,表达量±20%为差异[27,28]),其中上调1397种,下调564种.

Fig.6 Scatter plot of enriched KEGG pathways statistics
为了鉴定经紫草素处理后细胞中涉及的信号通路,使用DAVID软件对鉴定到的差异表达的磷酸化蛋白进行KEGG(Kyoto encyclopedia of genes and genomes,京都基因与基因组百科全书)信号通路分析,发现定量到的差异磷酸化蛋白在32种KEGG通路中显著富集(P≤0.05,表S1,见本文支持信息).图6示出了前10个富集通路,主要包括DNA复制、RNA转运、核糖体生成、蛋白酶体、剪接体和mRNA监视通路等,意味着紫草素可能主要通过影响遗传物质的生成来抑制HepG2细胞的增殖及生长,与已有研究结果相符[25].
综上所述,为寻找快速、简便且能够全面定量磷酸化蛋白质组的技术,提出了一种灵敏、高效、高通量定量磷酸化蛋白质组的策略:TMT10-plex标记定量技术结合连续互补的磷酸化肽富集法SMOAC.结果表明,SMOAC能够有效富集TMT10-plex标记的磷酸化肽段,包括多磷酸化肽和单磷酸化肽;并且其特异性强、灵敏度高、工作量少,不需要将混合的标记肽段分馏后多次富集,只需要一次额外的富集步骤;即使是低于1 mg的少量复杂生物样本,也能对其差异表达的磷酸化蛋白进行相对全面的定量分析.将该策略与高精度高灵敏度质谱仪结合,可使每组样品只需要3 h质谱分析时间即能识别大量的磷酸化位点,极大提高了磷酸化蛋白质组学的定量水平.此外,实验使用6个TMT试剂标记了处理组与对照组各3例样品的肽段,实现了1次SMOAC富集加1次质谱分析同时分析定量6个生物样品磷酸化蛋白质组的目的.如果用TMTpro 16-plex标记试剂(美国Thermo Scientific),最多可一次性分析16个样本,由于富集前需要将标记肽段全部混合,每个样品只需要50 μg就能得到理想的效果.该策略为标准化磷蛋白质组标记定量技术提供了参考.
感谢复旦大学生物医学研究院公共技术平台蛋白质子平台周新文老师和刘晓慧老师分别在质谱采集和报告撰写方面提供的帮助.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20210406.
